Dinámicas complejas en el desarrollo del primer segmento tarsal de Drosophila melanogaster.
Complex dynamics in the development of the first tarsal segment of Drosophila melanogaster
DOI:
https://doi.org/10.15446/abc.v21n3.53778Palabras clave:
auto-organización, peines sexuales, rotación (es)rotation, sex combs, self-organization. (en)
Descargas
La interacción de grupos de genes, proteínas, y células es necesaria para el desarrollo de un organismo multicelular. Por tal motivo, la teoría de la complejidad puede ser una herramienta indispensable para entender cómo diversos procesos embriológicos y evolutivos suceden. Sin embargo, en la mayoría de los programas de investigación estas áreas permanecen aisladas. En un esfuerzo por crear un punto de integración entre el Evo-Devo y las ciencias de la complejidad, en este documento propongo que las dinámicas celulares de epitelios pueden tener comportamientos que se asemejan a los encontrados en sistemas complejos. Dichas dinámicas celulares, además de regular la densidad celular de los epitelios, pueden conferir alta evolucionabilidad a estos tejidos. Para lograr este objetivo, utilizo como sistema el desarrollo del primer segmento tarsal de las patas anteriores de Drosophila melanogaster. Primero doy un ejemplo en el cual dinámicas aleatorias a nivel celular pueden generar la emergencia de patrones organizados a nivel del tejido. En seguida muestro como la modificación de características morfológicas del epitelio puede generar dinámicas celulares altamente organizadas o por el contrario aleatorios. Como resultado, planteó que el desarrollo de los epitelios muestra rasgos de comportamientos complejos y propone que la retro-alimentación entre tensión mecánica y procesos celulares son básicos para entender cómo se desarrollan y evolucionan los organismos multicelulares. Estos estudios ponen en evidencia las bases mecánicas de procesos complejos que conectan diversos niveles de organización.
Gene, protein and cell interactions are vital for the development of a multicellular organism. As a result, complexity theory can be a fundamental tool to understand how diverse developmental and evolutionary processes occur. However, in most scientific programs these two fields are separated. In an effort to create a connection between the Evo-devo and complexity science, this article shows how the cell dynamics of epithelia can display behaviours with similar features to complex systems. Here, I propose that these cell dynamics, in addition to control cell density in epithelia, can provide high evolvability to this type of tissue. To achieve this goal, I used a as a systems the development of Drosophila melanogaster front legs. First, I provide an example in which order at the tissue level emerge from apparently random cell dynamics. Then, I show that small modifications in epithelial cellular components can produce highly organized or the opposite random cell dynamics. Therefore, this work shows that a developing epithelium displays signs of complex behaviours and I propose that the feedback between tension and cellular processes are key for understanding how multicellular organisms development and evolve. Such studies may reveal the mechanistic basis of complex processes that bridge several levels of organization.
DOI: https://doi.org/10.15446/abc.v21n3.53778
DINÁMICAS COMPLEJAS EN EL DESARROLLO DEL PRIMER SEGMENTO TARSAL DE Drosophila melanogaster
Complex Dynamics in the Development of the First Tarsal Segment of Drosophila melanogaster
Juan Nicolás MALAGON1.
1 Department of Cell and Systems Biology, University of Toronto. 25 Harbord Street. Toronto, Canadá.
For correspondence. nicolasmalagon@gmail.com
Received: 28th October 2015, Returned for revision: 17th May 2016, Accepted: 24th June 2016.
Associate Editor: Graciela Bailliet.
Citation/Citar este artículo como. Malagon JN. Dinámicas complejas en el desarrollo del primer segmento tarsal de Drosophila melanogaster. Acta biol. Colomb. 2016;21(3):495-500. DOI: https://doi.org/10.15446/abc.v21n3.53778
El tema de este artículo fue presentado en el V Simposio Colombiano de Biología Evolutiva organizado por la Red Colombiana de Biología Evolutiva (COLEVOL) y sometido por invitación de la revista Acta Biológica Colombiana con el fin de incentivar la investigación en el área de biología evolutiva.
RESUMEN
La interacción de grupos de genes, proteínas, y células es necesaria para el desarrollo de un organismo multicelular. Por tal motivo, la teoría de la complejidad puede ser una herramienta indispensable para entender cómo diversos procesos embriológicos y evolutivos suceden. Sin embargo, en la mayoría de los programas de investigación estas áreas permanecen aisladas. En un esfuerzo por crear un punto de integración entre el Evo-Devo y las ciencias de la complejidad, en este documento propongo que las dinámicas celulares de epitelios pueden tener comportamientos que se asemejan a los encontrados en sistemas complejos. Dichas dinámicas celulares, además de regular la densidad celular de los epitelios, pueden conferir alta evolucionabilidad a estos tejidos. Para lograr este objetivo, utilizo como sistema el desarrollo del primer segmento tarsal de las patas anteriores de Drosophila melanogaster. Primero doy un ejemplo en el cual dinámicas aleatorias a nivel celular pueden generar la emergencia de patrones organizados a nivel del tejido. En seguida muestro como la modificación de características morfológicas del epitelio puede generar dinámicas celulares altamente organizadas o por el contrario aleatorios. Como resultado, planteó que el desarrollo de los epitelios muestra rasgos de comportamientos complejos y propone que la retro-alimentación entre tensión mecánica y procesos celulares son básicos para entender cómo se desarrollan y evolucionan los organismos multicelulares. Estos estudios ponen en evidencia las bases mecánicas de procesos complejos que conectan diversos niveles de organización.
Palabras clave: auto-organización, peines sexuales, rotación.
ABSTRACT
Gene, protein and cell interactions are vital for the development of a multicellular organism. As a result, complexity theory can be a fundamental tool to understand how diverse developmental and evolutionary processes occur. However, in most scientific programs these two fields are separated. In an effort to create a connection between the Evo-devo and complexity science, this article shows how the cell dynamics of epithelia can display behaviours with similar features to complex systems. Here, I propose that these cell dynamics, in addition to control cell density in epithelia, can provide high evolvability to this type of tissue. To achieve this goal, I used a as a systems the development of Drosophila melanogaster front legs. First, I provide an example in which order at the tissue level emerge from apparently random cell dynamics. Then, I show that small modifications in epithelial cellular components can produce highly organized or the opposite random cell dynamics. Therefore, this work shows that a developing epithelium displays signs of complex behaviours and I propose that the feedback between tension and cellular processes are key for understanding how multicellular organisms development and evolve. Such studies may reveal the mechanistic basis of complex processes that bridge several levels of organization.
Keywords: rotation, sex combs, self-organization.
INTRODUCCIÓN
La teoría de la complejidad ha revolucionado la forma en la que entendemos los sistemas físicos y naturales, desde el comportamiento de la bolsa hasta la meteorología (Sole y Brian, 2000) En particular en la biología, el estudio de la complejidad y la auto-organización parece ser fundamental para entender el comportamiento de sistemas a diferentes niveles jerárquicos (Andrade, 2003; Andrade, 2009) Algunos ejemplos a nivel molecular y celular incluyen los patrones espaciales de crecimiento en colonias de bacterias (Sole y Gould, 2000), la formación de microtúbulos (Karsenti, 2008) y los patrones de conectividad de proteínas y metabolitos (Albert y Barabasi, 2000; Barabási y Bonabeau, 2003) A nivel macroscópico, los ejemplos también abundan, como es el caso de los patrones de vuelo en aves, el movimiento de cardúmenes de peces (Camazine, 2001), y la construcción de termiteros (Turner, 2007)
En mi opinión, una de las aplicaciones más importantes de la teoría de la complejidad es entender cómo se desarrollan y evolucionan los organismos. Un sistema complejo está compuesto por varias partes, las cuales presentan diferentes grados de interacción (Sole y Brian, 2000) Basado en esta definición, genoma, proteoma y metaboloma pueden ser estudiados como un sistema complejo (Jeong y Albert, 2000; Jeong et al 2001; Sole, 2009) De igual manera, la formación de tejidos y órganos también puede estar regida por leyes de diseño de comportamientos complejos ya que están compuestos por grupos de células (Dobrescu y Purcarea, 2011) En este artículo, propongo que los procesos celulares que conllevan al desarrollo de los tejidos epiteliales pueden ser mejor entendidos dentro del marco de los sistemas complejos. Para lograr este objetivo, se utilizó como sistema el proceso de rotación de los peines sexuales (PS) de Drosophila melanogaster.
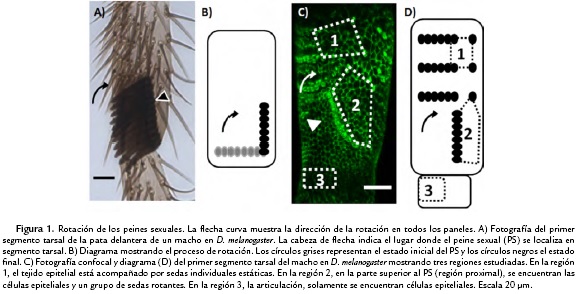
Los PS son un grupo de sedas (pelos) con una coloración oscura y puntas redondas localizados en las patas delanteras de los machos en D. melanogaster (Fig. 1A) (True, 2008; Tanaka et al, 2011; Malagon y Khan, en prensa) Este conjunto de sedas es utilizado por el macho para agarrar a la hembra durante el rito de cortejo (Tanaka et al, 2011) Una de los rasgos más interesantes de los PS en D. melanogaster es que cambian de posición durante el desarrollo, rotando aproximadamente 90 grados (Held et al, 2004) (Fig. 1B). El PS está rodeado por células epiteliales, las cuales experimentan múltiples procesos celulares durante la rotación (Atallah, 2008; Tanaka et al., 2009; Malagon, 2013) Para entender cómo sucede este proceso, realicé una detallada caracterización de los procesos celulares que ocurren durante la rotación y posteriormente comparé con otras regiones del primer segmento tarsal (Fig. 1C-D). Como resultado encontré que las células epiteliales que rodean al PS presentan simultáneamente varios procesos celulares, cambiando su tamaño apical, intercambiando vecinos, y en algunos casos, abandonando el epitelio para probablemente morir posteriormente (Malagon, 2013) De forma inesperada, encontré que dichos procesos celulares siguen dinámicas que se asemejan a comportamientos descritos en varios sistemas complejos, como la emergencia de patrones organizados basados en secuencia de eventos aleatorios y diferente grado de predictibilidad entre sistemas.
JUEGO DEL CAOS Y ROTACIÓN DE LOS PEINES SEXUALES: EMERGENCIA DE PATRONES ORGANIZADOS BASADO EN SECUENCIA DE EVENTOS ALEATORIOS
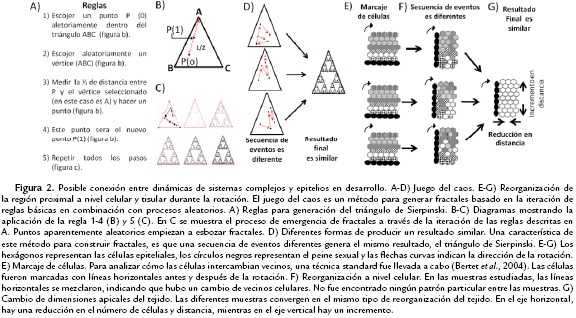
El triángulo de Sierpinski es un ejemplo sorprendente de organización, en el cual un fractal es construido a partir de cualquier triángulo (Rubiano, 2009) Como resultado, en el interior de este triángulo aparecen triángulos que se repiten a diferentes escalas (Fig. 2A-D). La formación del triángulo Sierpinski a través del "juego del caos", es un ejemplo de un sistema en el cual un conjunto de reglas básicas y procesos aleatorios pueden generar la emergencia de orden. Una característica esencial del juego del caos, es que bajo este conjunto de reglas el sistema inevitablemente llegará al mismo resultado: la emergencia de triángulos a diferentes escalas (Fig. 2D). Sin embargo, la serie de eventos por la cual se obtiene este resultado puede ser distinta en cada ocasión, por lo que es imposible predecir los estados intermedios del sistema. En este caso, el sistema llega de forma diferente al mismo resultado.
De igual forma que el triángulo de Sierpinski, las dinámicas celulares durante la rotación siguen una secuencia de eventos diferentes en cada una de las muestras estudiadas, pero como resultado final emerge un patrón global (Malagon, 2013) En este ensayo, me concentraré en describir los patrones espacio-temporales del intercambio de vecinos celulares. Estos procesos celulares son fundamentales durante morfogénesis y han sido ampliamente estudiados (Bertet et al., 2004; Blankenship et al, 2006; Marinari et al., 2012)
Para verificar si las células cambian de vecinos durante la rotación, líneas horizontales con diferentes colores fueron realizadas en cada célula a lo largo del tejido estudiado (Fig. 2E-F). Si las células no intercambian vecinos, al finalizar la rotación, las mismas líneas se deben conservar. Por el contrario, el que las líneas se mezclen es un indicador de que el tejido modifica sus vecinos celulares durante el desarrollo (Bertet et al., 2004; Blankenship et al., 2006) El análisis de videos del desarrollo de los PS arrojó resultados inesperados, mostrando que en la parte superior del PS (región proximal), las células cambian vecinos sin mostrar un patrón particular. Mientras algunos grupos celulares rotan en la misma dirección que el PS, otros grupos rotan en la dirección opuesta, y en algunos casos se observan células que no intercambian vecinos celulares (Fig. 2E-F). Además, los patrones son diferentes en cada una de las muestras estudiadas. Por consiguiente, fue imposible predecir los patrones de reorganización de vecinos celulares durante la rotación (Fig. 2F).
A diferencia del nivel celular, los procesos de reorganización son predecibles y similares entre cada una de las patas estudiadas en el nivel tisular. En todos los casos estudiados, el tejido se alarga, incrementando su número de células y distancia en el eje vertical, mientras reduce el número de células y distancia en el eje horizontal (Fig. 2G). Además, el área apical del tejido se reduce casi a la mitad (Malagon, 2013) Esta diferencia entre estos dos niveles también puede ser observada en otros procesos celulares, como la desaparición de células del epitelio (Malagon, 2013; Malagon y Larsen, 2015)
Para analizar si esta paradoja entre la baja predictibilidad de las dinámicas celulares y la alta predictibilidad es exclusiva del PS, fue necesario estudiar el desarrollo de tejidos epiteliales de otras regiones de las patas de D. melanogaster. Además caractericé dos regiones adicionales, una conformada exclusivamente por células epiteliales, y otra constituida de una combinación de células epiteliales y sedas individuales (Fig. 1C-D, regiones 1 y 3). Los resultados obtenidos muestran de nuevo una conexión con estudios en sistemas complejos.
ORDEN, DESORDEN, Y FASE DE TRANSICIÓN
Uno de los ideales de la ciencia es el control y la predicción de los diferentes fenómenos que nos rodean (Sole, 2000). La teoría de la complejidad ha modificado dicho paradigma, y ha mostrado que aunque hay sistemas cuyas dinámicas son altamente predecibles, en otros sistemas su comportamiento no se puede predecir a largo plazo (Fig. 3). Por ejemplo, el movimiento de un péndulo simple es relativamente fácil de determinar, produciendo oscilaciones de frecuencias regulares. Sin embargo, este sistema que parece tan regular puede producir oscilaciones con frecuencias caóticas al unir dos péndulos simples uno colgado del otro (péndulo doble). Además, los sistemas pueden presentar también comportamientos complejos, mostrando nuevos patrones que no pueden ser explicados al analizar las partes por separado, como en el caso del termitero (Turner, 2007) y el juego del caos (Rubiano, 2009).
Las diferencias entre estos tres tipos de comportamientos no son tan abruptas como podría esperarse. Una simple modificación en las reglas de dichos sistemas es suficiente para transformar un sistema altamente organizado en uno desorganizado, o en uno en el que emergen fractales (Kauffman, 1995; Sole, 2011) Por lo tanto, si cambiáramos las reglas de los epitelios podríamos obtener tejidos con dinámicas celulares predecibles o totalmente impredecibles, teóricamente hablando.
Para verificar esta hipótesis, describí las dinámicas celulares en dos regiones adicionales de las patas de D. melanogaster, la articulación entre el primer y el segundo segmento tarsal, y una sección del primer segmento tarsal (Fig. 3). En estas dos regiones no existe el proceso de rotación y las células se mueven de una forma relativamente homogénea hacia la región proximal (región superior) (Malagon, 2013) Además, en dichas regiones, en lugar de sedas rotantes, existen sedas individuales o no hay presencia de sedas. Al estudiar las dinámicas celulares de estas regiones encontré que los procesos celulares presentan rangos de predictibilidad que se asemejan tanto al sistema ordenado como al sistema caótico (Malagon, 2013)
En la región de la articulación (Fig. 3), los procesos celulares son altamente predecibles. Las células rara vez intercambian vecinos y en muy pocos casos abandonan el epitelio. Estas regiones se asemejan al estado de orden. Por el contrario, en las regiones donde encontramos sedas individuales (Fig. 3), los comportamientos celulares describen patrones espacio-temporales que son difíciles de predecir. Las células constantemente intercambian vecinos, pero la forma en la que ocurren dichos cambios presenta una alta variabilidad (Malagon, 2013 ) Se podría decir que los procesos de reorganización celular son diferentes en cada una de las muestras estudiadas. De igual forma, es imposible predecir cuales células van a desaparecer durante el desarrollo, en qué lugar, o en qué intervalo de tiempo. Por tal motivo, considero que el comportamiento de esta región se asemeja al estado de desorden.
Las semejanzas mostradas entre las dinámicas celulares y los sistemas complejos son simplemente el primer paso para considerar si realmente los principios de complejidad pueden ser aplicados al desarrollo de epitelios. Para finalizar, planteo como la retro-alimentación entre fuerzas mecánicas y procesos celulares pueden ser un mecanismo potencial para explicar las dinámicas celulares descritas y analizo sus posibles implicaciones evolutivas.
RETRO-ALIMENTACION ENTRE FUEZAS MECÁNICAS Y PROCESOS CELULARES
El triángulo de Sierpinski no es el único ejemplo de organización que puede aparecer por la interacción de reglas básicas. Por ejemplo, también se puede generar fractales formados por cuadrados, pentágonos, y hexágonos (Rubiano, 2009) De igual forma, la emergencia de patrones organizados en epitelios debe ser posible bajo condiciones diferentes a la rotación de los PS. El desarrollo del noto, en la región dorsal del segmento torácico de D. melanogaster, puede ser un ejemplo.
Marinari et al. (2012) describieron los procesos celulares durante la morfogénesis del noto y mostraron que al igual que en el caso de los PS, las células desaparecen e intercambian vecinos de forma impredecible. No obstante al analizar el resultado a nivel del tejido, la aparición de algunos patrones espaciales fue evidente. Diferentes tipos de evidencias mostraron que la sección del tejido donde las células desaparecen se encontraba bajo un mayor grado de tensión. Además, la disminución o el incremento en el grado de proliferación celular permitió establecer la siguiente correlación: a mayor densidad celular del tejido (número de células por área), mayor el número de células que desaparecen del epitelio durante el desarrollo. Basado en estas y otras evidencias, dicho estudio concluyó que este tipo de muerte selectiva de células y reorganización del tejido es un mecanismo para ajustar el número de células en el tejido en un espacio determinado (Eisenhoffer et al., 2012; Fernandez - Gonzalez y Zallen, 2012) Los excesos de proliferación celular, son eliminados con base simplemente en el grado de tensión a lo largo del tejido. Simulaciones posteriores mostraron que las dinámicas celulares descritas en el noto podían emerger de reglas básicas, mediante las cuales el tejido liberaba tensión mientras buscaba el equilibrio termodinámico.
En el caso de los PS algo similar parece suceder, pero con una pequeña modificación: la presencia de sedas rotantes. Atallah (2009) demostró que una hilera de sedas, como el PS, actúan como barreras impidiendo el movimiento de las células epiteliales. En el caso del PS, la fuerza que mueve las sedas aparentemente se origina del incremento en tamaño apical de las células distales al PS (Malagon, 2013) Mi hipótesis es que las dinámicas celulares descritas en este artículo, ocurren como una respuesta pasiva a la rotación. Mientras en el noto dichos procesos celulares ocurren como mecanismo para liberar tensión en el tejido debido a un exceso de proliferación celular, en el PS estos comportamientos pueden ocurrir por la reducción en el espacio debido a la rotación. Esta hipótesis parece explicar las dinámicas celulares descritas en este ensayo (Malagon y Larsen, 2015)
Para concluir considero que futuros análisis de los PS son necesarios para verificar y expandir las hipótesis que propuse en este documento. En particular, para explorar cómo cambian las dinámicas celulares a nivel evolutivo. Aunque en el caso del noto, la retro-alimentación entre fuerzas mecánicas y procesos celulares generan una estabilidad en la densidad celular en los epitelios (Marinari, 2011), en el caso de los PS, esta retro-alimentación parece otorgar alta evolucionabilidad morfológica a este grupo de sedas. Por ejemplo, los cambios dramáticos en el ángulo de rotación entre especies cercanas de Drosophila pueden ser explicados en términos de la retro-alimentación de fuerzas mecánicas y procesos celulares. Dado que la rotación del tejido en la región proximal superior del PS experimenta mayor tensión, en el epitelio tiene lugar una alta reorganización celular. Sin embargo, dichos ajustes sucederán automáticamente, por lo tanto el sistema no necesita expresar nuevos genes en la ontogenia y/o fijar nuevos genes en la filogenia.
De igual forma, otro cambio morfológico como la variabilidad en número de sedas por PS (Ahuja y Singh, 2008) son fácilmente amortiguados utilizando esta retro-alimentación por medio fuerzas mecánicas. Por ejemplo, al incrementar el tamaño de los PS se producen cambios dramáticos en la dinámicas celulares, pero rasgos del fenotipo final como el ángulo de rotación y la elongación del tejido es similar al fenotipo normal (Malagon, 2013) Futuros estudios pueden verificar, si en otros casos, cambios alométricos pueden suceder fácilmente en los tejidos epiteliales debido ajustes mecánicos como el descrito en los PS.
En este artículo exploré posibles reglas que gobiernan el desarrollo y la evolución de los tejidos epiteliales. Considero que este tipos de estudios complementan los análisis genéticos y permiten acércanos a una visión integral de la biología.
AGRADECIMIENTOS
Agradezco a la profesora Ellen Larsen y Eugenio Andrade por su apoyo en las diferentes etapas de mi carrera profesional.
REFERENCIAS
Ahuja A, Singh RS. Variation and evolution of male sex combs in Drosophila: nature of selection response and theories of genetic variation for sexual traits. Genetics. 2008;179(1):503-509. Doi:10.1534/genetics.107.086363.
Albert R, Barabasi A. Topology of evolving networks: local events and universality. Phy. Rev. Lett. 2000;85(24):5234-5237. Doi:10.1103/PhysRevLett.85.5234.
Andrade E. Los demonios de Darwin: Semiótica y termodinámica de la evolución biológica. Bogotá: Editiorial Universidad Nacional de Colombia; 2003. p. XXVIII-XXIX.
Andrade E. La ontogenia del pensamiento evolutivo. Bogotá: Editiorial Universidad Nacional de Colombia. Bogotá; 2009. p. 107-109.
Atallah J. The development and evolution of complex patterns: the Drosophila Sex Comb as a model System (PhD thesis). Toronto: University of Toronto, Department of Cell and Systems Biology; University of Toronto. 2008; p. 45-90.
Ball P. The self-made tapestry: pattern formation in nature. New York: Oxford University Press; 2008. p. 30-50.
Barabasi A, Bonabeau E. Scale-free networks. Sci Am. 2003;288(5):50-59. Doi:10.1038/scientificamerican0503-60.
Bertet C, Sulak L, Lecuit T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 2004;429(6992):667-671. Doi:10.1038/nature02590.
Blankenship JT, Backovic ST, Sanny JSP, Weitz O, Zallen JA. Multicellular Rosette Formation Links Planar Cell Polarity to Tissue Morphogenesis. Dev Cell. 2006;11(4):459-470. Doi :10.1016/j.devcel2006.09.007.
Camazine S, Deneuborg, J.-L., Franks, N.R., Sneyd, J., Theraulaz, G. Bonabeau, E. Self-organization in Biological Systems, Princenton: Princeton University Press. 2001. p. 11-13.
Dobrescu R, Purcarea V. Emergence, self-organization and morphogenesis in biological structures. J Med Life. 2011;4(1):82-90.
Eishenhoffer GT, Loftus PD, Yoshigi M, Otsuna H, Chien CB, Morscos PA, et al. Crowding induces live cell extrusion to maintain homeostatic cell numbers in epithelia. Nature. 2012;484 (7395):546-549. Doi:10.1038/nature10999.
Fernandez-Gonzalez R, Zallen JA. Feeling the squeeze: live-cell extrusion limits cell density in epithelia. Cell. 2012;149(5):965-967. Doi: 10.1016/j.cell2012.05.006.
Held L, Grimson M, Du Z. Proving an old prediction: the sex comb rotates at 16 to 24 hours after pupariation. Dros Inf Serv. 2004;87(1):76-78.
Jeong H, Albert R. The large-scale organization of metabolic networks. Nature. 2000;760 (6804):651-654. Doi:10.1038/35036627.
Jeong H, Mason SP, Barabasi AL, Oltavi ZN. Lethality and centrality in protein networks. Nature. 2001;411:41-42. Doi:10.1038/35075138.
Karsenti E. Self-organization in cell biology: a brief history. Nat Rev. 2008;9(3):255-262. Doi:10.1038/nrm2357.
Kauffman SA. At the home in the universe. New York: Oxford University Press; 1995. p. 20-25.
Malagon JN, Waleed K. Evolution of allometric changes in fruit fly legs: a developmentally entrenched story. Acta biol Colomb. 2016 21(3). Doi: https://doi.org/10.15446/abc.v21n3.53650.
Malagon JN. Sex combs in motion: Cellular processes involved in sex comb rotation in Drosophila melanogaster (PhD thesis). Toronto: Department of Cell and Systems Biology, Arts and Science Faculty, University of Toronto; 2013. p. 120-150.
Malagon JN, Larsen E. Heredity and self-organization: partners in the generation and evolution of phenotypes. Int Rev Cell Mol Biol. 2015;315:153-181. Doi:10.1016/bs.ircmb.
Marinari E. A study of epithelial cell delamination in Drosophila. London: Molecular and Cell Biology, Faculty of Science, London College University, 2011. p. 97-99.
Marinari E, Mehonic A, Curran S, Gale J, Duke T, Baum B. Live-cell delamination counterbalances epithelial growth to limit tissue overcrowding. Nature. 2012;484(7395):542-545. Doi:10.1038/nature10984.
Rubiano G. Iteración y Fractales. Bogotá: Editiorial Universidad Nacional de Colombia; 2009. p. 107-109.
Sole R. Redes complejas: del genoma a Internet. Barcelona: Editorial Metatemas; 2009. p. 1-10.
Sole R. Phase Transitions. Princenton: Princenton University Press, 2011. p-10-23.
Sole R, Gould B. Signs of Life: How complexity pervades biology. New York: Basic Book, 2000. p. 1-20.
Tanaka K, Barmina O, Kopp A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci USA. 2009;106(12):4764-4769. Doi:10.1073/pnas.0807875106.
Tanaka K, Barmina O, Kopp, Sanders LE, Arbeitman MN, Kopp A. Evolution of sex-specific traits through changes in HOX-dependent doublesex expression. PLoS Biology. 2011;9(8):e.Doi:10.1371/journal.pbio.1001131.
True J. Combing evolution. Evol Dev. 2008;10(4):400-402. Doi:10.1111/j.1525-142X.2008.00250.
Turner JS. The Tinkerer's Accomplice. Cambridge: Harvard University Press; 2007. p. 10-44.
Referencias
Ahuja A, Singh RS. Variation and evolution of male sex combs in Drosophila: nature of selection response and theories of genetic variation for sexual traits. Genetics. 2008;179(1):503-509. Doi:10.1534/genetics.107.086363.
Albert R, Barabasi A. Topology of evolving networks: local events and universality. Phy. Rev. Lett. 2000;85(24):5234-5237. Doi:10.1103/PhysRevLett.85.5234
Andrade E. Los demonios de Darwin: Semiótica y termodinámica de la evolución biológica. Bogotá: Editiorial Universidad Nacional de Colombia; 2003. p. XXVIII-XXIX.
Andrade E. La ontogenia del pensamiento evolutivo. Bogotá: Editiorial Universidad Nacional de Colombia. Bogotá; 2009. p. 107-109.
Atallah J. The development and evolution of complex patterns: the Drosophila Sex Comb as a model System (PhD thesis). Toronto: University of Toronto, Department of Cell and Systems Biology; University of Toronto. 2008; p. 45-90.
Ball P. The self-made tapestry: pattern formation in nature. New York: Oxford University Press; 2008. p. 30-50.
Barabasi A, Bonabeau E. Scale-free networks. Sci Am. 2003;288(5):50-59. Doi:10.1038/scientificamerican0503-60
Bertet C, Sulak L, Lecuit T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 2004;429(6992):667-671. Doi:10.1038/nature02590
Blankenship JT, Backovic ST, Sanny JSP, Weitz O, Zallen JA. Multicellular Rosette Formation Links Planar Cell Polarity to Tissue Morphogenesis. Dev Cell. 2006;11(4):459-470. Doi:10.1016/j.devcel.2006.09.007
Camazine S, Deneuborg, J.-L., Franks, N.R., Sneyd, J., Theraulaz, G. Bonabeau, E. Self-organization in Biological Systems, Princenton: Princeton University Press. 2001. p. 11-13.
Dobrescu R, Purcarea V. Emergence, self-organization and morphogenesis in biological structures. J Med Life. 2011;4(1):82-90.
Eishenhoffer GT, Loftus PD, Yoshigi M, Otsuna H, Chien CB, Morscos PA, et al. Crowding induces live cell extrusion to maintain homeostatic cell numbers in epithelia. Nature. 2012;484 (7395):546-549. Doi:10.1038/nature10999
Fernandez-Gonzalez R, Zallen JA. Feeling the squeeze: live-cell extrusion limits cell density in epithelia. Cell. 2012;149(5):965-967. Doi: 10.1016/j.cell.2012.05.006
Held L, Grimson M, Du Z. Proving an old prediction: the sex comb rotates at 16 to 24 hours after pupariation. Dros Inf Serv. 2004;87(1):76-78.
Jeong H, Albert R. The large-scale organization of metabolic networks. Nature. 2000;760 (6804):651-654. Doi:10.1038/35036627
Jeong H, Mason SP, Barabasi AL, Oltavi ZN. Lethality and centrality in protein networks. Nature. 2001;411:41-42. Doi:10.1038/35075138
Karsenti E. Self-organization in cell biology: a brief history. Nat Rev. 2008;9(3):255-262. Doi:10.1038/nrm2357
Kauffman SA. At the home in the universe. New York: Oxford University Press; 1995. p. 20-25.
Malagon JN, Waleed K. Evolution of allometric changes in fruit fly legs: a developmentally en-trenched story. Acta biol Colomb. 201621(3). Doi: http://dx.doi.org/10.15446/abc.v21n3.53650
Malagon JN. Sex combs in motion: Cellular processes involved in sex comb rotation in Drosophila melanogaster (PhD thesis). Toronto: Department of Cell and Systems Biology, Arts and Science Faculty, University of Toronto; 2013. p. 120-150.
Malagon JN, Larsen E. Heredity and self-organization: partners in the generation and evolution of phenotypes. Int Rev Cell Mol Biol. 2015;315:153-181. Doi:10.1016/bs.ircmb
Marinari E. A study of epithelial cell delamination in Drosophila. London: Molecular and Cell Biology, Faculty of Science, London College University, 2011. p. 97-99.
Marinari E, Mehonic A, Curran S, Gale J, Duke T, Baum B. Live-cell delamination counterbalances epithelial growth to limit tissue overcrowding. Nature. 2012;484(7395):542-545. Doi:10.1038/nature10984.
Rubiano G. Iteración y Fractales. Bogotá: Editiorial Universidad Nacional de Colombia; 2009. p. 107-109.
Sole R. Redes complejas: del genoma a Internet. Barcelona: Editorial Metatemas; 2009. p. 1-10.
Sole R. Phase Transitions. Princenton: Princenton University Press, 2011. p-10-23.
Sole R, Gould B. Signs of Life: How complexity pervades biology. New York: Basic Book, 2000. p. 1-20.
Tanaka K, Barmina O, Kopp A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci USA. 2009;106(12):4764-4769. Doi:10.1073/pnas.0807875106
Tanaka K, Barmina O, Kopp, Sanders LE, Arbeitman MN, Kopp A. Evolution of sex-specific traits through changes in HOX-dependent doublesex expression. PLoS Biology. 2011;9(8):e.Doi:10.1371/journal.pbio.1001131
True J. Combing evolution. Evol Dev. 2008;10(4):400-402. Doi:10.1111/j.1525-142X.2008.00250
Turner JS. The Tinkerer's Accomplice. Cambridge: Harvard University Press; 2007. p. 10-44.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Ernest C. Y. Ho, Juan Nicolas Malagón, Abha Ahuja, Rama Singh, Ellen Larsen, Roeland M. H. Merks. (2018). Rotation of sex combs in Drosophila melanogaster requires precise and coordinated spatio-temporal dynamics from forces generated by epithelial cells. PLOS Computational Biology, 14(10), p.e1006455. https://doi.org/10.1371/journal.pcbi.1006455.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2016 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).