Comparação de Diferentes Métodos Químicos como Extrantes de Alumínio em Solos Tiomorficos do Brasil e Colômbia
Comparison of Different Chemical Methods as Extrantes of Aluminum in Acid Sulphate Soils of Brazil and Colombia
DOI:
https://doi.org/10.15446/rfnam.v68n1.47845Keywords:
Analise química, fitotoxicidade, solos tiomórficos, acidez, compostos orgânicos. (pt)Chemical analyze, phytotoxicity, thiomorphic soils, acidity, organic compounds (en)
Downloads
Comparação de Diferentes Métodos Químicos como Extrantes de Alumínio em Solos Tiomorficos do Brasil e Colômbia
Comparison of Different Chemical Methods as Extrantes of Aluminum in Acid Sulphate Soils of Brazil and Colombia
Enrique Combatt Caballero1; Víctor Hugo Álvarez V.2 e Júlio César Lima N.3
1 Professor Asistente. Universidad de Córdoba - Facultad de Ciencias Agrícolas - Departamento de Agronomía y Desarrollo Rural. A.A. 354, Montería, Colombia. <ecombatt@fca.edu.co>
2 Professor Titular-Voluntário. Universidade Federal de Viçosa- Departamento de Solos. Av. P. H. Rolfs, s/n, 36570-000, Viçosa, Minas Gerais, Brasil. <vhav@ufv.br>
3 Professor Titular. Universidade Federal de Viçosa- Departamento de Solos. Av. P. H. Rolfs, s/n, 36570-000, Viçosa, Minas Gerais, Brasil. <julio_n2003@yahoo.com.br>
Recebido: Julho 21, 2013; Aceito: Setembro 11, 2014
doi: https://doi.org/10.15446/rfnam.v68n1.47845
Resumo. A acidificação do solo tiomórficos tem como consequência a solubilização de compostos de Al, o que ocasiona o aumento da concentração de Al3+ na solução do solo. O objetivo, deste trabalho foi determinar os teores de Al trocável e ativo extraídos com 12 métodos analíticos em amostras de solos tiomórficos do Brasil e Colômbia. Foi realizado um ensaio no laboratório com amostras de 12 solos, nove do Estado do Espírito Santo (Brasil) e três da Colômbia. Os métodos avaliados foram: KCl 1 mol L-1, Ca(OAc)2 0,5 mol L-1 pH 7, BaCl2 0,1 mol L-1, NH4OAc 1 mol L-1 pH 4,8, CuCl2 0,5 mol L-1 pH 2,8 e LaCl3 0,33 mol L-1 pH 4,0. Para comparação dos métodos de extração, os tratamentos formaram um delineamento fatorial 12x12, dispostos em blocos casualizados com três repetições. Foram utilizados analise de variância, estatística descritiva e contrastes para determinar a capacidade de extração de Al pelos métodos químicos. A determinação quantitativa mostrou que o método com maior capacidade extratora de Al foi a solução de Na4P2O7. Os métodos que utilizam íons de cloreto, não tamponados, conseguem extrair mais eficientemente Al dos solos tiomórficos que a soluções extratoras de acetatos, sendo CuCl2 e LaCl3 as de maior eficiência. O aumento do tempo de agitação não resultou em maior eficiência na extração de Al entre as soluções não tamponadas.
Palavras-chave. Analise química, fitotoxicidade, solos tiomórficos, acidez, compostos orgânicos.
Abstract. The acidification of acid sulphate soil has as a result the solubilization of Al compounds, which increases the concentration of Al3+ in the soil solution. This study was carried out to evaluate the levels of exchangeable and active Al extracted with 12 analytical methods, in soil samples from acid sulphate soil from Brazil and Colombia. It was conducted an laboratory investigation with 12 samples soils, nine from Espirito Santo State (Brazil) and three from Colombia. The methods evaluated were: KCl 1 mol L-1, Ca(OAc)2 0.5 mol L-1 pH 7, BaCl2 0.1 mol L-1, NH4OAc 1 mol L-1 pH 4.8, CuCl2 0.5 mol L-1 pH 2.8 e LaCl3 0.33 mol L-1 pH 4.0. For comparison of extraction methods, the treatments were set as a factorial 12x12 design, arranged in a randomized block with three replications. The analysis of variance, statistics descriptive and contrasts were applied to determine the capacity of Al extraction by the chemical methods. The quantitative determination showed that the method with higher extraction capacity of Al was the Na4P2O7 solution. The methods that use chloride ions unbuffered, are able to extract more efficiently the Al of the acid sulphate soil than the solutions of acetates, being the CuCl2 and LaCl3 the ones with highest efficiency. The increase in the stirring time did not increased the extraction efficiency of Al among the non-buffered solutions.
Key words. Chemical analyze, phytotoxicity, thiomorphic soils, acidity, organic compounds.
INTRODUÇÃO
Os solos tiomórficos são considerados de baixo potencial agrícola quando drenados. Isto por que a oxidação de sulfetos conduz à produção de acido sulfúrico (pH<3,5) e a solubilização de metais como Al, Fe e Mn que podem alcançar níveis tóxicos para as lavouras e os organismos vivos (Jusop e Muhrizal, 2002; Hicks et al., 2002).
A acidificação do solo tem como consequência a solubilização de compostos de Al, o que ocasiona o aumento da concentração de Al3+ na solução do solo. Isto pode ser observado em camadas de solos extremadamente acidas, com valores de pH<3,5, como consequência da formação de grandes quantidades de ácidos que ocasionam mudanças dramáticas no solo (White et al., 1997), sendo estas condições presentes em solos tiomórficos drenados (Ahern et al., 2004).
Os teores dos cátions alcalinos, e de Al, Fe e Mn trocáveis são utilizados para avaliar algumas propriedades químicas dos solos. A partir dos teores de Al trocável e ativo do solo se pode avaliar a acidez gerada pela drenagem desses solos. No entanto a extração química do Al é de natureza complexa, devido aos diferentes compostos de Al nos solos, como o complexo Al - húmus e diferentes formas de Al trocável e de Al ativo presente nos solos. Takahashi et al. (1995) indicaram que as reações de troca que ocorrem durante os processos de extração do Al são complexas devido às diferentes formas de Al complexadas com compostos minerais e orgânicos. Drabek et al. (2003) relataram que não há um método de extração de Al que seja aceito universalmente para todos os solos e suas condições químicas.
Nesse sentido Van Hees et al. (2000) relatam que a influencia do pH do solo sobre a solubilidade do Al é fortemente modificada pelas frações de Al complexada pela matéria orgânica do solo, e também pelo Al que se encontra nas fases sólidas e liquidas.
A fração trocável do Al no solo envolve principalmente as formas monoméricas deste elemento, enquanto os polímeros inorgânicos e o Al complexado pela matéria orgânica constituem a fração não trocável (McLean, 1976). Estas formas inorgânicas têm sido referidas como os polímeros de Al-hidroxi adsorvidos aos coloides ou situados nas entrecamadas de vermiculitas, montmorilonitas, e íons hidroxialumínio associados à matéria orgânica, em forma de complexos orgânicos e em formas amorfas (Juo e Kamprath, 1979).
Kamprath, (1970) e Noble et al. (1997) sugerem diferentes métodos de extração de Al trocável, os quais extraem diferentes quantidades de Al dependendo das condições dos solos. A extração de Al com KCl 1 mol L-1 é recomendada normalmente para todas as condições dos solos, mas a fração de difícil extração e não trocável, encontrada ligada a compostos orgânicos. Frequentemente a solução de CuCl2 0,5 mol L-1, è sugerido para a extração de Al fracamente ligado a compostos orgânicos e a de Na4P2O70,1 mol L-1 é indicada para a extração de Al fortemente ligado compostos orgânicos (Porebska e Mulder, 1996).
Takahashi e Dahlgren, (1998) afirmaram que a extração com KCl 1 mol L-1 nem sempre reflete o teor de Al trocável em solos em que predominam os complexos Al- humicos. Juo e Kamprath (1979) também indicaram que o Al complexado não é facilmente extraído com KCl. Estes autores recomendam o uso de CuCl2 0,5 mol L-1 e LaCl3 0,3 mol L-1 para a extração de Al complexado, devido à afinidade do Cu e do La pelos mesmos ligantes do Al e por que a acidez da solução (pH 3,3) favorece a despolimerização dos polímeros de Al - OH. No entanto, esses extratores têm o inconveniente de extrair polímeros Al-hidroxi dos espaços interlaminares dos filosilicatos 2:1. Bloom e McBride (1979) consideram que o LaCl3 é um extrator que pode remover uma parte do Al complexado com a matéria orgânica. Perez et al. (2009) expõem que a determinação indireta do Al por titulação com NaOH, após extração com solução de KCl 1 mol L-1, pode não ser adequada para certos tipos de solos brasileiros, notadamente aqueles que apresentam altos teores de carbono orgânico
Em vista da comprovada falta de pesquisas nestes solos, o objetivo do trabalho foi determinar os teores de Al trocável e ativo com diferentes métodos analíticos em amostras de solos tiomórficos do Brasil e Colômbia.
MATERIAL E MÉTODOS
O trabalho foi desenvolvido nos laboratórios de química e fertilidade de solo do Departamento de Solos da Universidade Federal de Viçosa durante o ano de 2009.
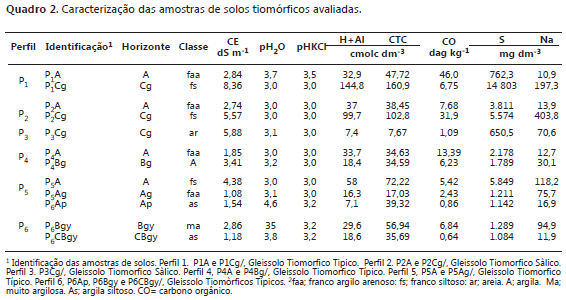
Solos. Foram utilizadas nove amostras de solos coletadas no Estado do Espírito Santo - Brasil, nos perfis identificados como P1, P2, P3, P4 e P5, e no Vale do Rio Sinú em Córdoba - Colômbia sendo três amostras no perfil P6. Quanto a classificação taxonômica os perfis P1, P4 e P5 foram classificados como Gleissolo Tiomórficos típicos e os perfis P2 e P3 Gleissolo Tiomórficos Sàlicos (EMBRAPA, 2006). Já o perfil P6 foi classificado como Gleissolo Tiomórfico típico segundo Embrapa, (2006) e Sulfic Endoaquepts Segundo SSS (2006).
As amostras foram secas, destorroadas, moídas e posteriormente passadas por peneira com malha de 2,0 mm (TFSA) para analises química. Na fração fina de cada solo foram realizadas as seguintes analises: frações granulométricas e condutividade elétrica segundo métodos descritos por EMBRAPA, (1999). pH quantificado em água (pH H2O) e em KCl 1 mol L-1 (pH - KCl) usando uma relação solo - solução de 1:2,5. O teor de carbono de compostos orgânico (CO) foi analisado via combustão seca em analisador elementar (CHNS/O), modelo Perkin Elmer®, PE-2400. A acidez potencial (H+Al) foi determinada por extração com Ca (OAc)2 0,5 mol L-1, pH 7 segundo método descrito por Defelipo e Ribeiro (1991). A capacidade de troca catiônica (CTC) foi determinada pelo método NH4OAc 1 mol L-1 a pH 7, e o S disponível, foi extraído com Ca(H2PO4)2, 500 mg L-1 de P, em HOAc 2 mol L-1 (Hoeft et al., 1973) e determinado por turbidimetria. E o Na disponível pelo extrator Mehlich-1 (Vettori, 1969).
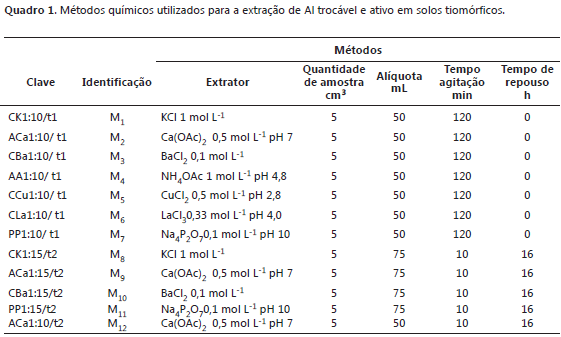
Métodos para determinação de Al trocável e de Al ativo. Foram avaliados 12 métodos de extração de Al utilizando-se 5 cm3 de TFSA. Nos primeiros sete métodos as amostras de solos foram colocadas em tubos de centrífuga com capacidade de 120 mL.
Os extratores utilizados foram os seguintes: KCl 1 mol L-1 (Buurman et al., 1996), Ca(OAc)2 0,5 mol L-1 pH 7 (Embrapa, 1999), BaCl2 0,1 mol L-1 (Hendershot e Duquette, 1986), NH4OAc 1 mol L-1, pH 4,8 (McLean, 1976), CuCl2 0,5 mol L-1, pH 2,8 (Jou e Kamprat, 1979) e LaCl3 0,33 mol L-1, pH 4,0 (Hargrove e Thomas, 1981), Na4P2O7 0,1 mol L-1, pH 10 (Buurman et al., 1996) (Quadro 1).
Foram adicionados 50 mL dos extratores a cada amostra de solo da seguinte forma: inicialmente acrescentou-se 20 mL de solução extratora ao solo, essa suspensão foi agitada por 30 min, centrifugada a 3.500 rpm por 5 min e o sobrenadante filtrado. Posteriormente o solo foi ressuspendido com mais 15 mL de solução extratora e agitada por 30 min, seguido da centrifugação e filtragem. Na fase final o solo foi ressuspendido com mais 15 mL de solução extratora e agitado por 1 h, centrifugado e o sobrenadante filtrado para o becker de 50 mL (Quadro 1).
Nos seguintes quatros métodos foram colocados 5 cm3 de solos e 75 mL dos extratores (KCl, Ca(OAc)2, BaCl2 e Na4P2O7) em erlermeyer de 125 mL de capacidade. A suspensão foi agitada por 10 min e depois deixada em repouso por 16 h. O sobrenadante foi transferido e filtrado para outro erlenmeyer de 125 mL.
Por ultimo, foram colocados 5 cm3 de solo e 50 mL de Ca(OAc)2 em erlenmeyer de 125 mL. A suspensão foi agitada por 10 min e deixada em repouso por 16 h. O sobrenadante filtrado e transferido para outro erlenmeyer de 125 mL. Na fase de dosagem do Al, utilizou-se um espectrofotômetro de emissão ótica em plasma induzido, marca Perkin Elmer®, modelo Optima 3300 DV.
Para comparação dos métodos de extração, os tratamentos foram organizados em esquema fatorial 12x12, dispostos em blocos casualizados com três repetições. Os fatores corresponderam aos 12 métodos de extração e aos 12 solos tiomorficos. Os dados foram submetidos a analise de variância, estatística descritiva, contraste ortogonais.
RESULTADOS E DISCUSSÃO
Características dos solos. As classes texturais predominantes nas amostras foram franco argilo arenosa e franco siltoso para os solos tiomórficos coletados no Brasil. A condutividade elétrica oscilou entre 1,85 e 8,36 dS m-1; o pH dos solos em água entre 3,00 e 3,75; os teores de C orgânico entre 10,9 e 460,4 g kg-1, a CTC variou entre 7,67 e 160,98 cmolc dm-3; a acidez potencial de 7,4 a 144,8 cmolc dm-3 e o S disponível entre 311 e 6.509 mg dm-3 (Quadro 2).
Com relação ao perfil de solo da Colômbia, as classes texturais predominantes foram argila siltoso e muito argilosa. A condutividade elétrica oscilou entre 1,18 e 2,86 dS m-1; o pH entre 3,48 e 4,55; o C orgânico entre 6,4 e 24,3 g kg-1, a CTC variou entre 35,69 e 56,94 cmolc dm-3; a acidez potencial de 7,1 a 29,6 cmolc dm-3 e o S disponível entre 1.084,4 e 1289,3 mg dm-3 (Quadro 2).
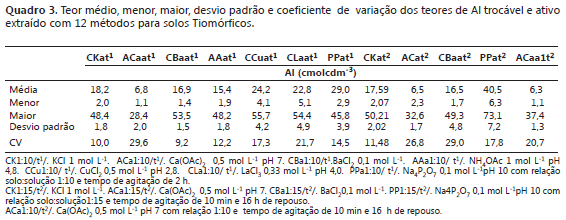
Extração do Al por diferentes métodos. Os teores médios de Al extraídos dos solos pelos diferentes métodos oscilaram entre 6,32 e 40,54 cmolcdm-3(Quadro 3). Destaca-se, por exemplo, que entre os métodos com tempo de agitação de 2 horas e 50 mL de alíquota (relação solo:solução 1:10) a sequencia de extração de Al foi a seguinte: PP1:10/ t1 > CCu1:10/ t1 >CLa1:10/ t1 >CBa1:10/ t1>AA1:10/ t1 > ACa1:10/ t1, corroborando a maior capacidade de extração de Na4P2O7 0,1 mol L-1 pH 10, conforme indicado por Kaiser e Zech (1996).
Quando comparados os teores médios extraídos pelos métodos com tempo de agitação de 10 min, 16 h de repouso e 75 mL de alíquota do extrator, (relação solo:solução 1:15) verifica-se novamente que o Na4P2O7 0,1 mol L-1 pH 10 (PP1:15/t2) tem maior força de extração, com a seguinte sequência: PP1:15/t2> CK1:15/t2> CBa1:15/t2> ACa1:15/t2.
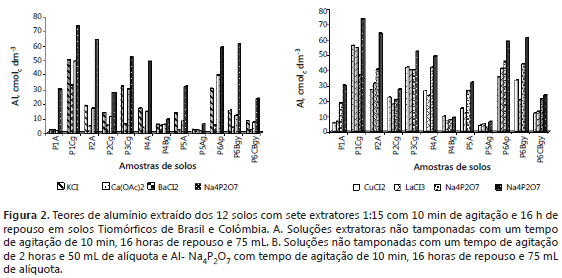
Teor de Al extraído com métodos que utilizam relação 1:10 e 120 min de agitação. A variação nos teores de Al extraídos pelos métodos que utilizaram cloretos nos 12 solos foram as seguintes: AlKCl (2,05 - 48,46); AlBaCl2 (1,44 - 53,5 ); AlCuCl2 (4,16 - 55,7) e AlLaCl3 (5,11 - 54,48) (Figura 1A). Para estas soluções extratoras pode-se constatar que La e Cu têm maior capacidade de deslocar o Al, possivelmente por atuar nas entre camadas das argilas ou nos complexos Al - húmus da matéria orgânica, além dos sítios trocáveis. Quando se comparam os teores de Al extraído por estes métodos com os teores de CO, verificou-se que nos solos que têm maiores teores de CO, o CuCl2 desloca mais Al, seguido pelos LaCl3, KCl e BaCl2.
É importante ressaltar que o CuCl2 extrai mais Al que LaCl3 também em solos que têm baixos teores de CO, sugerindo algum tipo de solubilização de compostos amorfos, polímeros Al-hidroxi de baixo grau de cristalinidade que podem ser simultaneamente extraídas pelo extrator. O fato da extração de Al pelo LaCl3 ter sido sempre menor, indicam que este extrator desloca as formas mais fracamente complexadas por compostos orgânicos e também de Al que se encontra retido com baixo grau de afinidade a fases inorgânicas. Segundo Ebeling et al. (2008) devido à forte interação entre a matéria orgânica e os elementos a ela adsorvidos, os métodos de rotina em fertilidade do solo podem não avaliar de forma adequada a acidez nos Organossolos. Em Espodossolos e Neossolos Quartzarênicos Rizzato et al. (2010) encontraram que os reagentes CuCl2 e LaCl3 foram mais seletivos para as formas de Al orgânico, cuja ordem de extractabilidade foi: Alp>AlCu>AlLa.
Os resultados evidenciam, além do mais, que os extratores KCl e BaCL2 foram os menos eficazes em deslocar o Al complexado nos compostos orgânicos. Juo e Kamprath (1979); Hargrove e Thomas (1984); Cronan et al. (1986) e Urrutia et al. (1995) indicam que o Al extraído com CuCl2 (pH 4,3) é maior presumivelmente devido à despolimerização induzida pelo baixo pH do extrator e à grande afinidade do Cu pelos sítios de troca da matéria orgânica. Nesse sentido Takahashi e Dahlgren (1998) trabalhando em solos dominados por complexos de Al - húmus, indicam que a quantidade de Al extraído com KCl 1 mol L-1 não sempre reflete a quantidade de Al trocável em solos dominados por complexos Al - húmus. Abreu et al. (2003) a extração com KCl 1 M tem-se utilizado como método convencional de estimar prontamente Al trocável em solos ácidos.
Quando se comparam os teores de Al extraída nos 12 solos (Figura 1B) pelos extratantes com cloretos e o teor de Al extraído pelo Na4P2O7, se observa que a solução extratora com Na4P2O7tem maior capacidade de extração de Al na maioria dos solos com alto teor de CO e argila. Isso corrobora a maior eficácia em dissolver compostos orgânicos de maior estabilidade, como da reconhecida capacidade de extrair formas inorgânicas de Al.
Nas condições químicas dos solos tiomórficos o reagente Na4P2O7 é considerado como um extrator mais eficiente na extração de Al, devido à combinação de uma solução de pH alto que é presumivelmente o responsável pela completa dissociação do Al fortemente unidos aos radicais da matéria orgânica. Este extrator também é mais eficaz na remoção de espécies mais polimerizadas de Al que não são unicamente aquelas complexadas à matéria orgânica.
Drabek et al. (2003) expõem que o CuCl2 0,5 mol L-1 é recomendado para extração de Al fracamente ligado a compostos orgânicos e o Na4PO7 0,1 mol L-1 é adequado para a extração de Al ligado fortemente a compostos orgânicos. Juo e Kamprath, (1979) indicam que o NH4OAc (pH 4,8) ao parece ser um extrator fraco na determinação do Al trocável e potencialmente reativo em solos ácidos, posto que extrai menor quantidade de Al que KCl 1 mol L-1. Além Drabek et al. (2003) indicam que com o método do Na4P2O7 pode ser extraído uma quantidade significativa de Al, não somente atribuído ao complexos orgânicos monoméricos, mais também a polímeros de compostos inorgânicos de baixo grau de cristalinidade. Em solos florestais Zolotajkin et al. (2014) encontraram que em solos com grandes quantidades de húmus, o teor de alumínio trocável depende da utilização de BaCl2 ou Na4P2O7 também o pH do solo. Zambrosi et al. (2007) a menor toxicidade do Al encontrada no SPD está associada com a complexação do elemento pela matéria orgânica, que promove a remoção do Al da solução do solo e a formação de complexos com o carbono orgânico dissolvido.
Teor de Al extraído com métodos que utilizam relação 1:15, 10 min de agitação e 16 h em repouso, e sua comparação com o métodos de relação 1:10 e 120 min de agitação. Ao analisar a variação dos teores de Al extraídos por estes métodos, verificaram-se intervalos de extração de: AlKCl (2,07 - 50,21); AlCa(OAc)2 (2,37 - 32,64); AlBaCl2 (1,725 - 49,31) e AlNa4P2O7 (6,36 - 73,12), observando-se que a solução extratora de Na4P2O7 tem a maior capacidade de extração de Al em todos os solos (Figura 2A).
A quantidade de Al extraída por Na4P2O7 quando utilizada a relação 1:15 e 16 h de repouso foi maior. Tal fato pode ser explicado pelo maior tempo de contato entre o solo e a solução extratora. Indica também que o maior tempo de contato favorece a disponibilização do Al fortemente complexado na matéria orgânica e do Al inorgânico de baixa cristalinidade.
Observando-se a Figura 2, está claro que o teor de Al extraído pelo Na4P2O7 excede os teores de Al extraído pelos demais métodos. A diferença nos teores de Al extraído pode ser explicada pela seletividade do extrator Na4P2O7 para formas Al-húmus ou Al em compostos de baixa cristalinidade, comparado com os extratores de KCl, BaCl2 e Ca(OAc)2. Takahashi et al. (1995) ressaltam que a capacidade do Na4P2O7 de extrair outras formas de Al que não somente aquelas associadas à matéria orgânica do solo, e a natureza da sustâncias húmicas dos solos estudados, o que pode resultar no Al sendo retido com diferente afinidade e interações químicas que não somente a sua complexação, provavelmente em sítios específicos da matéria orgânica. Van Breemen e Buurman (2002) expõe que em condições de hidromorfismo os complexos de Al- húmus predominam nos horizontes B espódicos e são, portanto, as formas dominantes de Al ativo.
Outra interpretação dos resultados das análises, conforme argumentado por Bloom et al. (2005) e que a extração do Al com KCl 1 mol L-1 não reflete a quantidade de Al trocável em solos orgânicos dominados por cargas variáveis, porque o KCl extraem mais quantidades de H+ que Al3+ trocável. Além disso, em nossa pesquisa o extrator Ca(OAc)2 0,5 mol L-1 foi tamponado a pH 7, sendo provável a precipitação do Al. Takahashi et al. (2006) indicam que o uso de Ca(OAc)2 a pH 7 durante a quantificação da CTC, pode contribuir para que o Al removido dos complexos Al- húmus de amostras de solo possam precipitar, devido a que o pH da solução extrator osolo fica maior que 5,5. Segundo Dijkstra e Fitzhugh (2003) os cátions de hidrolises acida complexados à matéria orgânica não são rapidamente trocáveis por reações normais de troca.
Nestas condições de solos tiomórficos, ao comparar a extração de Al pelos métodos CCu1:10/ t1 (CuCl2), CLa1:10/ t1(LaCl3), PP1:10/ t1 (Na4P2O7) (relação 1:10 e duas horas de agitação) com PP1:15/t2 (Na4P2O7, 1:15 e 16 horas de repouso), se observa também que o método PPat2 tem maior capacidade de extração. Este devido possivelmente à supra estimativa do Al trocável, por que ocorre deslocamento do Al de compostos amorfos que não compõem a fase trocável (Figura 2B).
Kaiser e Zech (1996) afirmaram que o extrator Na4P2O7 não deveria mais ser utilizado para estimar metais em complexos húmicos. Segundo esses autores, o Al associado à matéria orgânica pode ser superestimado, enfatizando que o Al extraído com Na4P2O7 não pode ser atribuído unicamente à associação do elemento à fração húmica do solo.
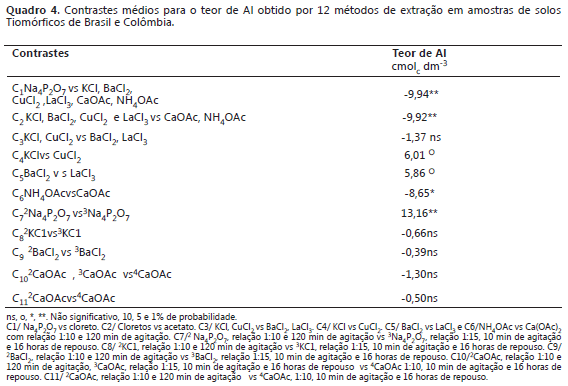
Comparação dos métodos de extração de alumínio por contrastes ortogonais. Mediante a interpretação de contrastes ortogonais para os métodos que utilizam relação 1:10 e 2 h de agitação, se indica que o extrator que utiliza a solução de Na4P2O7 extraiu mais eficientemente o Al quando comparado com os não tamponados (cloretos) e estes, maior quantidade de Al trocável que os tamponados (acetatos) e entre os acetatos o NH4OAc extraiu maior quantidade de Al que o Ca(OAc)2 (Quadro 4). Entre os extratores com cloretos, os CuCl2 e LaCl3 foram os mais eficientes que as soluções de cloretos de KCl e BaCl2. Quando analisado o contraste sete, se determina que o extrator de Na4P2O7 com relação 1:15, 10 min de agitação e 16 h de repouso sendo mais eficiente na extração de Al que Na4P2O7 com relação solo:solução 1:10 e 2 h de agitação.
Segundo Bertsch e Bloom, (1996) a solução extratora de Na4P2O7, tem sido usado "seletivamente" para extrair metais associados a compostos orgânicos, mas também pode deslocar Al de compostos de baixo grau de cristalinidade.
Nos contrastes oito, nove, dez e 11 não se encontrou diferencias significativa entre os teores de Al que são utilizados nos contraste médios. Com estes resultados, se verifica que os extratores KCl, BaCl2e Ca(OAc)2 podem utilizar-se na extração de Al independentemente da relação solo:solução e do tempo de agitação e repouso.
Vários compostos de Al amorfos podem ter fases coloidais coassociadas com a matéria orgânica, que são liberadas através da dispersão do material orgânico durante a extração com Na4P2O7, tendo o teor de Al extraído boa correlação com o teor de CO. Mas Garcia et al. (2004) expõem que o uso de soluções extratoras de Na4P2O7 para a extração de Al ligado a complexos orgânicos ligados a alumínio superestima os teores de Al extraídos, quando comparados com teores extraídos pelo CuCl2 0,5 mol L-1 e LaCl3 0,33 mol L-1 em solos com diferentes quantidades de argila e matéria orgânica. Auxtero et al. (2012) encontraram que a distribuição de Al foi determinada por vários extratores na seguinte ordem: 0,5 M CuCl2>0,33 M LaCl3>1 M KCl, variaram desde 1,8-13,5, 1,3-4,4, 0,7-3,0 e cmol kg-1, respectivamente.
Isso se deve, de acordo com Juo e Kamprath, (1979) e Oates & Kamprath (1983), ao alto poder complexante do íon Cu e à reação ácida propiciada pela adição desta solução ao solo. Estas reações químicas contribuem à liberação do Al complexado ou ligado a compostos orgânicos que fazem parte da matéria orgânica e do Al em formas amorfas ligado à fase inorgânica do solo. Além disso, a solução de CuCl2 e LaCl3 solubilizam maior quantidade de Al que o extrator KCl. Resultados similares foram encontrados nesta pesquisa quando foram utilizadas e comparados os teores de Al extraídos com soluções de CuCl2 0,5 mol L-1, KCl 1 mol L-1 e BaCl2 0,1 mol L-1.
É necessário indicar que, conforme alertam Bertsch & Bloom, (1996) os métodos para determinação de Al não são sempre seletivos para fases especificas, embora existam algumas relações definidas operacionalmente entre o Al teoricamente trocável e extratores seletivos. Mrvic et al. (2008) alguns métodos não são suficientemente seletivos, por isso, é necessário pesquisar mais para conseguir métodos favoráveis para a determinação das diferentes formas de Al.
A aplicação destes métodos para extração de Al nos solos tiomórficos apesentam algumas dificuldades dados os diferentes teores de argila e carbono orgânicos presentes nestes solos. Neste caso é necessário ter presente o objetivo da determinação do Al, porque dependendo do extrator poderá haver teores baixos ou altos do Al, mas sua aplicabilidade pode ser errônea.
Destes métodos os mais recomendável para solos com alto conteúdos de carbono orgânico podem ser o método que utilizam CuCl2, porque com sua utilização se podes extrair o Al ligado aos compostos orgânicos, mas o KCl pode também utilizar-se para conhecer o Al facilmente extraível, além o método é mais econômico e reprodutível.
CONCLUSÕES
Das soluções extratoras testadas o Na4P2O7 foi a que extraiu os maiores teores de Al nos solos tiomórficos pesquisados.
Os métodos que utilizam íons de cloreto, não tamponados, consegueram extrair mais eficientemente Al dos solos tiomórficos que a soluções extratoras de acetatos (tamponados), sendo os CuCl2 e LaCl3 os de maior eficiência.
Os extratores CuCl2 e LaCl3 tem maior poder de extração de Al que KCl em condições de pH muito acido e altos teores de S e CO.
O KCl é mais eficaz na extração de Al que o Ca(OAc)2 em condições de solos tiomórficos.
O incremento do tempo de agitação não aumenta a eficiência na extração de Al entre as soluções não tamponadas.
Para avaliação dos teores de Al em solos tiomórficos se podem usar soluções de KCl 1 mol L-1 e BaCl2 0,1 mol L-1.
REFERÊNCIAS BIBLIOGRÁFICAS
Abreu, C.H., T. Muraoka and A.F. Lavorante. 2003. Exchangeable aluminum evaluation in acid soils. Scientia Agricola 60(3): 543-548.
Ahern, C.R., A.E. McLnea and L.A. Sullivan. 2004. Acid Sulfate Soils Laboratory Methods Guidelines. Queensland Department of Natural Resources, Mines and Energy, Indooroopilly, Queensland, Australia. 132 p.
Auxtero, E., M. Madeira and D. Parker. 2012. Extractable Al and Soil Solution Ionic Concentrations in Strongly Leached Soils from Northwest Iberia: Effects of Liming. International Scholarly Research Notices. DOI: 10.5402/2012/105627.
Bertsch, P.M. and P.R. Bloom. 1996. Aluminum. pp. 517-550. In: Sparks, D.L., A.L. Page, P.A. Helmke, R.H. Loeppert, P.N. Soltanpour, M.A. Tabatabai, C.T. Johnston and M.E. Summer (eds.). Methods of Soil Analysis. Book Series No. 5. Soil Science Society of America Inc., Madison, Wisconsin 1.390 p.
Bloom, P.R. and M.B. McBride. 1979. Metal ion binding and exchange with hydrogen ions in acid - washed peat. Soil Science Society of America Journal 43(4): 687-692.
Bloom, P.R., U.L. Skyllberg and M.E. Sumner. 2005. Soil acidity. pp. 411-459. In: Tabatabai, M.A and D.L. Sparks (eds.). Chemical Processes in Soils. Soil Science Society of America. Book Series No. 8. Madison, Wisconsin. 1.188 p.
Buurman, P., L.B. Van and J. Velthor. 1996. Manual for Soil and Water Analyses. Backhuys Publishers, Leiden. The Netherlands. 314 p.
Cronan, C.S., W.J. Walter and P.R. Bloom. 1986. Predicting aqueous aluminum concentrations in natural waters. Nature 324: 140-143.
Defelipo, B.V. e A.C. Ribeiro. 1991. Análise Química do Solo. Segunda edição. Universidade Federal de Viçosa, Viçosa. 26 p.
Dijkstra, F. and R. Fitzhugh. 2003. Aluminum solubility and mobility in relation to organic carbon in surface soils affected by six tree species of the northeastern United States. Geoderma 114(1-2): 33-47.
Drabek, O., L. Boruvka, L. Mladkova and M. Kocarek. 2003. Possible method of aluminum speciation in forest soils. Journal of Inorganic Biochemistry 97(1): 8-15.
Empresa Brasileira de Pesquisa Agropequaria - EMBRAPA. 2006. Centro Nacional de Pesquisa de Solos. Sistema Brasileiro de classificação de solos. Segunda edição. Embrapa Solos, Rio de Janeiro, 306 p.
Empresa Brasileira de Pesquisa Agropequaria - EMBRAPA 1999. Manual de análises químicas de solos, plantas e fertilizantes. Organizador: Fábio Cesar da Silva. Embrapa Comunicação para Transferência de Tecnologia, Brasília. 370 p.
Ebeling, A.G., L.D. Anjos, D.V. Perez, M.G. Pereirae e G.S. Valladares. 2008. Relação entre acidez e outros atributos químicos em solos com teores elevados de matéria orgânica. Bragantia 67(2): 261-266.
García, E., J.C. Nóvoa, X. Pontevedra, A. Martínez and P. Buurman. 2004. Aluminium fractionation of European volcanic soils by selective dissolution techniques. Catena 56(1-3): 155-183.
Hargrove, W.L. and G.W. Thomas. 1984. Extraction of aluminum from aluminum organic matter in relation to titratable acidity. Soil Science Society of America Journal 48(6): 1458-1460.
Hargrove, W.I. and G.W. Thomas. 1981. Extraction of aluminum form aluminum organic matter complexes. Soil Science Society of America Journal 45(1): 151-153.
Hendershot, W.H. and M. Duquette. 1986. A simple barium chloride method for determining cation exchange capacity and exchangeable cations. Soil Science Society of America Journal 50(3): 605-608.
Hicks, W., G. Bowmanand and R. Fitzpatrick. 2002. The geochemistry of Australian tropical acid sulfate soil and their environment hazard. In: Symposium VI. Paper No. 238.17th World Congress Soil Science Thailand.
Hoeft, R.G., L.M. Walsh and D.R. Keeney. 1973. Evaluation of various extractants for available soil sulfur. Soil Science Society of America Journal 37(3): 401-411.
Juo, A.S. and E.J. Kamprath. 1979. Copper chloride as on extractant for estimating the potentially reactive aluminum pool in acid soils. Soil Science Society of America Journal 43(1): 35-58.
Jusop, S. and S. Muhrizal. 2002. Pyrite in acid sulfate soils: transformation and inhibition of its oxidation by application of natural materials. En: http://www.ldd.go.th/Wcss2002/papers/0097.pdf; consulta: febreiro 2007.
Kamprath, E.J. 1970. Exchangeable aluminum as a criterion for liming leached mineral soils. Soil Science Society of America Journal 34(2): 252-254.
Kaiser, K. and W. Zech. 1996. Defects in estimation of aluminum in humus complexes of podzolic soils by pyrophosphate extractions. Soil Science 161(7): 452-458.
Mrvić, V., M. Jakovljević, D. Stevanović, D. Čakmak and M. Zdravković. 2008. Methods for the determination of the form of aluminium: Pseudogley soils. Journal of the Serbian Chemical Society 73(6): 673-680.
McLean, E.O. 1976. Chemistry of soil aluminum. Communication Soil Science Plant Analyses 7(7): 619-636.
Noble, A.D., M. Cannon and D. Muller. 1997. Evidence of accelerated soil acidification under stylosanthes-dominated pastures. Australian Journal of Soil Research. 35(6): 1309-1322.
Oates, K.M. and E.J. Kamprath. 1983. Soil acidity and limming: II. Evaluation of using aluminium extracted by various chloride salts for determining lime requeriments. Soil Science Society of America Journal 47(4): 690-692.
Perez, V.D, L.H. Cunha dos Anjos, A. Gilvani Ebeling and G.M. Pereira. 2009. Comparison of H/Al stoichiometry of mineral and organic soils in Brazil. Revista Brasileira de Ciência do Solo 33(4): 1071-1076.
Porebska, G. and J. Mulder. 1996. The chemistry of aluminium in strongly acidified sandy soil in Poland. European Journal of Soil Science 47(1): 81-87.
Rizzato, M., P. Vidal, X.L. Otero, V. Moreira e F. Macías. 2010. Seletividade do pirofosfato de sódio e de cloretos não tamponados (CuCl2 e LaCl3) como extratores de alumínio associado à matéria orgânica em solos de restinga do estado de São Paulo. Revista Brasileira de Ciência do Solo 34: 1561-1572.
Soil Survey Division Staff - SSS. 2006. Keys to soil taxonomy. Ninth edition. Natural Resources Conservation Services, Department of Agriculture (USDA). United States. 332 p.
Takahashi, T., Y. Ikeda, K. Fujita and M. Nanzyo. 2006. Effect of liming on organically complexed aluminum of nonallophanic Andosols from northeastern Japan. Geoderma 130(1-2): 26-34.
Takahashi, T., T. Fukuuka and R.A. Dahlgren. 1995. Aluminum solubility and release rates from soil horizons dominated by aluminum - humus complexes. Soil Science and Plant Nutrition 41(1): 119-131.
Takahashi, T. and R.A. Dahlgren. 1998. Possible control of aluminum solubility by 1 M KCl treatment in some soil dominated by aluminum - humus complexes. Soil Science and Plant Nutrition 44(1): 43-51.
Urrutia, M., F. Macías y E. García - Rodeja. 1995. Evaluación del CuCl2 y del LaCl3 como extractantes de aluminio en suelos ácidos de Galicia. Nova Acta Científica Compostelana (Bioloxía) 5: 173 -182.
Van Breemen, N. and P. Buurman. 2002. Soil formation. Second edition. Kluwer Academic Publishers, Dordrecht, Netherland. 404 p.
Van Hees, P.A., U.S. Lundstrom, M. Starr and R. Giesler. 2000. Factors influencing aluminium concentrations in soil solution from podzols. Geoderma 94(2-4): 289-310.
Vettori, L. 1969. Métodos de análise de solo. Ministério da Agricultura. Boletim Técnico No. 7. Rio de Janeiro. 24 p.
White, I., M.D. Melville, B. Wilson and J. Sammut. 1997. Reducing acidic discharges from coastal wetlands in eastern Australia. Wetlands Ecology and Management 5(1): 55-72.
Zambrosi, F., L. Alleoni e E. Caires. 2007. Aplicação de gesso agrícola e especiação iônica da solução de um Latossolo sob sistema plantio direto. Ciência Rural, Santa Maria 37(1): 110-117.
Zołotajkin, M., A. Smoliński, J. Ciba, J. Kluczka and M. Skwira. 2014. Comparison of the chemical properties of forest soil from the Silesian Beskid, Poland. Journal of Chemistry. Vol. 2014, Article ID 748236, 8 p. doi: 10.1155/2014/748236.
References
Abreu, C.H., T. Muraoka and A.F. Lavorante. 2003. Exchangeable aluminum evaluation in acid soils. Scientia Agricola 60(3): 543-548.
Ahern, C.R., A.E. McLnea and L.A. Sullivan. 2004. Acid Sulfate Soils Laboratory Methods Guidelines. Queensland Department of Natural Resources, Mines and Energy, Indooroopilly, Queensland, Australia. 132 p.
Auxtero, E., M. Madeira and D. Parker. 2012. Extractable Al and Soil Solution Ionic Concentrations in Strongly Leached Soils from Northwest Iberia: Effects of Liming. International Scholarly Research Notices. DOI: 10.5402/2012/105627.
Bertsch, P.M. and P.R. Bloom. 1996. Aluminum. pp. 517-550. In: Sparks, D.L., A.L. Page, P.A. Helmke, R.H. Loeppert, P.N. Soltanpour, M.A. Tabatabai, C.T. Johnston and M.E. Summer (eds.). Methods of Soil Analysis. Book Series No. 5. Soil Science Society of America Inc., Madison, Wisconsin 1.390 p.
Bloom, P.R. and M.B. McBride. 1979. Metal ion binding and exchange with hydrogen ions in acid - washed peat. Soil Science Society of America Journal 43(4): 687-692.
Bloom, P.R., U.L. Skyllberg and M.E. Sumner. 2005. Soil acidity. pp. 411-459. In: Tabatabai, M.A and D.L. Sparks (eds.). Chemical Processes in Soils. Soil Science Society of America. Book Series No. 8. Madison, Wisconsin. 1.188 p.
Buurman, P., L.B. Van and J. Velthor. 1996. Manual for Soil and Water Analyses. Backhuys Publishers, Leiden. The Netherlands. 314 p.
Cronan, C.S., W.J. Walter and P.R. Bloom. 1986. Predicting aqueous aluminum concentrations in natural waters. Nature 324: 140-143.
Defelipo, B.V. e A.C. Ribeiro. 1991. Análise Química do Solo. Segunda edição. Universidade Federal de Viçosa, Viçosa. 26 p.
Dijkstra, F. and R. Fitzhugh. 2003. Aluminum solubility and mobility in relation to organic carbon in surface soils affected by six tree species of the northeastern United States. Geoderma 114(1-2): 33-47.
Drabek, O., L. Boruvka, L. Mladkova and M. Kocarek. 2003. Possible method of aluminum speciation in forest soils. Journal of Inorganic Biochemistry 97(1): 8-15.
Empresa Brasileira de Pesquisa Agropequaria - EMBRAPA. 2006. Centro Nacional de Pesquisa de Solos. Sistema Brasileiro de classificação de solos. Segunda edição. Embrapa Solos, Rio de Janeiro, 306 p.
Empresa Brasileira de Pesquisa Agropequaria - EMBRAPA 1999. Manual de análises químicas de solos, plantas e fertilizantes. Organizador: Fábio Cesar da Silva. Embrapa Comunicação para Transferência de Tecnologia, Brasília. 370 p.
Ebeling, A.G., L.D. Anjos, D.V. Perez, M.G. Pereirae e G.S. Valladares. 2008. Relação entre acidez e outros atributos químicos em solos com teores elevados de matéria orgânica. Bragantia 67(2): 261-266.
García, E., J.C. Nóvoa, X. Pontevedra, A. Martínez and P. Buurman. 2004. Aluminium fractionation of European volcanic soils by selective dissolution techniques. Catena 56(1-3): 155-183.
Hargrove, W.L. and G.W. Thomas. 1984. Extraction of aluminum from aluminum organic matter in relation to titratable acidity. Soil Science Society of America Journal 48(6): 1458-1460.
Hargrove, W.I. and G.W. Thomas. 1981. Extraction of aluminum form aluminum organic matter complexes. Soil Science Society of America Journal 45(1): 151-153.
Hendershot, W.H. and M. Duquette. 1986. A simple barium chloride method for determining cation exchange capacity and exchangeable cations. Soil Science Society of America Journal 50(3): 605-608.
Hicks, W., G. Bowmanand and R. Fitzpatrick. 2002. The geochemistry of Australian tropical acid sulfate soil and their environment hazard. In: Symposium VI. Paper No. 238.17th World Congress Soil Science Thailand.
Hoeft, R.G., L.M. Walsh and D.R. Keeney. 1973. Evaluation of various extractants for available soil sulfur. Soil Science Society of America Journal 37(3): 401-411.
Juo, A.S. and E.J. Kamprath. 1979. Copper chloride as on extractant for estimating the potentially reactive aluminum pool in acid soils. Soil Science Society of America Journal 43(1): 35-58.
Jusop, S. and S. Muhrizal. 2002. Pyrite in acid sulfate soils: transformation and inhibition of its oxidation by application of natural materials. En: http://www.ldd.go.th/Wcss2002/papers/0097.pdf; consulta: febreiro 2007.
Kamprath, E.J. 1970. Exchangeable aluminum as a criterion for liming leached mineral soils. Soil Science Society of America Journal 34(2): 252-254.
Kaiser, K. and W. Zech. 1996. Defects in estimation of aluminum in humus complexes of podzolic soils by pyrophosphate extractions. Soil Science 161(7): 452-458.
Mrvić, V., M. Jakovljević, D. Stevanović, D. Čakmak and M. Zdravković. 2008. Methods for the determination of the form of aluminium: Pseudogley soils. Journal of the Serbian Chemical Society 73(6): 673-680.
McLean, E.O. 1976. Chemistry of soil aluminum. Communication Soil Science Plant Analyses 7(7): 619-636.
Noble, A.D., M. Cannon and D. Muller. 1997. Evidence of accelerated soil acidification under stylosanthes-dominated pastures. Australian Journal of Soil Research. 35(6): 1309-1322.
Oates, K.M. and E.J. Kamprath. 1983. Soil acidity and limming: II. Evaluation of using aluminium extracted by various chloride salts for determining lime requeriments. Soil Science Society of America Journal 47(4): 690-692.
Perez, V.D, L.H. Cunha dos Anjos, A. Gilvani Ebeling and G.M. Pereira. 2009. Comparison of H/Al stoichiometry of mineral and organic soils in Brazil. Revista Brasileira de Ciência do Solo 33(4): 1071-1076.
Porebska, G. and J. Mulder. 1996. The chemistry of aluminium in strongly acidified sandy soil in Poland. European Journal of Soil Science 47(1): 81-87.
Rizzato, M., P. Vidal, X.L. Otero, V. Moreira e F. Macías. 2010. Seletividade do pirofosfato de sódio e de cloretos não tamponados (CuCl2 e LaCl3) como extratores de alumínio associado à matéria orgânica em solos de restinga do estado de São Paulo. Revista Brasileira de Ciência do Solo 34: 1561-1572.
Soil Survey Division Staff - SSS. 2006. Keys to soil taxonomy. Ninth edition. Natural Resources Conservation Services, Department of Agriculture (USDA). United States. 332 p.
Takahashi, T., Y. Ikeda, K. Fujita and M. Nanzyo. 2006. Effect of liming on organically complexed aluminum of nonallophanic Andosols from northeastern Japan. Geoderma 130(1-2): 26-34.
Takahashi, T., T. Fukuuka and R.A. Dahlgren. 1995. Aluminum solubility and release rates from soil horizons dominated by aluminum - humus complexes. Soil Science and Plant Nutrition 41(1): 119-131.
Takahashi, T. and R.A. Dahlgren. 1998. Possible control of aluminum solubility by 1 M KCl treatment in some soil dominated by aluminum - humus complexes. Soil Science and Plant Nutrition 44(1): 43-51.
Urrutia, M., F. Macías y E. García - Rodeja. 1995. Evaluación del CuCl2 y del LaCl3 como extractantes de aluminio en suelos ácidos de Galicia. Nova Acta Científica Compostelana (Bioloxía) 5: 173 -182.
Van Breemen, N. and P. Buurman. 2002. Soil formation. Second edition. Kluwer Academic Publishers, Dordrecht, Netherland. 404 p.
Van Hees, P.A., U.S. Lundstrom, M. Starr and R. Giesler. 2000. Factors influencing aluminium concentrations in soil solution from podzols. Geoderma 94(2-4): 289-310.
Vettori, L. 1969. Métodos de análise de solo. Ministério da Agricultura. Boletim Técnico No. 7. Rio de Janeiro. 24 p.
White, I., M.D. Melville, B. Wilson and J. Sammut. 1997. Reducing acidic discharges from coastal wetlands in eastern Australia. Wetlands Ecology and Management 5(1): 55-72.
Zambrosi, F., L. Alleoni e E. Caires. 2007. Aplicação de gesso agrícola e especiação iônica da solução de um Latossolo sob sistema plantio direto. Ciência Rural, Santa Maria 37(1): 110-117.
Zołotajkin, M., A. Smoliński, J. Ciba, J. Kluczka and M. Skwira. 2014. Comparison of the chemical properties of forest soil from the Silesian Beskid, Poland. Journal of Chemistry. Vol. 2014, Article ID 748236, 8 p. doi: 10.1155/2014/748236
How to Cite
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Download Citation
CrossRef Cited-by
1. Enrique Combatt Caballero, Alfredo Jarma Orozco, Manuel Palencia Luna. (2019). Modeling the Requirements of Agricultural Limestone in Acid Sulfate Soils of Brazil and Colombia. Communications in Soil Science and Plant Analysis, 50(8), p.935. https://doi.org/10.1080/00103624.2019.1594877.
Dimensions
PlumX
Article abstract page views
Downloads
License
Copyright (c) 2015 Revista Facultad Nacional de Agronomía Medellín

This work is licensed under a Creative Commons Attribution-NonCommercial 4.0 International License.
The journal allows the author(s) to maintain the exploitation rights (copyright) of their articles without restrictions. The author(s) accept the distribution of their articles on the web and in paper support (25 copies per issue) under open access at local, regional, and international levels. The full paper will be included and disseminated through the Portal of Journals and Institutional Repository of the Universidad Nacional de Colombia, and in all the specialized databases that the journal considers pertinent for its indexation, to provide visibility and positioning to the article. All articles must comply with Colombian and international legislation, related to copyright.
Author Commitments
The author(s) undertake to assign the rights of printing and reprinting of the material published to the journal Revista Facultad Nacional de Agronomía Medellín. Any quotation of the articles published in the journal should be made given the respective credits to the journal and its content. In case content duplication of the journal or its partial or total publication in another language, there must be written permission of the Director.
Content Responsibility
The Faculty of Agricultural Sciences and the journal are not necessarily responsible or in solidarity with the concepts issued in the published articles, whose responsibility will be entirely the author or the authors.