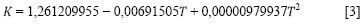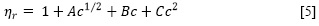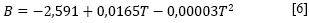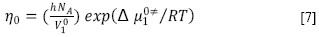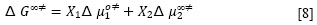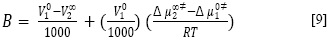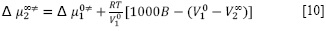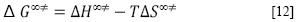Interacciones moleculares de las soluciones acuosas diluidas de nitrato de sodio a partir de datos viscosimétricos
Molecular interactions of aqueous sodium nitrate solutions from viscometric data
DOI:
https://doi.org/10.15446/rev.colomb.quim.v45n1.57200Palabras clave:
mezclas binarias, viscosidad dinámica, parámetros de activación, Jones-Dole (es)binary mixtures, dynamic viscosity, activation parameters, Jones-Dole (en)
Se determinaron experimentalmente los tiempos de flujo de soluciones NaNO3 + H2O en el intervalo de concentración molal 0,0000-0,9996 (mol/kg) . Se usó un microviscosímetro automático Anton Paar®, modelo AMVn, a temperaturas desde 283,15 K hasta 318,15 K cada 5 K y presión atmosférica de 0,101 MPa. A partir de los datos obtenidos, se calcularon las viscosidades dinámicas (), los coeficientes de viscosidad, y de la ecuación de Jones-Dole, y los parámetros de activación del flujo viscoso (, y ) a dilución infinita. Los coeficientes resultaron positivos al igual que . De acuerdo con el análisis del signo de este último, el NaNO3 actúa como un soluto formador de la estructura del agua. Por otro lado, los parámetros de activación del flujo viscoso a dilución infinita (, y ) revelaron que el proceso de flujo viscoso es endotérmico con un claro predominio de las interacciones ión-solvente.
Flow times of aqueous sodium nitrate solutions in the molal concentration interval 0.0000 to 0.9996 (mol/kg) were determined by using an automatic microviscosimeter AMVn Anton Paar® at temperatures ranging from 283.15 K to 318.15 K every 5 K and atmospheric pressure of 0.101 MPa. From the data obtained, the dynamic viscosities (), the viscosity coefficients , , and form the Jones-Dole equation, and the activation parameters of viscous flow (, and ) at infinite dilution were calculated. The coefficients , , and were positive as well as . On the one hand, according to the sign analysis, sodium nitrate acts as a structure-forming solute of the water. On the other hand, the activation viscous flow parameters at infinite dilution (, y ) revealed that the viscous flow process is endothermic with a clear ion-solvent interactions predominance.
DOI: https://doi.org/10.15446/rev.colomb.quim.v45n1.57200
Interacciones moleculares de las soluciones acuosas diluidas de nitrato de sodio a partir de datos viscosimétricos
Molecular interactions of aqueous sodium nitrate solutions from viscometric data
Interacções moleculares de soluções aquosas diluídas de nitrato de sódio a partir de dados viscosimétricos
Manuel S. Páez1*, Dairo E. Pérez1, Oscar L. Julio1
1 Grupo de fisicoquímica de mezclas líquidas, Laboratorio de Termodinámica de soluciones, Facultad de Ciencias Básicas, Departamento de Química, Universidad de Córdoba. Carrera 6 No. 76-103. Km 3. Vía Cereté. Córdoba. Colombia.
*autor para correspondencia: mspaezm@gmail.edu.co
Article citation: Páez, M. S.; Pérez, D. E.; Julio, O. L. Interacciones moleculares de las soluciones acuosas diluidas de nitrato de sodio a partir de datos viscosimétricos. Rev. Colomb. Quim. 2016, 45(1), 21-26. DOI: https://doi.org/10.15446/rev.colomb.quim.v45n1.57200
Recibido: 19 de Enero de 2016. Aceptado: 7 de Marzo de 2016.
Resumen
Se determinaron experimentalmente los tiempos de flujo de soluciones NaNO3 + H2O en el intervalo de concentración molal 0,0000-0,9996 (mol/kg). Se usó un microviscosímetro automático Anton Paar®, modelo AMVn, a temperaturas desde 283,15 K hasta 318,15 K cada 5 K y presión atmosférica de 0,101 MPa. A partir de los datos obtenidos, se calcularon las viscosidades dinámicas (η), los coeficientes de viscosidad A , B y C de la ecuación de Jones-Dole, dB/dT y los parámetros de activación del flujo viscoso (ΔG∞‡, ΔH∞‡ y ΔS∞‡) a dilución infinita. Los coeficientes A, B y C resultaron positivos al igual que dBIdT. De acuerdo con el análisis del signo de este último, el NaNO3 actúa como un soluto formador de la estructura del agua. Por otro lado, los parámetros de activación del flujo viscoso a dilución infinita (ΔG∞‡, ΔH∞‡ y ΔS∞‡) revelaron que el proceso de flujo viscoso es endotérmico con un claro predominio de las interacciones ión-solvente.
Palabras clave: Mezclas binarias, viscosidad dinámica, parámetros de activación, Jones-Dole.
Abstract
Flow times of aqueous sodium nitrate solutions in the molal concentration interval 0.0000 to 0.9996 (mol kg) were determined by using an automatic microviscosimeter AMVn Anton Paar® at temperatures ranging from 283.15 K to 318.15 K every 5 K and atmospheric pressure of 0.101 MPa. From the data obtained, the dynamic viscosities (η), the viscosity coefficients A, B, and C form the Jones-Dole equation, dBIdT and the activation parameters of viscous flow (ΔG∞‡, ΔH∞‡ and ΔS∞‡) at infinite dilution were calculated. The coefficients A, B, and C were positive as well as dBIdT. On the one hand, according to the sign analysis, sodium nitrate acts as a structure-forming solute of the water. On the other hand, the activation viscous flow parameters at infinite dilution (ΔG∞‡, ΔH∞‡ y ΔS∞‡) revealed that the viscous flow process is endothermic with a clear ion-solvent interactions predominance.
Keywords: Binary mixtures, dynamic viscosity, activation parameters, Jones-Dole.
Resumo
Foram determinados experimentalmente os tempos de fluxo de soluções NaNO3 + H2O na gama de concentração molal 0,0000-0,9996 (mol/kg). Foi utilização um microviscosímetro automático Anton Paar® modelo AMVn, a temperaturas desde 283,15 K até 318,15 K cada 5 K e à pressão atmosférica de 0,101 MPa. A partir dos dados obtidos foram calculadas as viscosidades dinâmicas (η), os coeficientes de viscosidade A, B, e C da equação Jones-Dole, dB/dT e os parámetros de activajao de fluxo viscoso (ΔG∞‡, ΔH∞‡ e ΔS∞‡) a diluição infinita. Os coeficientes A, B, e C foram positivos, como dB/dT. De acordo com a análise do signo deste último, o NaNO3 age como um soluto formador da estrutura da água. Além disso, os parâmetros de ativação do fluxo viscoso à diluição infinita (ΔG∞‡, ΔH∞‡ y ΔS∞‡) revelaram que o processo de fluxo viscoso é endotérmico com uma clara predominância de interações íon-solvente.
Palavras-Chave: Misturas binárias, viscosidade dinâmica, parâmetros de ativação, Jones-Dole.
Introducción
La viscosidad es una propiedad de transporte que consigue explicar otros fenómenos y, por tanto, posee numerosas aplicaciones. Las propiedades volumétricas y viscosimétricas de las soluciones, especialmente aquellas que involucran sistemas electrolíticos tales como la densidad, la viscosidad, el coeficiente B, así como los parámetros de activación del flujo viscoso ΔG∞‡, ΔH∞‡ y ΔS∞‡ a dilución infinita, juegan un papel sumamente importante en numerosos procesos industriales y farmacéuticos, debido a que su estudio proporciona información valiosa acerca de las interacciones soluto-solvente en la solución.
Por ejemplo, la viscosidad de una disolución de un polímero es un factor a considerar en la aplicación de un recubrimiento, dado que, si el recubrimiento se va aplicar con pistola de aspersión, se requiere menor viscosidad que en el caso de la aplicación con brocha. En ambos casos, es necesario que la viscosidad se incremente gradualmente y de forma adecuada a medida que el disolvente se evapora.
Del mismo modo, los resultados de los parámetros derivados de la viscosidad a menudo son usados en medicina y química farmacéutica para predecir la absorción y la permeabilidad de fármacos a través de membranas biológicas (1, 2). Es bien conocido que los datos viscosimétricos y otros datos termodinámicos proporcionan información valiosa con respecto a las interacciones moleculares en solución. Por tal razón, el estudio de las propiedades fisicoquímicas de mezclas líquidas es esencial para contribuir a un mejor entendimiento de la teoría del estado líquido.
La viscosidad es afectada por varios parámetros: la masa molecular, la forma y el tamaño de las moléculas, la concentración, la temperatura y las interacciones moleculares (hidrofílicas, hidrofóbicas, e interacciones iónicas), por tanto, el estudio de la viscosidad de soluciones acuosas de electrolitos en función de la temperatura y la composición podría ayudar a comprender las interacciones ión-ión e ión-solvente (3). Algunos investigadores han reportado viscosidades de electrólitos 1:1 y discuten los resultados en términos de interacciones usando la ecuación de Jones-Dole (4-6), de manera que se empleó esta ecuación como modelo.
El propósito de este estudio consistió en evaluar experimentalmente la viscosidad y calcular sus propiedades derivadas, a fin de examinar los cambios estructurales y discutirlos en términos de las interacciones moleculares dominantes en las condiciones de estudio: 0,101 MPa y temperaturas desde 283,15 K hasta 318,15 K.
Materiales y métodos
Los reactivos empleados fueron nitrato de sodio (NaNO3) grado analítico (99%) Sigma-Aldrich. El agua usada para preparar las soluciones fue destilada dos veces y desgasificada hasta obtener una conductividad menor de 2,0 µS/cm.
Las soluciones del sistema NaNO3 + H2O, fueron preparadas en la escala de molalidad 0,0000-0,9996 mol/kg, utilizando el método gravimétrico, en recipientes de vidrio con tapa hermética, tomando todas las precauciones necesarias para evitar la contaminación de las muestras y la pérdida de agua por evaporación. Todas las medidas de masa fueron realizadas en una balanza analítica marca Precisa ES 225 SM-DR con una incertidumbre de ± 1x10-5 g.
Las densidades experimentales en la región de trabajo de las soluciones acuosas de NaNO3 se midieron con un densímetro digital de tubo vibratorio Anton Paar® DMA 5000, en el intervalo de temperatura 283,15-318,15 K y a la presión atmosférica 0,101 MPa. La celda del DMA se calibró con aire seco y agua ultra pura a presión atmosférica (7). Las muestras fueron termostatadas y controladas a ± 0,001 K. La incertidumbre en el valor de la densidad determinada fue de±0,2x 10-5 g/cm.
Las viscosidades de las diferentes mezclas binarias en la región de trabajo se determinaron con un icroviscosímetro Automático Anton Paar® (AMVn) a presión atmosférica 0,101 MPa, en el intervalo de temperaturas 283,15-318,15 K, cada 5 K. La temperatura en las mediciones se controló mediante un sensor Pt 100 con una resolución de ± 0,01 K. El principio de medición del viscosímetro es la ley de Stokes, ecuación [1] (8), que arroja los tiempos de flujo y calcula automáticamente la viscosidad absoluta, previa incorporación de la densidad de la muestra. La viscosidad se obtuvo con una incertidumbre de ± 0,001 mPa s.
En esta ecuación pb = 7,73000 g/cm3 es la densidad de la esfera, t es el tiempo de flujo, y K es la constante de calibración (8), la cual se obtuvo usando agua como líquido de calibración y los datos de viscosidad reportados por Riddick y Bunger (9). Se trabajó con un ángulo de inclinación de 30° a todas las temperaturas.
Resultados y discusión
Los datos experimentales de la densidad del sistema NaNO3 + H2O, fueron ajustados por un procedimiento de mínimos cuadrados conforme a la ecuación [2]
Donde p es la densidad de la solución, ra (mol/kg) es la molalidad del NaNO3 en la mezcla NaNO3 + H2O, T es la temperatura absoluta, a es la desviación estándar y las letras minúsculas desde a hasta j son parámetros ajustables. Los resultados de este ajuste se muestran en la Tabla 1, estos permiten obtener densidades de la mezcla NaNO3 + H2O, con la desviación estándar (σ) especificada en dicha tabla.
A partir de los datos generados con la ecuación [2], y con ayuda de la ecuación de la ley de Stokes (ecuación [1] (8), se evaluó la viscosidad dinámica, η (mPa s) del sistema NaNO3 / H2O, a diferentes temperaturas de trabajo, previa determinación de la constante de calibración K (mPacm3/g).
Los valores encontrados de K son reunidos en la ecuación [3].
con una incertidumbre de σ = ± 0,00002482027 (mPa . cm3/g).
La viscosidad dinámica de las soluciones acuosas de nitrato de sodio alcanzada (η), concuerda satisfactoriamente con la tendencia obtenida por Isono (10) η = f(m), en el intervalo de concentración 0,0500-8,0000 m (mol/kg). Sin embargo, este trabajo, a diferencia del elaborado por Isono (10), se enfocó de manera más precisa en el intervalo diluido 0,0000-0,99963 (mol/kg), para de esta forma poder analizar mejor las interacciones moleculares que ocurren en solución. De igual forma, los datos experimentales para la viscosidad dinámica del sistema NaNO3 / H2O, fueron ajustados por un procedimiento de mínimos cuadrados con ayuda de la ecuación [4].
Donde η es la viscosidad dinámica de la solución, m (mol/kg) es la molalidad del NaNO3 en la mezcla NaNO3 / H2O, T es la temperatura absoluta, σ es la desviación estándar y las letras minúsculas desde a hasta h son parámetros ajustables. Los resultados de este ajuste se muestran en la Tabla 1, junto a los resultados de densidad y desviación estándar (σ).
A partir de las viscosidades dinámicas de la solución obtenidas con la ecuación [4], se determinó la viscosidad relativa (ηr) como la razón de la viscosidad dinámica de la solución respecto a la del solvente puro (η0). Estas viscosidades, a su vez, se ajustaron usando un procedimiento de mínimos cuadrados con la ecuación [5] de Jones-Dole para soluciones electrolíticas (11).
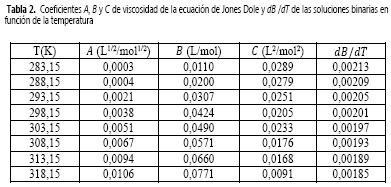
Donde c es la molaridad (mol/L), A, también llamado coeficiente de Falkenhagen, es una constante positiva que mide las interacciones de largo alcance ion-ion (fuerzas de Coulomb), B es una constante que tiene en cuenta la interacción ion-solvente (12) y el coeficiente de C incluye todas las interacciones estructurales soluto-solvente y soluto-soluto que no se toman en cuenta en los términos Ac1/2 y Be (11). Las constantes A, B y C son parámetros de ajustables y T es la temperatura en Kelvin. Los resultados de este ajuste se muestran en la Tabla 2.
El hecho de que los coeficientes B y C sean mucho mayores que A demuestra que las interacciones ion-solvente dominan el comportamiento fisicoquímico de este sistema, mientras que, los valores no nulos del parámetro A indican que en estas soluciones también se encuentran otro tipo de interacciones, que si bien no son dominantes, juegan un papel determinante a la hora de definir las propiedades de este sistema.
La dependencia del coeficiente B de viscosidad de la ecuación anterior, con respecto a la temperatura, fue expresada con una ecuación [6].
Los resultados de este ajuste, igual que los de dB/dT, se muestran en la Tabla 2.
Debido a que el coeficiente B y dBIdT son positivos, podría indicarse que en la solución acuosa de nitrato de sodio se forman agregados hidrofóbicos y que el soluto está fuertemente hidratado (15), es decir, el NaNO3 se comporta como un soluto formador (cosmotrópico) de la estructura del agua (14, 15). Por otra parte, el valor positivo del coeficiente C podría indicar el favorecimiento de autointeracciones iónicas e interacciones entre iones de signo opuesto no contempladas en los términos Ac1/2 Be (16). Esto reafirma la interpretación previamente atribuida a los parámetros A, B y C, analizados conjuntamente.
Los datos de viscosidad también fueron examinados a través de la teoría del estado de transición de Eyring, donde un líquido está compuesto por moléculas distribuidas al azar, separadas por espacios libres, que están divididas, a su vez, por un gran número de pequeñas unidades llamadas cavidades. Se supone que estas cavidades se mueven con el volumen del líquido y que el salto de las moléculas desde una cavidad hacia otra, bajo la acción de algún esfuerzo cortante, causa el flujo de los líquidos. Durante este proceso, una molécula sólo puede moverse si está en la cercanía de una cavidad y posee un exceso de energía libre para pasar a ella. La viscosidad entonces es función del volumen y la temperatura (17). En este sentido, para un líquido puro se ha demostrado que se cumple la siguiente ecuación [7] (18).
Donde h es la constante de Planck, NA es el número de Avogadro, η0 es la viscosidad del solvente en Pa s, V10 es el volumen molar del solvente puro en m3/mol, R es la constante de los gases y Δµ10‡ es la contribución por mol del solvente de la energía libre de activación del flujo viscoso de la solución.
Cuando una solución fluye, tanto el soluto como las moléculas del solvente se mueven bajo la fuerza de cizallamiento. Entonces, la energía de activación del flujo viscoso para la solución (ΔG∞‡), cuando la concentración del soluto tiende a cero (m2→0), se puede escribir conforme a la ecuación [8].
Donde X1 y X2 son las fracciones molares del solvente y soluto, respectivamente. Δµ∞‡2 como se define en la ecuación anterior, incluye cualquier cambio en la energía libre de activación de las moléculas de disolvente causados por la presencia del soluto, así como la contribución del movimiento propia del soluto (19). De acuerdo con la teoría de Feakins (20), el coeficiente B de viscosidad está relacionado con Δµ∞‡2 por la ecuación [9].
Esta puede ser reorganizada de la siguiente manera, ecuación [10].
Donde es volumen molar parcial del solvente puro (cm3/mol) y V∞2 es el volumen molar parcial estándar del soluto a dilución infinita. Los términos Xi y Mi denotan las fracciones molares y el peso molecular del H2O (M1) y del NaNO3 (M2) respectivamente. Los valores calculados de Δµ0‡2, Δµ∞‡2 y V∞ 2 son dados en la Tabla 3.
es volumen molar parcial del solvente puro (cm3/mol) y V∞2 es el volumen molar parcial estándar del soluto a dilución infinita. Los términos Xi y Mi denotan las fracciones molares y el peso molecular del H2O (M1) y del NaNO3 (M2) respectivamente. Los valores calculados de Δµ0‡2, Δµ∞‡2 y V∞ 2 son dados en la Tabla 3.
Se puede observar en la Tabla 3 que los valores de Δµ2∞‡ son positivos y más grandes que Δµ10‡ lo que podría indicar que el nitrato de sodio se comporta como un soluto formador de la estructura del agua, como previamente se había concluido. Por otra parte, los grandes valores de Δµ2∞‡ podrían ser consecuencia de las fuertes interacciones ión-solvente en este sistema. En otras palabras, la formación del estado de transición es menos favorecida en presencia del nitrato de sodio, es decir, la formación del estado de transición podría estar acompañada por la ruptura y la distorsión de las fuerzas intermoleculares en la estructura del solvente. En los estudios de Rajagopal y Jayabalakrishnan (19) y Mishra y Gautam (21) se encuentran resultados similares para otros sistemas de estudio.
La energía libre de activación del flujo viscoso (ΔG∞‡) para la solución cuando la concentración del soluto tiende a cero (m2→0) fue calculada con ayuda de la ecuación [11].
Los valores de la entalpía de activación (ΔH∞‡) y la entropía de activación (ΔS∞‡), cuando la concentración del soluto tiende a cero, fueron calculados usando la ecuación fundamental [12].
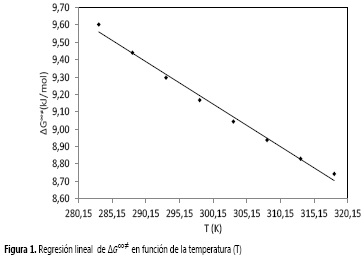
Aquí los valores de ΔH∞‡ y ΔS∞‡ fueron determinados usando un procedimiento de regresión lineal a partir de la Figura 1 de ΔG∞‡ en función de T. Los resultados se muestran en la Tabla 4, e indican que estos parámetros son independientes de la temperatura.
Los valores de ΔH∞‡, para el sistema de estudio son positivos, lo que podría indicar que el proceso del flujo viscoso es endotérmico. Esto implica que dicho proceso no es favorable termodinámicamente y es necesario hacer un trabajo sobre el sistema para romper la barrera energética en el proceso de flujo.
Los valores positivos de la variación de entropía de activación ΔS∞‡ muestran que las especies que forman el estado activado son más desordenadas que en el estado inicial, este último más estructurado. Este comportamiento se ha observado en otros sistemas de estudio (22-25).
Conclusiones
En este trabajo se reportan las viscosidades y densidades experimentales del sistema NaNO3 + H2O, en la región diluida (0,0000-0,9996 mol/kg), a las temperaturas desde 283,15 hasta 318,15 K, cada 5 K y a 0,101 MPa. Los coeficientes A, B y C del sistema NaNO3 + H2O son positivos en todo el intervalo de concentración a todas las temperaturas de estudio.
Los valores de los coeficientes B y C resultan ser mucho mayores que el coeficiente A, lo que indica un claro predominio de las interacciones ion-solvente. Adicionalmente los valores de dB/dT son positivos a lo largo de todas las isotermas y composiciones de NaN03, hecho que indica que el nitrato de sodio actúa como un soluto formador de la estructura del agua.
Por otro lado, cuando (m2→0), los valores de los parámetros de activación son positivos. Ll signo de ΔG∞‡ evidencia una dificultad mayor en el movimiento de los iones de la sal para desplazarse a través del disolvente, de ahí que se necesite mayor energía para saltar de una posición de equilibrio a la otra. Finalmente, el signo positivo de ΔH∞‡ y ΔS∞‡ implicaría que dicho proceso no es favorable termodinámicamente y además sugiere que las especies en el estado de transición presentan una estructura más desordenada que las especies en estado activado.
Agradecimientos
Los autores agradecen a la Universidad de Córdoba por el apoyo prestado para la realización de este trabajo.
Referencias
1. Iqbal, M. J.; Chaudhry, M.A. Thermodynamic study of three pharmacologically significant drugs: density, viscosity and refractive index measurements at different temperatures. J.Chem. Thermodyn. 2008, 41, 221-226. D0I: https://doi.org/10.1016/j.jct.2008.09.016.
2. Tarlok S. B.; Harpreet, S.; Parampaul, K. B. Volumetric and viscometric properties of some sulpha drugs in aqueous solutions of sodium chloride at T = (288.15 to 318.15) K. J. Chem. Eng. Data. 2010, 55, 3872-3881. D0I: https://doi.org/10.1021/je900798p.
3. Páez, M.; Cantero, P.; Peña, J. Viscosidades de la mezcla n,n-Dimetilformamida + I-Butanol a Diferentes Temperaturas. Inf. Tecnol. 2012, 23 (3), 149-156. D0I: https://doi.org/10.4067/s0718-07642012000300018.
4. Masood, S.; Saeed, R.; Ashfaq, M.; Irfan, A. Ion-solvent and ion-ion interactions of NaCl aqueous and aqueous maltose solutions at 298-323 K on viscosity data. Russ. J. Phys. Chem. A. 2014, 88 (12), 2102-2107. D0I: https://doi.orgI10.1134/s0036024414120346.
5. Saeed, R.; Uddin, F.; Fazal, A. Effect of electrolyte concentration on viscous flow of polymer solutions. J. Chem. Eng. Data. 2002, 47 (6), 1359-1362. D0I: https://doi.orgI10.1134/s0036024414120346.
6. Kharat, S. J. Density and viscosity studies of aqueous solutions of cesium trifluroacetate at different temperatures. J. Chem. Eng. Data. 2008, 53 (6), 1292-1294. D0I: https://doi.orgI10.1021/je700703h.
7. Spieweck, F.; Bettin, H. Solid and liquid density determination. Techn. Mess. 1992, 59 (6), 285-1292. D0I: https://doi.orgI10.1524Iteme.1992.59.6.237.
8. Instruction Manual AMVn Automated Microviscometer. Printed: Anton Paar, Austria, 2008, pp 43.
9. Riddick, J. A.; Bunger, W. B. Organic solvents. 3rd ed.; Wiley & Sons: New York, 1970; Vol. 2, pp 67-68.
10. Isono, T. Density, viscosity, and electrolytic conductivity of concentrated aqueous electrolyte solutions at several temperatures. Alkaline-earth chlorides, lanthanum chloride, sodium chloride, sodium nitrate, sodium bromide, potassium nitrate, potassium bromide, and cadmium nitrate. J Chem Eng Data 1984, 29 (1), 45-52. D0I: https://doi.orgI10.1021/je00035a016.
11. Kaminsky, M. The concentration and temperature dependence of the viscosity of aqueous solutions of strong electrolytes. III. KCl, K2S04, MgCl2, BeS04, and MgS04 solutions. Z. Physik. Chem. NeueFloge. 1957, 12, 206-231.
12. Svorstol, I.; Sigvartsen, T.; Songstad, T.; Ernster, L.; Lónnberg, H.; Berg, J E et al Solvent properties of dichioromethane VII Viscosity studies of electrolytes in dichioromethane Acta Chem Scand. 1988, 42, 133-144. D0I: https://doi.org/10.3891/acta.chem.scand.42b-0133.
13. Abdulagatov, I. M.; Zeinalova, A. B.; Azizov, N. D. Experimental viscosity B-coefficients of aqueous LiCl solutions. J. Mol. Liq. 2006, 126 (1-3), 75-88. D0I: https://doi.orgI10.1016/j.molliq.2005.10.006.
14. Páez, M.; Alvis, A.; Arrazola, G. Efecto de la temperatura sobre la viscosidad de soluciones acuosas diluidas de Cloruro de 1-Butil-3-metilImidazolio [Bmim+][Cl-]. Inf. Tecnol. 2014, 25 (3), 185-190. D0I: https://doi.org/10.4067/s0718-07642014000300021.
15. Motin, M. A.; Biswas, T. K.; Huque, E. M. Volumetric and viscosimetric studies on sodium nitrate and potassium nitrate in aqueous and H20-urea solutions. Monatsh. Chem. 2003, 134 (4), 475-487. D0I: https://doi.org/10.1007/s00706-002-0480-0.
16. Zhao, H Viscosity B-coefficients and standard partial molar volumes of amino acids, and their roles in interpreting the protein (enzyme) stabilization. Biophys. Chem. 2006, 122 (3), 157-183. D0I: https://doi.orgI10.1016Ij.bpc.2006.03.008.
17. Duangthongsuk, W.; Wongwises, S. Measurement of temperature-dependent thermal conductivity and viscosity of Ti02-water nanofluids. Exp. Therm. Fluid Sci. 2009, 33 (4), 706-714. D0I: https://doi.orgI10.1016Ij.expthermflusci.2009.01.005.
18. Shekaari, H; Jebali, F Solute-Solvent interactions of amino acids in aqueous 1-Propyl-3-Methylimidazolium bromide ionic liquid solutions at 298.15 K. J. Solution Chem. 2010, 39 (10), 1409-1427. D0I: https://doi.org/10.1007/s10953-010-9597-719.
19. Rajagopal, K.; Jayabalakrishnan, S. S. A volumetric and viscometric study of 4-aminobutyric acid in aqueous solutions of metformin hydrochloride at 308.15, 313.15 and 318.15 K. J. Serb. Chem. Soc. 2011, 76 (1), 129-142. D0I: https://doi.org/10.2298/jsc090616002r.
20. Glasstone, S.; Laidler, K.; Eyring, H. The theory of rate processes McGraw Hill: New York, 1941; p. 477.
21. Mishra, A. P.; Gautam, S. K. Viscometric and volumetric studies of some transition metal chlorides in glycine wáter solution. Indian J Chem. 2001, 40 (A), 100-104.
22. Sinha, B.; Sarkar, A.; Kumar, P.; Brahman, D. Physicochemical properties of L-Alanine in aqueous silver sulphate solutions at (298.15, 308.15, and 318.15) K. Int. J. Thermophys. 2011, 32 (10), 2062-2078. D0I: https://doi.org/10.1007/s10765-011-1060-523.
23. Yan, Z.; Wang, J.; Lu, J. Viscosity behavior of some α-amino acids and their groups in water-sodium acetate mixtures. Biophys. Chem. 2002, 99 (3), 199-207. DOI: https://doi.org/10.1016/s0301-4622(02)00200-4.
24. Khanuja, P. Volumetric and viscometric study of interactions of amino acids in aqueous sucrose solution at different temperatures. Chem. Sci. Trans. 2013, 2 (4), 1268-1275. DOI: https://doi.org/10.7598/cst2013.524.
25. Farhad, H. M.; Kumar, B. T.; Islam, M. N.; Entazul, H. M. Volumetric and viscometric studies on dodecyltrimethylammonium bromide in aqueous and in aqueous amino acid solutions in premicellar region. Monatsh. Chem. 2010, 141 (12),1297-1308. doi:10.1007/s00706-010-0402-5. DOI: https://doi.org/10.1007/s00706-010-0402-5.
Referencias
Iqbal, M. J.; Chaudhry, M.A. Thermodynamic study of three pharmacologically significant drugs: density, viscosity and refractive index measurements at different temperatures. J. Chem. Thermodyn. 2008, 41, 221–226. DOI: http://dx.doi.org/10.1016/j.jct.2008.09.016
Tarlok S. B.; Harpreet, S.; Parampaul, K. B. Volumetric and viscometric properties of some sulpha drugs in aqueous solutions of sodium chloride at T = (288.15 to 318.15) K. J. Chem. Eng. Data. 2010, 55, 3872–3881. DOI: http://dx.doi.org/10.1021/je900798p
Páez, M.; Cantero, P.; Peña, J. Viscosidades de la mezcla n,n-Dimetilformamida + I-Butanol a Diferentes Temperaturas. Inf. Tecnol. 2012, 23 (3), 149-156. DOI: http://dx.doi.org/10.4067/s0718-07642012000300018
Masood, S.; Saeed, R.; Ashfaq, M.; Irfan, A. Ion–solvent and ion–ion interactions of NaCl aqueous and aqueous maltose solutions at 298–323 K on viscosity data. Russ. J. Phys. Chem. A. 2014, 88 (12), 2102–2107. DOI: http://dx.doi.org/10.1134/s0036024414120346
Saeed, R.; Uddin, F.; Fazal, A. Effect of electrolyte concentration on viscous flow of polymer solutions. J. Chem. Eng. Data. 2002, 47 (6), 1359-1362. DOI: http://dx.doi.org/10.1134/s0036024414120346
Kharat, S. J. Density and viscosity studies of aqueous solutions of cesium trifluroacetate at different temperatures. J. Chem. Eng. Data. 2008, 53 (6), 1292-1294. DOI: http://dx.doi.org/10.1021/je700703h
Spieweck, F.; Bettin, H. Solid and liquid density determination. Techn. Mess. 1992, 59 (6), 285-1292. DOI: http://dx.doi.org/10.1524/teme.1992.59.6.237
Instruction Manual AMVn Automated Microviscometer. Printed: Anton Paar, Austria, 2008, pp 43.
Riddick, J. A.; Bunger, W. B. Organic solvents. 3rd ed.; Wiley & Sons: New York, 1970; Vol. 2, pp 67-68.
Isono, T. Density, viscosity, and electrolytic conductivity of concentrated aqueous electrolyte solutions at several temperatures. Alkaline-earth chlorides, lanthanum chloride, sodium chloride, sodium nitrate, sodium bromide, potassium nitrate, potassium bromide, and cadmium nitrate. J. Chem. Eng. Data. 1984, 29 (1), 45-52. DOI: http://dx.doi.org/10.1021/je00035a016
Kaminsky, M. The concentration and temperature dependence of the viscosity of aqueous solutions of strong electrolytes. III. KCl, K2SO4, MgCl2, BeSO4, and MgSO4 solutions. Z. Physik. Chem. Neue Floge. 1957, 12, 206-231.
Svorstol, I.; Sigvartsen, T.; Songstad, T.; Ernster, L.; Lönnberg, H.; Berg, J. E. et al. Solvent properties of dichioromethane. VII. Viscosity studies of electrolytes in dichioromethane. Acta Chem. Scand. 1988, 42, 133-144. DOI: http://dx.doi.org/10.3891/acta.chem.scand.42b-0133
Abdulagatov, I. M.; Zeinalova, A. B.; Azizov, N. D. Experimental viscosity B-coefficients of aqueous LiCl solutions. J. Mol. Liq. 2006, 126 (1-3), 75-88. DOI: http://dx.doi.org/10.1016/j.molliq.2005.10.006
Páez, M.; Alvis, A.; Arrazola, G. Efecto de la temperatura sobre la viscosidad de soluciones acuosas diluidas de Cloruro de 1-Butil-3-metilImidazolio [Bmim+][Cl-]. Inf. Tecnol. 2014, 25 (3), 185-190. DOI: http://dx.doi.org/10.4067/s0718-07642014000300021
Motin, M. A.; Biswas, T. K.; Huque, E. M. Volumetric and viscosimetric studies on sodium nitrate and potassium nitrate in aqueous and H2O-urea solutions. Monatsh. Chem. 2003, 134 (4), 475-487. DOI: http://dx.doi.org/10.1007/s00706-002-0480-0
Zhao, H. Viscosity B-coefficients and standard partial molar volumes of amino acids, and their roles in interpreting the protein (enzyme) stabilization. Biophys. Chem. 2006, 122 (3), 157–183. DOI: http://dx.doi.org/10.1016/j.bpc.2006.03.008
Duangthongsuk, W.; Wongwises, S. Measurement of temperature-dependent thermal conductivity and viscosity of TiO2-water nanofluids. Exp. Therm. Fluid Sci. 2009, 33 (4), 706-714. DOI: http://dx.doi.org/10.1016/j.expthermflusci.2009.01.005
Shekaari, H.; Jebali, F. Solute–Solvent interactions of amino acids in aqueous 1-Propyl-3-Methylimidazolium bromide ionic liquid solutions at 298.15 K. J. Solution Chem. 2010, 39 (10), 1409–1427. DOI: http://dx.doi.org/10.1007/s10953-010-9597-7
Rajagopal, K.; Jayabalakrishnan, S. S. A volumetric and viscometric study of 4-aminobutyric acid in aqueous solutions of metformin hydrochloride at 308.15, 313.15 and 318.15 K. J. Serb. Chem. Soc. 2011, 76 (1), 129–142. DOI: http://dx.doi.org/10.2298/jsc090616002r
Glasstone, S.; Laidler, K.; Eyring, H. The theory of rate processes. McGraw Hill: New York, 1941; p. 477.
Mishra, A. P.; Gautam, S. K. Viscometric and volumetric studies of some transition metal chlorides in glycine wáter solution. Indian J. Chem. 2001, 40 (A), 100-104.
Sinha, B.; Sarkar, A.; Kumar, P.; Brahman, D. Physicochemical properties of L-Alanine in aqueous silver sulphate solutions at (298.15, 308.15, and 318.15) K. Int. J. Thermophys. 2011, 32 (10), 2062-2078. DOI: http://dx.doi.org/10.1007/s10765-011-1060-5
Yan, Z.; Wang, J.; Lu, J. Viscosity behavior of some α-amino acids and their groups in water-sodium acetate mixtures. Biophys. Chem. 2002, 99 (3), 199-207. DOI: http://dx.doi.org/10.1016/s0301-4622(02)00200-4
Khanuja, P. Volumetric and viscometric study of interactions of amino acids in aqueous sucrose solution at different temperatures. Chem. Sci. Trans. 2013, 2 (4), 1268-1275. DOI: http://dx.doi.org/10.7598/cst2013.524
Farhad, H. M.; Kumar, B. T.; Islam, M. N.; Entazul, H. M. Volumetric and viscometric studies on dodecyltrimethylammonium bromide in aqueous and in aqueous amino acid solutions in premicellar region. Monatsh. Chem. 2010, 141 (12),1297–1308. doi:10.1007/s00706-010-0402-5. DOI: http://dx.doi.org/10.1007/s00706-010-0402-5
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Manuel Páez Meza, Dairo Pérez Sotelo, María Vergara Hernández, Enoc Arciria Pico, Said Figueredo López. (2018). Viscometric, thermodynamic and theoretical DFT studies of dl-2-aminobutyric acid in aqueous sodium nitrate solutions at different temperatures. Journal of Molecular Liquids, 271, p.599. https://doi.org/10.1016/j.molliq.2018.09.012.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).