PURIFICACIÓN Y CARACTERIZACIÓN DE alfa-AMILASA DE PENICILLIUM COMMUNE PRODUCIDA MEDIANTE FERMENTACIÓN EN FASE SÓLIDA
Palabras clave:
alfa-amilasa, Penicillium commune, fermentación en fase sólida, yuca blanca colombiana. (es)PURIFICACIÓN Y CARACTERIZACIÓN DE α-AMILASA DE PENICILLIUM COMMUNE PRODUCIDA MEDIANTE FERMENTACIÓN EN FASE SÓLIDA
PURIFICATION AND CHARACTERIZATION OF α-AMYLASE FROM PENICILLIUM COMMUNE PRODUCED BY SOLID STATE FERMENTATION
PURIFICAÇÃO E CARACTERIZAÇÃO DA α-AMILASA DEPENICILLIUM COMMUNE PRODUZIDA MEDIANTE FERMENTAÇÃO EM FASE SÓLIDA
Esperanza Espinel1,2, Elizabeth López1,3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia.
2 Dirección actual Colegio Marruecos y Molinos IED, SED. Bogotá, Colombia. neespinelb@unal.edu.co
Recibido: 17/12/08 - Aceptado: 21/08/09
RESUMEN
Este estudio reporta la purificación y caracterización parcial de una α-amilasa producida por Penicillium communemediante fermentación en fase sólida, empleando yuca blanca colombiana (Manihot esculenta Crantz) como soporte. La enzima fue purificada por precipitación fraccionada con sulfato de amonio, cromatografía de intercambio aniónico (DEAE-Sephadex A-50), cromatografía de filtración por gel (Sephadex G-75) y cromatografía de intercambio catiónico (CM-Sephadex C-50) obteniendo una actividad específica final de 314,82 U/mg, un grado de purificación del orden de 62 y un rendimiento de 9%. La purificación hasta la homogeneidad fue confirmada por SDS-PAGE. El peso molecular estimado fue 35 kDa. La enzima mostró máxima actividad de hidrólisis de almidón soluble con pH 6,0, y estabilidad en un intervalo de pH de 5,0-7,0. La estabilidad térmica de la enzima se presentó en el intervalo de temperatura 0-50 °C y su temperatura óptima fue 70 °C. Los iones Ca2+,Ba2+ y Ag+aumentaron significativamente la actividad de la enzima, siendo el ión Ca2+ el que tuvo el más alto poder activador. Cu2+ no alteró significativamente la actividad de la enzima, mientras que Li+ yFe3+ la disminuyeron ligeramente (13%), y Co2+ y Hg2+ la disminuyeron 25% y 40% respectivamente. Los valores de Km y Vmáxfueron calculados usando la linealización de Lineweaver-Burk, con el resultado Km = 0,48 mg/mL y Vmáx = 5,85 µmol glucosa/min. Entre los principales productos de hidrólisis del almidón de yuca se encuentran la maltosa y la glucosa, este resultado proporciona evidencia de que la enzima es capaz de romper los enlaces glicosídicos α-1,4 del almidón, comportamiento característico de una α-amilasa.
Palabras clave: α-amilasa, Penicillium commune, fermentación en fase sólida, yuca blanca colombiana.
ABSTRACT
This study reports the purification and partial characterization of an α-amylase from Penicillium communeproduced by solid state fermentation using colombian white tapioca (Manihot esculenta Crantz) as support. The enzyme was purified by ammonium sulphate precipitation, anion exchange chromatography (DEAE-Sep-hadex A-50), gel filtration chromatography (Sephadex G-75) and cation exchange chromatography (CM-Sephadex C-50). A purification factor of 62 with a 9% yield and final specific activity of 314.82 U/mg were recorded. Purification to homogeneity was confirmed by SDS PAGE. The molecular weight was estimated to be 35 kDa. The enzyme shows maximal activity in the soluble starch hydrolysis at pH 6.0, and is stable in a range of pH from 5.0 to 7.0. Thermal stability was in the range of temperature from 0 to 50 °C, and its optimal temperature was 70 °C. Ions Ca2+,Ba2+and Ag+ significantly increase the activity of the enzyme, with ion Ca2+ as the highest activator. Cu2+ does not alter significantly the activity of the enzyme, whereas Li+ and Fe3+ decrease it slightly (13%) and Co2+ and Hg2+decrease it 25% and 40% respectively. Km = 0.48 mg/mL and Vmax = 5.85 /xmol glucose/min were calculated using the linearization of Lineweaver-Burk. Among hydrolysis products of tapioca starch are maltose and glucose, this result provides evidence of the enzyme ability to hydrolyze the starch α-1,4 glucosidic linkages, a characteristic behavior of an α-amylase.
Key words: α-amylase, Penicillium commune, solid state fermentation, colombian white tapioca.
RESUMO
Este estudo reporta a purificação e caracterização parcial de uma α-amilasa produzida por Penicillium communemediante fermentação em fase sólida usando mandioca branca colombiana (Manihot esculenta Crantz) como suporte. A enzima foi purificada por precipitação fraccionada com sulfato de amónio, cromato-grafia de intercambio aniónico (DEAE-Sephadex A-50), cromatografia de filtração por gel (Sephadex G-75) e croma-tografia de intercambio catiónico (CM-Sephadex C-50) obtendo una actividade específica final de 314.82 U/mg, um grau de purificação na ordem de 62 e um rendimento de 9%. A purificação até à homogeneidade foi confirmada por SDS-PAGE. O peso molecular estimado foi de 35 kDa. A enzima mostrou máxima acti-vidade de hidrólises de amido solúvel a pH 6.0, e estabilidade num intervalo de pH de 5.0-7.0. A enzima foi estável num intervalo de temperatura de 0-50 °C, e sua temperatura óptima de reacção foi de 70°C. Íons Ca2+,Ba2+ eAg+ aumentaram significativamente a actividade da enzima, sendo o ião Ca2+, o que teve o mais alto poder indutor. Cu2+ não alterou significativamente a actividade da enzima, enquanto que Li+ eFe3+ a diminuíram ligeiramente (13%), e Co2+ eHg2+ a diminuíram 25% e40% respectivamente. Os valores de Km eVmáx foram calculados usando a linearização de Lineweaver-Burk, obtendo Km = 0.48 mg/mL e Vmáx = 5.85 µmol glucosa/min. Entre os principais produtos de hidrólises do amido de mandioca encontram-se a maltosa e glucosa; este resultado proporciona evidencia de que a enzima é capaz de romper os enlaces glucosídicos α-1,4 do amido, comportamento característico de uma α-amilasa.
Palavras-chave: α-amilasa, Penicillium commune, fermentação em fase sólida, mandioca branca colombiana.
INTRODUCCION
Las α-amilasas son enzimas que catalizan al azar la hidrólisis de enlaces glicosídicos α-1,4 de polisacáridos como el almidón y el glicógeno, para producir maltosa, oligosacáridos de diferentes tamaños y cadenas más o menos ramificadas llamadas dextrinas límite (1). Son de gran importancia en la industria alimenticia, textil, papelera y farmacológica, y aunque las fuentes productoras de α-amilasas incluyen plantas, animales y microorganismos, son las enzimas microbianas las que encuentran mayor demanda en aplicaciones industriales (2). Tradicionalmente la producción de α-amilasas se ha llevado a cabo mediante procesos de fermentación líquida sumergida (FLS) debido al mayor control de factores ambientales como temperatura y pH, sin embargo, la fermentación en fase sólida (FFS) constituye una alternativa interesante puesto que los metabolitos se concentran, y los procesos de purificación son menos costosos (3, 4). Los medios empleados en FFS son semejantes en textura al habitat natural de hongos filamentosos como Penicillium commune lo que genera mayores rendimientos en la producción de enzimas y la mínima degradación por acción de proteasas (5).
Cada una de las aplicaciones industriales de las α-amilasas requiere propiedades únicas respecto a especificidad, estabilidad, temperatura y dependencia del pH (6), y la búsqueda de enzimas que presenten propiedades diferentes a las conocidas se mantiene como un tema de interés en investigación.
Recientemente se ha reportado la producción de α-amilasa por hongos del género Penicillium (7, 8), sin embargo, en estos trabajos no se lleva a cabo la purificación y posterior caracterización de la enzima, etapas fundamentales para establecer su potencial en aplicaciones bio-tecnológicas.
En esta publicación se describe la producción, purificación y caracterización cinética de una α-amilasa obtenida a partir de una cepa nativa de Penicillium commune mediante fermentación en fase sólida, empleando yuca blanca colombiana (Manihot esculenta crantz) como soporte.
MATERIALES Y MÉTODOS
Materiales y microorganismo
Una cepa de Penicillium sp. fue donada por el laboratorio de microbiología del departamento de farmacia de la Universidad Nacional de Colombia. El microorganismo se mantuvo a temperatura ambiente en medio Saboraud agar-maltosa 4%. El almidón de yuca empleado fue adquirido en Ciacomeq Ltda., Bogotá, Colombia. La yuca(Manihot esculenta Crantz)fuecomprada en un supermercado en Bogotá y fue rallada manualmente luego de retirar la cascara empleando un rallador de plástico doméstico convencional.
Identificación del microorganismo
La identificación se realizó mediante técnicas de biología molecular en el laboratorio de micología y fitopatología (LAMFU) de la Universidad de los Andes de Bogotá. El Penicillium sp. fue crecido en medio líquido SDY (sucrosa, dextrosa y extracto de levadura) (9). A partir de la biomasa generada se realizó una extracción de ADN total a través del método de extracción por fenol-cloroformo (10). Posteriormente, se amplificó por PCR la región ITS1- 5,8S-ITS2 de la subunidad ribosomal, con los cebadores universales ITS4 e ITS5 (11). La región amplificada fue secuenciada por la compañía Macrogen (Seúl, Corea). La identificación molecular se realizó comparando la secuencia obtenida contra todas las secuencias nucleotídicas de hongos reportadas en la base de datos del NCBI (National Center for Biotechnology Information: http://www.ncbi.nlm.nih.gov), los análisis bioinformáticos se hicieron utilizando el algoritmo Blastn. Los alineamientos con mayor puntaje y máxima identidad obtenidos (E value= 0; identidad 100%) permiten identificar el microorganismo como perteneciente a la especie P. commune.
Obtención del inoculo
El micelio de P. commune fue suspendido en agua estéril, con agitación constante durante 10 min. se filtró sobre gasa estéril en condiciones asépticas para retirar el micelio sobrenadante, y se realizó el conteo de esporas con un hemacitómetro. Una suspensión de 1x107 esporas/mL se utilizó para inocular los medios de fermentación.
Medio de fermentación y producción enzimática
Los medios de fermentación se prepararon tomando como referencia el medio Czapcek-Dox (9), y se suplementaron con CaCl2. Se formularon dos medios, según la fuente de carbono, almidón de yuca o yuca rallada, y se realizaron dos tipos de fermentaciones, FFS y FLS, en condiciones estáticas.
Para las FFS el medio se preparó con 10 g de almidón ó 10 g de yuca rallada, humedecidos con 10 mL de solución de sales. El medio para la FLS contenía 3,0 g de almidón de yuca ó 3,0 g de yuca rallada, suspendidos en 100 mL de solución de sales diluída 1:10. La solución de sales contenía (g/100 mL de agua destilada): (NH4)2SO4, 3,00; MgSO4, 0,50; KCl, 0,50; FeSO4, 0,01; K2HPO4, 1,00; CaCl2, 0,15.
Los medios se esterilizaron a 121 °C y 15 psi por 15 min, se inocularon con 1 mL de suspensión de esporas de P. commune y se incubaron a 22 °C. Se hizo seguimiento cada 24 horas de la producción de la enzima. Para la FLS se separó el hongo mediante centrifugación por 30 min a 8 000 rpm, en una centrífuga MLW modelo T52; el sobrenadante constituyó el extracto crudo. En el caso de la FFS se adicionaron 50 mL de buffer fosfato 0,1 M pH 7,0, se agitó mecánicamente durante 30 min en un agitador de placa MLW modelo Thys 2 a 80 oscilaciones completas por minuto, se filtró la solución sobre algodón y se centrifugó por 30 min a 8 000 rpm, el sobrenadante constituyó el extracto crudo. Se tomaron 10mL de cada extracto crudo y se dializaron contra agua destilada para realizar medidas de concentración de proteína y actividad enzimática.
El trabajo se continuó empleando la FFS con yuca rallada, por ser el medio en el cual se obtuvo la mayor producción de enzima.
Producción de la enzima por fermentación en fase sólida
Se emplearon bandejas de aluminio (22,50 cm X 16,50 cm X 2,50 cm), en cada una se puso una capa de 1 cm de espesor aproximadamente de la mezcla de 100 g de yuca rallada y 100 mL de solución de sales. Las bandejas con el medio se esterilizarona121 °Cy15psi durante 15 min y se inocularon con 3 mL de la suspensión de esporas. La incubación se realizó a 22 °C durante siete días. Para obtener el extracto crudo se añadieron 150 mL de buffer fosfato 0,1 M pH 7,0, se agitó mecánicamente durante una hora a temperatura ambiente en un agitador de placa MLW modelo Thys 2 a 80 oscilaciones completas por minuto, y se filtró la solución sobre algodón para retirar los sólidos gruesos. Al residuo se le realizó una segunda extracción bajo las mismas condiciones y se juntaron los dos extractos. El filtrado total se centrifugó a 8 000 rpm por 30 min, en una centrifuga MLW modelo T52, el precipitado se descartó y se obtuvo un sobrenadante con un volumen de 2085 mL. De este sobrenadante se tomaron 100 mL para realizar ensayos preliminares de precipitación fraccionada con sulfato de amonio.
Determinación de actividad enzimática y cuantificación de proteínas
Para medir la actividad α-amilasa se utilizó el método de Nelson-Somogyi (12). La mezcla de reacción contiene 1 mL de solución de almidón soluble al 1% (p/v), 200 ,µL de una dilución apropiada de la muestra que contiene la enzima, y 800 ,µL de CaCl2 5mM. Luego de 20 min de reacción a 37 °C, se adicionan 500 ,µL del reactivo de Somogyi y se lleva la mezcla a un baño María a temperatura de ebullición. Pasados 10 min, se retira la mezcla del baño y se adicionan 500 ,µL del reactivo de Nelson, se completa el volumen a 10 mL con agua destilada y se realiza la determinación colorimétrica a 500 nm (espectrofotómetro Genesys 5).
Una unidad de actividad enzimática se define como la cantidad de enzima que libera 1 ,µg de glucosa por minuto bajo las condiciones del ensayo, 37 °C, pH 6,0. La actividad específica se define como las unidades de actividad por miligramo de proteína.
La concentración de proteínas fue determinada por el método colorimétrico de Bradford (13), empleando albúmina sérica bovina como proteína patrón.
Purificación de la enzima
Precipitación con sulfato de amonio
El extracto crudo fue sometido a precipitación fraccionada con sulfato de amonio. La fracción con la proteína de interés precipitó entre 50 y 80% de saturación. Este precipitado se disolvió en el mínimo volumen de agua destilada, se dializó 24 h contra agua destilada y se liofilizó.
Cromatografía de intercambio aniónico
El liofilizado de la etapa anterior se disolvió en el mínimo volumen de buffer fosfato 50 mM, pH 6,0, y se aplicó a una columna de DEAE Sephadex A-50 (2,5 x 30,0 cm) equilibrada con el mismo buffer. La elusión se realizó por medio de un gradiente discontinuo de fuerza iónica (NaCl 0,1 a 0,5 M). La velocidad de flujo fue de 30 mL/h. A cada fracción (5 ml) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que contenían la proteína de interés, se mezclaron en un pool (pool DEAE-pico II), que se dializó contra agua destilada y se liofilizó.
Cromatografía de filtración por gel
El pool DEAE-pico II se disolvió en NaCl al 1% y fue sometido a cromatografía de filtración por gel sobre Sepha-dex G-75 (2,5 X 30,0 cm). La elusión de las proteínas se realizó con NaCl al 1%. La velocidad de flujo fue de 27 mL/h. A cada fracción (4,5 mL) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que mostraron mayor actividad enzimática, se mezclaron en un pool (pool G-75-pico II) que se dializó contra agua destilada y se concentró por liofilización.
Cromatografía de intercambio catiónico
El pool G-75-pico II se disolvió en buffer fosfato0,05M,pH7,0yfue sometidoa cromatografía de intercambio catiónico sobre CM Sephadex C-50 (2,5 x 30,0 cm). La elusión se realizó por medio de un gradiente discontinuo de fuerza iónica (NaCl 0,1 a 0,5 M). La velocidad de flujo fue de 27 mL/h. A cada fracción (4,5 mL) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que contenían la proteína de interés, se mezclaron en un pool (pool CM-pico I) que se dializó contra agua destilada y se liofilizó.
Caracterización de la enzima
Determinación del peso molecular por electroforesis en condiciones desnaturalizantes
Se corrieron electroforesis SDS-PAGE (14), con geles de poliacrilamida al 12%, los cuales se tiñeron con azul de Coomassie. Los marcadores de peso molecular empleados fueron de la marca Bio-Rad, con las siguientes proteínas como estándares: fosforilasa B (104 kDa), albúmina de suero bovino (83 kDa), ovoalbúmina (49 kDa), anhidrasa carbónica (37 kDa), inhibidor de la tripsina de soya (29 kDa) y lisozima (20 kDa).
Efecto del pH sobre la actividad y la estabilidad de la enzima
El pH óptimo de la enzima fue determinado realizando medidas de actividad en un rango de pH entre 2,0 y 12,0 a 37 °C. Para establecer el efecto del pH sobre la estabilidad, la enzima fue incubada a 37 °C por 1 h en diferentes buffers en un rango de pH entre 2,0 y 12,0 y la actividad residual fue determinada bajo las condiciones normales del ensayo. Se usaron buffers glicina-HCl, acetato-acético, fosfato y glicina-NaOH, todos con concentración 100 mM.
Efecto de la temperatura sobre la actividad y la estabilidad de la enzima
La temperatura óptima de la enzima fue determinada en un rango de temperatura entre 0 y 92 °C en buffer fosfato 100 mM, pH 6,0. El efecto de la temperatura sobre la estabilidad fue establecido incubando por 1 h la enzima en buffer fosfato 100 mM, pH 6,0 en un rango de temperatura entre 40 y 92 °C. La actividad residual fue determinada bajo las condiciones normales del ensayo.
Efecto de la concentración de sustrato
Se utilizaron siete concentraciones diferentes de almidón soluble (0,2-1,4 mg/mL). Las mediciones de actividad se realizaron bajo las condiciones normales del ensayo. La mezcla de reacción contenía 100 ,µL de enzima purificada; 100 ,µL de CaCl2 5 mM; 800,µL de buffer fosfato 100 mM, pH 6,0, y 1 mL de solución de almidón. La estimación de Km y Vmáx se realizó a partir de la linealización de Li-neweaver-Burk.
Efecto de algunos iones metálicos, EDTA y SDS sobre la actividad enzimática
Se utilizaron las siguientes sales: CuSO4.5H2O, CaCl2.2H2O, LiCl, FeCl3.6H2O, AgNO3, HgCl2, BaCl2 y CoCl2. La concentración final de sal en la mezcla de reacción para todos los casos fue 1,0 mM. La enzima, previamente dializada contra agua destilada, se incubó con la solución de la sal durante 30 min a 37 °C, luego se determinó la actividad residual bajo las condiciones normales del ensayo. La actividad sin adición de los iones metálicos fue definida como de 100%. Para medir los efectos de EDTA y SDS, la enzima fue incubada con el componente respectivo por 30 min a 37 °C, luego se realizó la medición de actividad enzimática residual bajo las condiciones normales del ensayo. La concentración final en la mezcla de reacción para ambos compuestos fue 10 mM. La actividad en ausencia de EDTA y SDS fue considerada como de 100%.
Capacidad para hidrolizar el almidón de yuca y productos de hidrólisis
Los productos finales de hidrólisis luego de 10, 20, 30 y 60 min de incubación fueron evaluados según Hmidet et al. (15), mediante comparación con patrones de glucosa y maltosa en una cromatografía de capa delgada (silica gel 60 F254 Merck), la fase móvil fue cloroformo/acético/agua (70:60:10, v/v/v) y el revelado se hizo con H2SO4/metanol (5:95, v/v). Los productos de hidrólisis fueron observados como manchas oscuras luego de adicionar el revelador y calentar a 120 °C por 3 min.
RESULTADOS Y DISCUSIÓN
Producción de la enzima
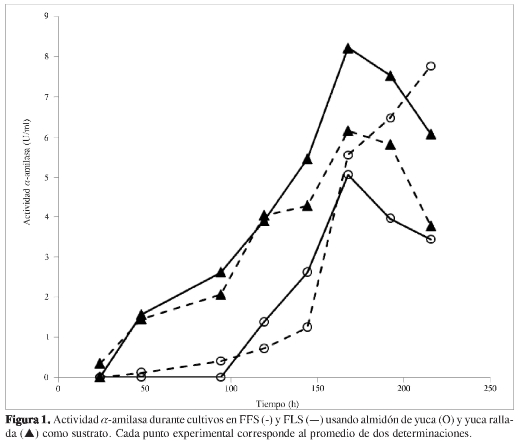
La cinética de producción de α-amilasa en los diferentes medios de cultivo se presenta en la Figura 1.
En los medios con yuca rallada hay un incremento de la actividad α-amilasa a partir de 48 horas, con un máximo a las 168 horas (siete días), en las que la actividad enzimática fue de 8,21 U/mL para la FFS y 6,15 U/mL para la FLS. En cuanto a los medios con almidón de yuca, la actividad enzimática comienza a aumentar a partir de las 120 horas (5 días) sin alcanzar los valores observados con yuca rallada, no obstante, a partir de las 168 horas (7 días) se aprecia un incremento en la actividad enzimática en la fermentación líquida sumergida que presenta un valor máximo de 7,76 U/mL a los 10 días de observación.
El crecimiento de P. commune, un hongo filamentoso, se favoreció en el medio sólido empleando yuca rallada; este medio ofrecía una mayor área superficial y presentaba una textura más rugosa, semejante a las condiciones de los hábitats usuales de este microorganismo.
Los resultados obtenidos sugieren que la yuca rallada constituye un mejor soporte para la producción de α-amilasa por P. commune y que en caso de usar almidón de yuca en fermentación en fase sólida, la producción de la misma cantidad de α-amilasa tomaría más tiempo.
Purificación de la enzima
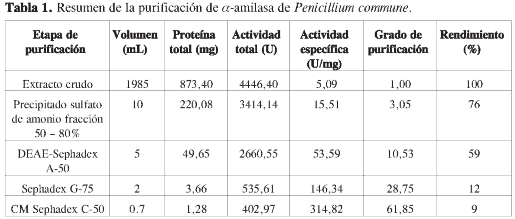
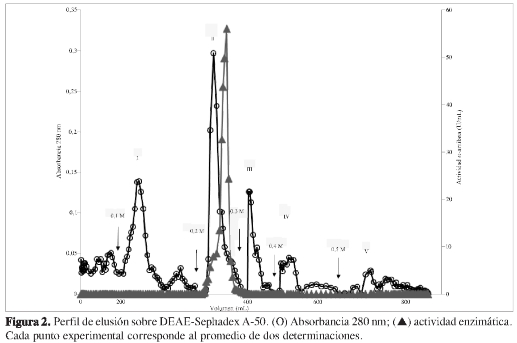
La purificación de α-amilasa de P. commune se resume en la Tabla 1. El extracto crudo fue precipitado por adición de sulfato de amonio, la mayor actividad α-amilasa se encontró en la fracción 50-80%, esta fracción fue aplicada a una columna de DEAE Sephadex A-50, cuyo perfil de elusión (Figura 2) mostró un único pico con actividad α-amilasa luego de la adición de buffer fosfato 50 mM, pH 6,0 NaCl 0,2 M. Las fracciones del pico con actividad fueron reunidas en el pool DEAE-pico II, el cual fue dializado contra agua destilada y liofilizado, alcanzando un grado de purificación de 10,53.
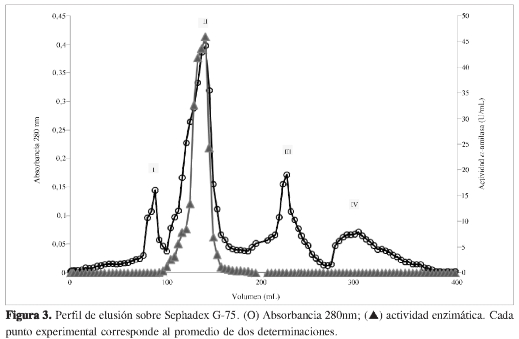
Este pool fue aplicado a una columna de Sephadex G-75, la elusión se realizó con NaCl al 1%. El perfil cromatográfico (Figura 3) mostró un único pico de actividad α-amilasa, las fracciones del pico activo fueron reunidas en el pool G-75 pico II, el cual fue dializado contra agua destilada y liofilizado, con este paso se alcanzó un grado de purificación de 28,75.
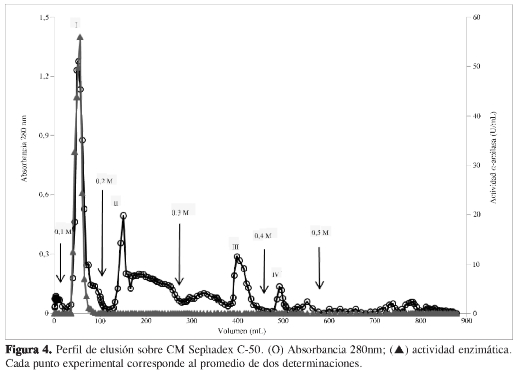
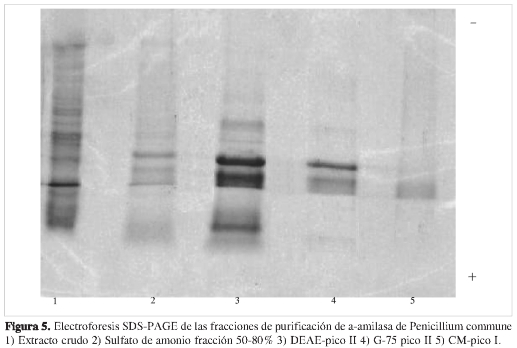
El pool G-75 pico II se disolvió en buffer fosfato 50 mM, pH 7,0, y fue aplicado a una columna de CM Sephadex C-50. El perfil de elusión (Figura 4) mostró un único pico con actividad α-amilasa luego de la adición de buffer fosfato 50 mM, pH 7,0 NaCl 0,1 M. Las fracciones con actividad fueron reunidas en el pool CM- pico I, el cual fue dializado contra agua destilada, liofilizado y disuelto en buffer fosfato 50 mM, pH 7,0, alcanzando un grado de purificación final de 61,85. Este pool mostró una sola banda en la electroforesis SDS-PAGE (Figura 5), indicando la purificación hasta la homogeneidad de la enzima.
Peso molecular
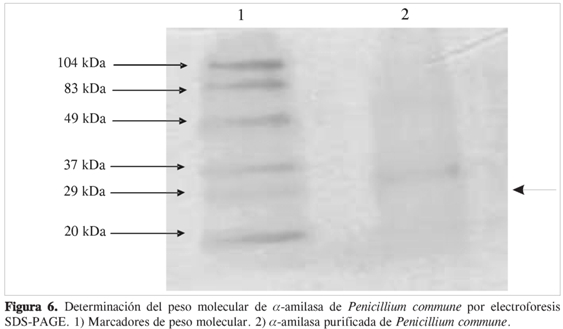
La comparación de la movilidad electroforética de la α-amilasa de P. commune con la de los marcadores de peso molecular en una electroforesis SDS-PAGE (Figura 6) permite establecer un peso molecular de 35 kDa. El rango de peso molecular para las α-amilasas oscila entre 10 y 210 kDa (2), sin embargo, la mayoría de las α-amilasas microbianas tienen su peso molecular entre 30 - 70 kDa, rango en el que se encuentra la α-amilasa de P. commune.
Efecto del pH sobre la actividad y la estabilidad de la enzima
Cuando la actividad de la enzima fue ensayada con diferentes valores de pH, la máxima actividad se obtuvo con pH 6,0.
En otros estudios, el pH óptimo de la α-amilasa de Penicillium chrysogenum fue de 5,0 (7) y el de la α-amilasa dePenicilium griseofulvum de 5,5 (8). Aunque el pH óptimo para las α-amilasas varía entre 2,0 y 12,0 (2), la mayoría de las α-amilasas microbianas tienen su pH óptimo en el rango ligeramente ácido a neutro, rango en el que se encuentra el pH óptimo de la α-amilasa de Penicillium commune.
Luego de la incubación de la enzima por 1 h en buffer de diferente pH, se observa que la enzima fue estable en el rango de pH 5,0-7,0. La enzima retuvo 95% de su actividad con un pH 5,0 y 98,8% con un pH 7,0. Rangos de estabilidad en el pH similares han sido reportados para las α-amilasas de Aspergillus awamori (16) y Thricoderma viride (17).
Efecto de la temperatura sobre la actividad y la estabilidad de la enzima
La temperatura a la cual se alcanza la máxima actividad y, por tanto, corresponde a la temperatura óptima de reacción, es 70 °C. Cuando se sobrepasa este valor, la actividad disminuye rápidamente porque la enzima se va desnaturalizando.
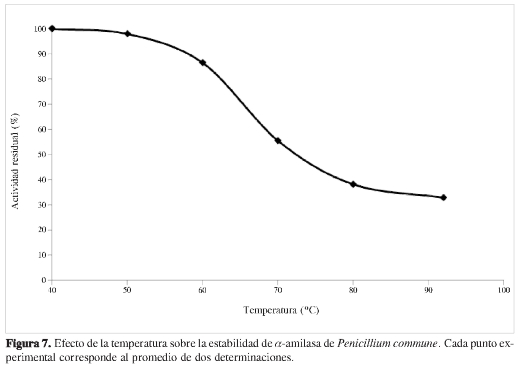
Como se puede observar en la Figura 7, cuando la enzima fue incubada durante una hora en buffer fosfato 100 mM, pH 6,0 en un rango de temperatura entre 40 y 92 °C, la actividad decreció rápidamente a partir de 50 °C, indicando que el rango de estabilidad térmica de la enzima es 0-50 °C. Vale la pena destacar que la enzima conserva 35% de su actividad después de ser calentada una hora a 92 °C. Una consecuencia de orden práctico derivada de este hallazgo, es la necesidad de revisar cuál es el tiempo requerido para la inactivación total de la enzima en las medidas de actividad por el método de Nelson-Somogyi.
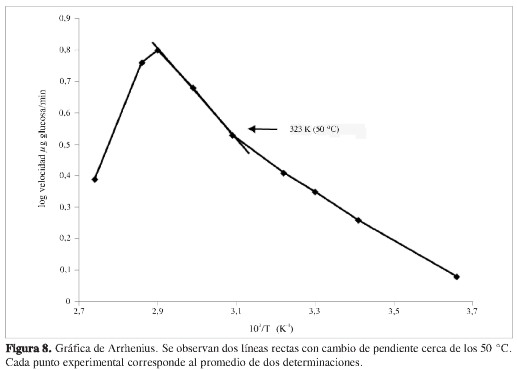
Con los datos obtenidos en la determinación de la temperatura óptima se construyó una gráfica de Arrhenius (Figura 8) para así poder analizar la inactivación térmica de la enzima. El cambio de pendiente cerca a los 50 °C que se observa en la gráfica, sugiere que la incubación por periodos prolongados de tiempo a esta temperatura induce un cambio conformacional de la enzima. Un caso de comportamiento similar fue reportado por Uchino, para una α-amilasa de Bacillus sp. (18).
Parámetros cinéticos Km y Vmáx
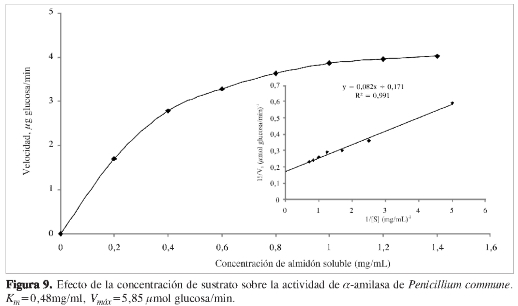
Los valores de Km y Vmáx determinados usando la linelización de Lineweaver-Burk (Figura 9) fueron 0,48 mg/mL y 5,85 jiímol glucosa/min, respectivamente. La α-amilasa de Penicillium commune presenta una cinética típica de Michaelis-Menten y posee una alta afinidad por el almidón soluble respecto a otras α-amilasas microbianas comoThermofibida fusca (0,88 mg/mL), Aureobasidiumpullulans (5,75 mg/mL) y Bacillus sp. (1,64 mg/mL) (18, 19, 20), sin embargo, es muy similar a la del hongo filamentoso Aspergillus fumigatus (0,42 mg/mL) (21).
Efecto de algunos iones metálicos, del EDTA y del SDS sobre la actividad enzimática
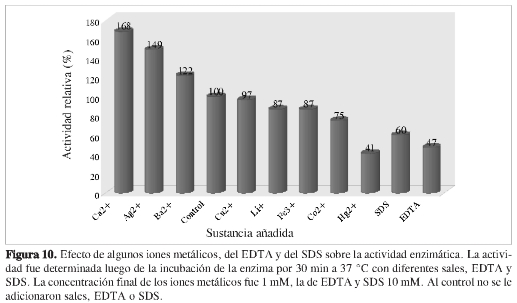
El efecto de algunos iones metálicos, del EDTA y del SDS sobre la actividad enzimática de la α-amilasa dePenicillium commune se muestra en la Figura 10. Las α-amilasas son proteínas pequeñas que contienen por lo menos un ión Ca2+ por molécula. La cantidad de iones Ca2+ puede variar de uno a diez dependiendo del origen de la enzima. De acuerdo con Gupta, et al. (2), para lograr una completa remoción de los iones Ca2+ no basta con dializar contra agua destilada, se hace necesario tratar la enzima con EDTA o EGTA. Además, según Nielsen, et al. (22), de los tres iones calcio (CaI, CaII, CaIII) que la α-amilasa de Bacillus halmapalus contiene, es posible remover CaIII sin observar cambios estructurales significativos, pero no CaI o CaII. Lo anterior justifica que luego de la diálisis contra agua destilada no se genere pérdida total de la actividad enzimática y, por lo tanto, se pueda evaluar el efecto de los iones escogidos, del EDTA y del SDS.
Como se puede notar, Ca2+,Ba2+ y Ag+ aumentan significativamente la actividad de la enzima, siendo el ión Ca2+el que tiene el más alto poder activador. El efecto activador del calcio puede estar relacionado con interacciones adicionales favorables que contribuyen a la neutralización de las cargas negativas en la de los dominios estructurales A y B de la enzima (22). Cu2+ no altera significativamente la actividad de la enzima, mientras que Li+ y Fe3+ la disminuyen ligeramente y Co2+ y Hg2+ la disminuyen considerablemente.
La inhibición por iones mercurio sugiere, tal como lo indican Li, et al. (20), que residuos aminoacídicos con grupos sulfihidrilo o imidazol son importantes en la función de la enzima. Esta afirmación concuerda con el hecho de que varios residuos de histidina (His210, His122, numeración para Taka amilasa) están implicados en el mecanismo catalítico de las α-amilasas. El agente quelante EDTA y el surfactante SDS también mostraron acción inhibitoria sobre la actividad de la enzima. La inhibición que ocasiona el EDTA apoya la sugerencia de que la α-amilasa de P. commune contiene calcio, y que su actividad es dependiente de este ión. En cuanto al SDS, se corrobora su efecto sobre la estructura terciaria de la enzima, sin que se presente completa desnaturalización con la concentración ensayada.
Capacidad para hidrolizar el almidón de yuca y productos de hidrólisis
El análisis cromatográfico de los productos de hidrólisis del almidón de yuca por α-amilasa de Penicillium communese muestra en la Figura 11. Entre los principales productos de hidrólisis se encuentran maltosa y glucosa. La producción de trazas de glucosa fue determinada desde los 10 min de reacción, así como la formación de pequeñas cantidades de maltosa y dextrinas, cuya cantidad fue aumentando a medida que aumentaba el tiempo de reacción. Este resultado proporciona evidencia de que la enzima presenta el comportamiento característico de una α-amilasa, ya que es capaz de romper los enlaces glicosídicos α-1,4 del almidón de yuca, lo cual es de interés por su potencial en la producción de biocombustibles.
Resultados similares en la hidrólisis de almidón han sido reportados para las α-amilasas de Penicillium griseofulvumy Penicülium chrysogenum (7, 8).
CONCLUSIONES
Tanto el almidón de yuca como la yuca blanca colombiana (Manihot esculenta crantz) empleados como soporte, permiten el crecimiento de Penicillium commune. En las condiciones usadas en esta investigación, el microorganismo sólo produce una α-amilasa. La comparación de las cinéticas de producción de la enzima en cultivos en FFS y FLS estático, permite establecer que la fermentación en fase sólida con yuca blanca rallada arroja los mejores resultados en cuanto a actividad α-amilasa.
La enzima presenta un pH óptimo de 6,0 y fue estable en un rango de pH entre 5,0 y 7,0 a 37 °C, además tiene una temperatura óptima de 70 °C y presenta máxima estabilidad en el rango 0-50 °C. Con temperaturas superiores probablemente la enzima adquiere un estado conformacional que le permite conservar 35% de su actividad después de ser calentada a 92 °C durante una hora.
La gráfica de Arrhenius presenta un cambio de pendiente cerca a los 50 °C, sugiriendo que la incubación por periodos prolongados de tiempo a esta temperatura induce un cambio conformacional de la enzima.
Dado que Ca2+ tiene el más alto poder activador y el EDTA causa una fuerte inhibición, se confirma que la α-amilasa de Penicillium commune contiene calcio, y que su actividad es dependiente de este ión.
La α-amilasa de Penicillium commune es activa sobre almidón de yuca usado como sustrato, lo cual se evidencia en la producción de maltosa y glucosa en la cromatografía de capa delgada sobre silica gel.
AGRADECIMIENTOS
A la profesora Pilar Meléndez del departamento de farmacia de la Universidad Nacional de Colombia por el suministro de la cepa de Penicillium sp. y al Sr. Gregorio Medina del laboratorio de microbiología del Instituto de Ciencia y Tecnología de Alimentos (ICTA) de la Universidad Nacional de Colombia por el servicio de liofilización.
A las profesoras Luisa Castiblanco y Silvia Restrepo, del laboratorio de micologia y fitopatología (LAMFU) de la Universidad de los Andes de Bogotá, por su valiosa colaboración en la identificación del Penicillium commune.
REFERENCIAS BIBLIOGRÁFICAS
1. Maheshwari, R.; Bharadwaj, G.; Bhat, M. Thermophilic fungi: their physiology and enzymes. Microbiology and Molecular Biology Reviews. 2000. 64: 461-488.
2. Gupta, R.; Gigras, H.; Mohapatra, H.; Goswami, V.; Chauhan, B. Microbial a-amylases: a biotechnological perspective. Process Biochemistry. 2003. 38: 1599-1616.
3. Pandey, A.; Soccol, C.R. New developments in solid state fermentation: I-bioprocesses and products. Process Biochemistry. 2000. 35: 1153-1169.
4. Soni, S. K.; Arshdeep, K.; Gupta, J. K. A solid state fermentation based bacterial a-amylase and fungal glucoamylase system and its suitability for the hydrolysis of wheat starch. Process Biochemistry. 2003. 39: 185-192.
5. Hõlker, U.; Lenz, J. Solid- state fermentation - Are there any biotechno-logical advantages? Current Opinion in Microbiology. 2005. 8: 301-306.
6. McTigue,M. A.; Kelly, C.T.; Doyle, E. M.; Fogarty, W. M. The alkaline amylase of the alkalophilic Bacillus sp.IMD 370. Enzyme and Microbial Technology. 1995. 17: 570-573.
7. Balkan, B. y Ertan, F. Production and properties of a-amylase from Penicillium chrysogenum and its application in starchhydrolysis. Preparative Biochemistry and Biotechnology. 2005. 35: 169-178.
8. Ertan, F.; Yagar, H.; Balkan, B. Some properties of free and inmobilized a-amylase from Penicillium griseofulvumby solid state fermentation. Preparative Biochemistry and Biotechnology. 2006. 36: 81-91.
9. Merck. Manual de medios de cultivo. 1990. p. 77.
10. Sambrook, J.; E. F. Fritsch, and T. Maniatis. 1989. Molecular cloning: a laboratory manual, 2nd ed., vol. I. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.
11. White, T. J.; T. Bruns, S. Lee, and J. Taylor. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics, p. 315-322. In N. Innis, D. Gelfand, J. Sninsky, and T. White (ed.), PCR protocols: a guide to methods and applications. Academic Press, Inc., New York.
12. Nelson, N. A photometric adaptation of the Somogyi method for the determination of glucose. J. Biol. Chem.1944. 153: 375-380.
13. Bradford, M. M. A rapid and sensitive method for the quantization of micrograms quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976. 72: 248-254.
14. Laemmli, U. K. Cleavage of the structure proteins during the assembly of the head of bacteriophage T4.Nature. 1970. 227: 680-685.
15. Hmidet, N.; Bayoudh, A.; Berrin, J. G.; Kanoun, S.; Juge, N.; Nasri, M. Purification and biochemical characterization of a novel a-amylase from Bacillus licheniformis NH1 cloning, nucleotide sequence and expression of amyN gene in Escherichia coli. Process Biochemistry. 2008. 43 (5): 499-510.
16. Bhella, R.S.; Altosaar, I. Purification and some properties of the extracellular a-amylase from Aspergillus awamori. Can J Microbiol. 1985.31: 149-153.
17. Schellart, J. A.; Visser, M. W.; Zandstva, T.; Middlehover, W. J. Starch degradation by the mold Trichoderma viride I. The mechanism of degradation. Antonie Van Leeuwenhock J Microbiol Serol. 1976. 42: 229-238.
18. Uchino, F. A thermophilic and unusually acidophilic amylase produced by a thermophilic acidophilic Bacillus sp.Agrie Biol. Chem.1982. 46 (1): 7-13.
19. Yang, C. H.; Liu, W. H. Purification and properties of a maltotriose-producing a-amylase from Thermobifida fusca. Journal of Industrial Microbiology and Biotechnology. 2004. 35 (2-3): 254-260.
20. Li, H.; Chi, Z.; Wang, X. D.; Ma, L.; Gao, L. Purification and characterization of extracellular amylase from the marine yeast Aureobasidium pullulans N13d and its raw potato starch digestion. Enzyme and Microbial Technology. 2007 . 40: 1006-1012.
21. Planchot, V.; Colonna, P. Purification and characterization of extracellular alpha-amylase from Aspergillus fumigatus. Carbohydrate Research. 1995. 272 (1): 97-109.
22. Nielsen, A. D.; Pusey, M. L.; Fuglsang, C. C.; Westha, P. A proposed mechanism for the thermal denaturation of a recombinant Bacillus halmapalus a-amylase-the effect ofcalcium ions. Biochimica et Biophysica Acta. 2003.1652: 52-63.
PURIFICACIÓN Y CARACTERIZACIÓN DE α-AMILASA DE PENICILLIUM COMMUNE PRODUCIDA MEDIANTE FERMENTACIÓN EN FASE SÓLIDA
PURIFICATION AND CHARACTERIZATION OF α-AMYLASE FROM PENICILLIUM COMMUNE PRODUCED BY SOLID STATE FERMENTATION
PURIFICAÇÃO E CARACTERIZAÇÃO DA α-AMILASA DEPENICILLIUM COMMUNE PRODUZIDA MEDIANTE FERMENTAÇÃO EM FASE SÓLIDA
Esperanza Espinel1,2, Elizabeth López1,3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia.
2 Dirección actual Colegio Marruecos y Molinos IED, SED. Bogotá, Colombia. neespinelb@unal.edu.co
Recibido: 17/12/08 - Aceptado: 21/08/09
RESUMEN
Este estudio reporta la purificación y caracterización parcial de una α-amilasa producida por Penicillium communemediante fermentación en fase sólida, empleando yuca blanca colombiana (Manihot esculenta Crantz) como soporte. La enzima fue purificada por precipitación fraccionada con sulfato de amonio, cromatografía de intercambio aniónico (DEAE-Sephadex A-50), cromatografía de filtración por gel (Sephadex G-75) y cromatografía de intercambio catiónico (CM-Sephadex C-50) obteniendo una actividad específica final de 314,82 U/mg, un grado de purificación del orden de 62 y un rendimiento de 9%. La purificación hasta la homogeneidad fue confirmada por SDS-PAGE. El peso molecular estimado fue 35 kDa. La enzima mostró máxima actividad de hidrólisis de almidón soluble con pH 6,0, y estabilidad en un intervalo de pH de 5,0-7,0. La estabilidad térmica de la enzima se presentó en el intervalo de temperatura 0-50 °C y su temperatura óptima fue 70 °C. Los iones Ca2+,Ba2+ y Ag+aumentaron significativamente la actividad de la enzima, siendo el ión Ca2+ el que tuvo el más alto poder activador. Cu2+ no alteró significativamente la actividad de la enzima, mientras que Li+ yFe3+ la disminuyeron ligeramente (13%), y Co2+ y Hg2+ la disminuyeron 25% y 40% respectivamente. Los valores de Km y Vmáxfueron calculados usando la linealización de Lineweaver-Burk, con el resultado Km = 0,48 mg/mL y Vmáx = 5,85 µmol glucosa/min. Entre los principales productos de hidrólisis del almidón de yuca se encuentran la maltosa y la glucosa, este resultado proporciona evidencia de que la enzima es capaz de romper los enlaces glicosídicos α-1,4 del almidón, comportamiento característico de una α-amilasa.
Palabras clave: α-amilasa, Penicillium commune, fermentación en fase sólida, yuca blanca colombiana.
ABSTRACT
This study reports the purification and partial characterization of an α-amylase from Penicillium communeproduced by solid state fermentation using colombian white tapioca (Manihot esculenta Crantz) as support. The enzyme was purified by ammonium sulphate precipitation, anion exchange chromatography (DEAE-Sep-hadex A-50), gel filtration chromatography (Sephadex G-75) and cation exchange chromatography (CM-Sephadex C-50). A purification factor of 62 with a 9% yield and final specific activity of 314.82 U/mg were recorded. Purification to homogeneity was confirmed by SDS PAGE. The molecular weight was estimated to be 35 kDa. The enzyme shows maximal activity in the soluble starch hydrolysis at pH 6.0, and is stable in a range of pH from 5.0 to 7.0. Thermal stability was in the range of temperature from 0 to 50 °C, and its optimal temperature was 70 °C. Ions Ca2+,Ba2+and Ag+ significantly increase the activity of the enzyme, with ion Ca2+ as the highest activator. Cu2+ does not alter significantly the activity of the enzyme, whereas Li+ and Fe3+ decrease it slightly (13%) and Co2+ and Hg2+decrease it 25% and 40% respectively. Km = 0.48 mg/mL and Vmax = 5.85 /xmol glucose/min were calculated using the linearization of Lineweaver-Burk. Among hydrolysis products of tapioca starch are maltose and glucose, this result provides evidence of the enzyme ability to hydrolyze the starch α-1,4 glucosidic linkages, a characteristic behavior of an α-amylase.
Key words: α-amylase, Penicillium commune, solid state fermentation, colombian white tapioca.
RESUMO
Este estudo reporta a purificação e caracterização parcial de uma α-amilasa produzida por Penicillium communemediante fermentação em fase sólida usando mandioca branca colombiana (Manihot esculenta Crantz) como suporte. A enzima foi purificada por precipitação fraccionada com sulfato de amónio, cromato-grafia de intercambio aniónico (DEAE-Sephadex A-50), cromatografia de filtração por gel (Sephadex G-75) e croma-tografia de intercambio catiónico (CM-Sephadex C-50) obtendo una actividade específica final de 314.82 U/mg, um grau de purificação na ordem de 62 e um rendimento de 9%. A purificação até à homogeneidade foi confirmada por SDS-PAGE. O peso molecular estimado foi de 35 kDa. A enzima mostrou máxima acti-vidade de hidrólises de amido solúvel a pH 6.0, e estabilidade num intervalo de pH de 5.0-7.0. A enzima foi estável num intervalo de temperatura de 0-50 °C, e sua temperatura óptima de reacção foi de 70°C. Íons Ca2+,Ba2+ eAg+ aumentaram significativamente a actividade da enzima, sendo o ião Ca2+, o que teve o mais alto poder indutor. Cu2+ não alterou significativamente a actividade da enzima, enquanto que Li+ eFe3+ a diminuíram ligeiramente (13%), e Co2+ eHg2+ a diminuíram 25% e40% respectivamente. Os valores de Km eVmáx foram calculados usando a linearização de Lineweaver-Burk, obtendo Km = 0.48 mg/mL e Vmáx = 5.85 µmol glucosa/min. Entre os principais produtos de hidrólises do amido de mandioca encontram-se a maltosa e glucosa; este resultado proporciona evidencia de que a enzima é capaz de romper os enlaces glucosídicos α-1,4 do amido, comportamento característico de uma α-amilasa.
Palavras-chave: α-amilasa, Penicillium commune, fermentação em fase sólida, mandioca branca colombiana.
INTRODUCCION
Las α-amilasas son enzimas que catalizan al azar la hidrólisis de enlaces glicosídicos α-1,4 de polisacáridos como el almidón y el glicógeno, para producir maltosa, oligosacáridos de diferentes tamaños y cadenas más o menos ramificadas llamadas dextrinas límite (1). Son de gran importancia en la industria alimenticia, textil, papelera y farmacológica, y aunque las fuentes productoras de α-amilasas incluyen plantas, animales y microorganismos, son las enzimas microbianas las que encuentran mayor demanda en aplicaciones industriales (2). Tradicionalmente la producción de α-amilasas se ha llevado a cabo mediante procesos de fermentación líquida sumergida (FLS) debido al mayor control de factores ambientales como temperatura y pH, sin embargo, la fermentación en fase sólida (FFS) constituye una alternativa interesante puesto que los metabolitos se concentran, y los procesos de purificación son menos costosos (3, 4). Los medios empleados en FFS son semejantes en textura al habitat natural de hongos filamentosos como Penicillium commune lo que genera mayores rendimientos en la producción de enzimas y la mínima degradación por acción de proteasas (5).
Cada una de las aplicaciones industriales de las α-amilasas requiere propiedades únicas respecto a especificidad, estabilidad, temperatura y dependencia del pH (6), y la búsqueda de enzimas que presenten propiedades diferentes a las conocidas se mantiene como un tema de interés en investigación.
Recientemente se ha reportado la producción de α-amilasa por hongos del género Penicillium (7, 8), sin embargo, en estos trabajos no se lleva a cabo la purificación y posterior caracterización de la enzima, etapas fundamentales para establecer su potencial en aplicaciones bio-tecnológicas.
En esta publicación se describe la producción, purificación y caracterización cinética de una α-amilasa obtenida a partir de una cepa nativa de Penicillium commune mediante fermentación en fase sólida, empleando yuca blanca colombiana (Manihot esculenta crantz) como soporte.
MATERIALES Y MÉTODOS
Materiales y microorganismo
Una cepa de Penicillium sp. fue donada por el laboratorio de microbiología del departamento de farmacia de la Universidad Nacional de Colombia. El microorganismo se mantuvo a temperatura ambiente en medio Saboraud agar-maltosa 4%. El almidón de yuca empleado fue adquirido en Ciacomeq Ltda., Bogotá, Colombia. La yuca(Manihot esculenta Crantz)fuecomprada en un supermercado en Bogotá y fue rallada manualmente luego de retirar la cascara empleando un rallador de plástico doméstico convencional.
Identificación del microorganismo
La identificación se realizó mediante técnicas de biología molecular en el laboratorio de micología y fitopatología (LAMFU) de la Universidad de los Andes de Bogotá. El Penicillium sp. fue crecido en medio líquido SDY (sucrosa, dextrosa y extracto de levadura) (9). A partir de la biomasa generada se realizó una extracción de ADN total a través del método de extracción por fenol-cloroformo (10). Posteriormente, se amplificó por PCR la región ITS1- 5,8S-ITS2 de la subunidad ribosomal, con los cebadores universales ITS4 e ITS5 (11). La región amplificada fue secuenciada por la compañía Macrogen (Seúl, Corea). La identificación molecular se realizó comparando la secuencia obtenida contra todas las secuencias nucleotídicas de hongos reportadas en la base de datos del NCBI (National Center for Biotechnology Information: http://www.ncbi.nlm.nih.gov), los análisis bioinformáticos se hicieron utilizando el algoritmo Blastn. Los alineamientos con mayor puntaje y máxima identidad obtenidos (E value= 0; identidad 100%) permiten identificar el microorganismo como perteneciente a la especie P. commune.
Obtención del inoculo
El micelio de P. commune fue suspendido en agua estéril, con agitación constante durante 10 min. se filtró sobre gasa estéril en condiciones asépticas para retirar el micelio sobrenadante, y se realizó el conteo de esporas con un hemacitómetro. Una suspensión de 1x107 esporas/mL se utilizó para inocular los medios de fermentación.
Medio de fermentación y producción enzimática
Los medios de fermentación se prepararon tomando como referencia el medio Czapcek-Dox (9), y se suplementaron con CaCl2. Se formularon dos medios, según la fuente de carbono, almidón de yuca o yuca rallada, y se realizaron dos tipos de fermentaciones, FFS y FLS, en condiciones estáticas.
Para las FFS el medio se preparó con 10 g de almidón ó 10 g de yuca rallada, humedecidos con 10 mL de solución de sales. El medio para la FLS contenía 3,0 g de almidón de yuca ó 3,0 g de yuca rallada, suspendidos en 100 mL de solución de sales diluída 1:10. La solución de sales contenía (g/100 mL de agua destilada): (NH4)2SO4, 3,00; MgSO4, 0,50; KCl, 0,50; FeSO4, 0,01; K2HPO4, 1,00; CaCl2, 0,15.
Los medios se esterilizaron a 121 °C y 15 psi por 15 min, se inocularon con 1 mL de suspensión de esporas de P. commune y se incubaron a 22 °C. Se hizo seguimiento cada 24 horas de la producción de la enzima. Para la FLS se separó el hongo mediante centrifugación por 30 min a 8 000 rpm, en una centrífuga MLW modelo T52; el sobrenadante constituyó el extracto crudo. En el caso de la FFS se adicionaron 50 mL de buffer fosfato 0,1 M pH 7,0, se agitó mecánicamente durante 30 min en un agitador de placa MLW modelo Thys 2 a 80 oscilaciones completas por minuto, se filtró la solución sobre algodón y se centrifugó por 30 min a 8 000 rpm, el sobrenadante constituyó el extracto crudo. Se tomaron 10mL de cada extracto crudo y se dializaron contra agua destilada para realizar medidas de concentración de proteína y actividad enzimática.
El trabajo se continuó empleando la FFS con yuca rallada, por ser el medio en el cual se obtuvo la mayor producción de enzima.
Producción de la enzima por fermentación en fase sólida
Se emplearon bandejas de aluminio (22,50 cm X 16,50 cm X 2,50 cm), en cada una se puso una capa de 1 cm de espesor aproximadamente de la mezcla de 100 g de yuca rallada y 100 mL de solución de sales. Las bandejas con el medio se esterilizarona121 °Cy15psi durante 15 min y se inocularon con 3 mL de la suspensión de esporas. La incubación se realizó a 22 °C durante siete días. Para obtener el extracto crudo se añadieron 150 mL de buffer fosfato 0,1 M pH 7,0, se agitó mecánicamente durante una hora a temperatura ambiente en un agitador de placa MLW modelo Thys 2 a 80 oscilaciones completas por minuto, y se filtró la solución sobre algodón para retirar los sólidos gruesos. Al residuo se le realizó una segunda extracción bajo las mismas condiciones y se juntaron los dos extractos. El filtrado total se centrifugó a 8 000 rpm por 30 min, en una centrifuga MLW modelo T52, el precipitado se descartó y se obtuvo un sobrenadante con un volumen de 2085 mL. De este sobrenadante se tomaron 100 mL para realizar ensayos preliminares de precipitación fraccionada con sulfato de amonio.
Determinación de actividad enzimática y cuantificación de proteínas
Para medir la actividad α-amilasa se utilizó el método de Nelson-Somogyi (12). La mezcla de reacción contiene 1 mL de solución de almidón soluble al 1% (p/v), 200 ,µL de una dilución apropiada de la muestra que contiene la enzima, y 800 ,µL de CaCl2 5mM. Luego de 20 min de reacción a 37 °C, se adicionan 500 ,µL del reactivo de Somogyi y se lleva la mezcla a un baño María a temperatura de ebullición. Pasados 10 min, se retira la mezcla del baño y se adicionan 500 ,µL del reactivo de Nelson, se completa el volumen a 10 mL con agua destilada y se realiza la determinación colorimétrica a 500 nm (espectrofotómetro Genesys 5).
Una unidad de actividad enzimática se define como la cantidad de enzima que libera 1 ,µg de glucosa por minuto bajo las condiciones del ensayo, 37 °C, pH 6,0. La actividad específica se define como las unidades de actividad por miligramo de proteína.
La concentración de proteínas fue determinada por el método colorimétrico de Bradford (13), empleando albúmina sérica bovina como proteína patrón.
Purificación de la enzima
Precipitación con sulfato de amonio
El extracto crudo fue sometido a precipitación fraccionada con sulfato de amonio. La fracción con la proteína de interés precipitó entre 50 y 80% de saturación. Este precipitado se disolvió en el mínimo volumen de agua destilada, se dializó 24 h contra agua destilada y se liofilizó.
Cromatografía de intercambio aniónico
El liofilizado de la etapa anterior se disolvió en el mínimo volumen de buffer fosfato 50 mM, pH 6,0, y se aplicó a una columna de DEAE Sephadex A-50 (2,5 x 30,0 cm) equilibrada con el mismo buffer. La elusión se realizó por medio de un gradiente discontinuo de fuerza iónica (NaCl 0,1 a 0,5 M). La velocidad de flujo fue de 30 mL/h. A cada fracción (5 ml) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que contenían la proteína de interés, se mezclaron en un pool (pool DEAE-pico II), que se dializó contra agua destilada y se liofilizó.
Cromatografía de filtración por gel
El pool DEAE-pico II se disolvió en NaCl al 1% y fue sometido a cromatografía de filtración por gel sobre Sepha-dex G-75 (2,5 X 30,0 cm). La elusión de las proteínas se realizó con NaCl al 1%. La velocidad de flujo fue de 27 mL/h. A cada fracción (4,5 mL) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que mostraron mayor actividad enzimática, se mezclaron en un pool (pool G-75-pico II) que se dializó contra agua destilada y se concentró por liofilización.
Cromatografía de intercambio catiónico
El pool G-75-pico II se disolvió en buffer fosfato0,05M,pH7,0yfue sometidoa cromatografía de intercambio catiónico sobre CM Sephadex C-50 (2,5 x 30,0 cm). La elusión se realizó por medio de un gradiente discontinuo de fuerza iónica (NaCl 0,1 a 0,5 M). La velocidad de flujo fue de 27 mL/h. A cada fracción (4,5 mL) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que contenían la proteína de interés, se mezclaron en un pool (pool CM-pico I) que se dializó contra agua destilada y se liofilizó.
Caracterización de la enzima
Determinación del peso molecular por electroforesis en condiciones desnaturalizantes
Se corrieron electroforesis SDS-PAGE (14), con geles de poliacrilamida al 12%, los cuales se tiñeron con azul de Coomassie. Los marcadores de peso molecular empleados fueron de la marca Bio-Rad, con las siguientes proteínas como estándares: fosforilasa B (104 kDa), albúmina de suero bovino (83 kDa), ovoalbúmina (49 kDa), anhidrasa carbónica (37 kDa), inhibidor de la tripsina de soya (29 kDa) y lisozima (20 kDa).
Efecto del pH sobre la actividad y la estabilidad de la enzima
El pH óptimo de la enzima fue determinado realizando medidas de actividad en un rango de pH entre 2,0 y 12,0 a 37 °C. Para establecer el efecto del pH sobre la estabilidad, la enzima fue incubada a 37 °C por 1 h en diferentes buffers en un rango de pH entre 2,0 y 12,0 y la actividad residual fue determinada bajo las condiciones normales del ensayo. Se usaron buffers glicina-HCl, acetato-acético, fosfato y glicina-NaOH, todos con concentración 100 mM.
Efecto de la temperatura sobre la actividad y la estabilidad de la enzima
La temperatura óptima de la enzima fue determinada en un rango de temperatura entre 0 y 92 °C en buffer fosfato 100 mM, pH 6,0. El efecto de la temperatura sobre la estabilidad fue establecido incubando por 1 h la enzima en buffer fosfato 100 mM, pH 6,0 en un rango de temperatura entre 40 y 92 °C. La actividad residual fue determinada bajo las condiciones normales del ensayo.
Efecto de la concentración de sustrato
Se utilizaron siete concentraciones diferentes de almidón soluble (0,2-1,4 mg/mL). Las mediciones de actividad se realizaron bajo las condiciones normales del ensayo. La mezcla de reacción contenía 100 ,µL de enzima purificada; 100 ,µL de CaCl2 5 mM; 800,µL de buffer fosfato 100 mM, pH 6,0, y 1 mL de solución de almidón. La estimación de Km y Vmáx se realizó a partir de la linealización de Li-neweaver-Burk.
Efecto de algunos iones metálicos, EDTA y SDS sobre la actividad enzimática
Se utilizaron las siguientes sales: CuSO4.5H2O, CaCl2.2H2O, LiCl, FeCl3.6H2O, AgNO3, HgCl2, BaCl2 y CoCl2. La concentración final de sal en la mezcla de reacción para todos los casos fue 1,0 mM. La enzima, previamente dializada contra agua destilada, se incubó con la solución de la sal durante 30 min a 37 °C, luego se determinó la actividad residual bajo las condiciones normales del ensayo. La actividad sin adición de los iones metálicos fue definida como de 100%. Para medir los efectos de EDTA y SDS, la enzima fue incubada con el componente respectivo por 30 min a 37 °C, luego se realizó la medición de actividad enzimática residual bajo las condiciones normales del ensayo. La concentración final en la mezcla de reacción para ambos compuestos fue 10 mM. La actividad en ausencia de EDTA y SDS fue considerada como de 100%.
Capacidad para hidrolizar el almidón de yuca y productos de hidrólisis
Los productos finales de hidrólisis luego de 10, 20, 30 y 60 min de incubación fueron evaluados según Hmidet et al. (15), mediante comparación con patrones de glucosa y maltosa en una cromatografía de capa delgada (silica gel 60 F254 Merck), la fase móvil fue cloroformo/acético/agua (70:60:10, v/v/v) y el revelado se hizo con H2SO4/metanol (5:95, v/v). Los productos de hidrólisis fueron observados como manchas oscuras luego de adicionar el revelador y calentar a 120 °C por 3 min.
RESULTADOS Y DISCUSIÓN
Producción de la enzima
La cinética de producción de α-amilasa en los diferentes medios de cultivo se presenta en la Figura 1.
En los medios con yuca rallada hay un incremento de la actividad α-amilasa a partir de 48 horas, con un máximo a las 168 horas (siete días), en las que la actividad enzimática fue de 8,21 U/mL para la FFS y 6,15 U/mL para la FLS. En cuanto a los medios con almidón de yuca, la actividad enzimática comienza a aumentar a partir de las 120 horas (5 días) sin alcanzar los valores observados con yuca rallada, no obstante, a partir de las 168 horas (7 días) se aprecia un incremento en la actividad enzimática en la fermentación líquida sumergida que presenta un valor máximo de 7,76 U/mL a los 10 días de observación.
El crecimiento de P. commune, un hongo filamentoso, se favoreció en el medio sólido empleando yuca rallada; este medio ofrecía una mayor área superficial y presentaba una textura más rugosa, semejante a las condiciones de los hábitats usuales de este microorganismo.
Los resultados obtenidos sugieren que la yuca rallada constituye un mejor soporte para la producción de α-amilasa por P. commune y que en caso de usar almidón de yuca en fermentación en fase sólida, la producción de la misma cantidad de α-amilasa tomaría más tiempo.
Purificación de la enzima
La purificación de α-amilasa de P. commune se resume en la Tabla 1. El extracto crudo fue precipitado por adición de sulfato de amonio, la mayor actividad α-amilasa se encontró en la fracción 50-80%, esta fracción fue aplicada a una columna de DEAE Sephadex A-50, cuyo perfil de elusión (Figura 2) mostró un único pico con actividad α-amilasa luego de la adición de buffer fosfato 50 mM, pH 6,0 NaCl 0,2 M. Las fracciones del pico con actividad fueron reunidas en el pool DEAE-pico II, el cual fue dializado contra agua destilada y liofilizado, alcanzando un grado de purificación de 10,53.
Este pool fue aplicado a una columna de Sephadex G-75, la elusión se realizó con NaCl al 1%. El perfil cromatográfico (Figura 3) mostró un único pico de actividad α-amilasa, las fracciones del pico activo fueron reunidas en el pool G-75 pico II, el cual fue dializado contra agua destilada y liofilizado, con este paso se alcanzó un grado de purificación de 28,75.
El pool G-75 pico II se disolvió en buffer fosfato 50 mM, pH 7,0, y fue aplicado a una columna de CM Sephadex C-50. El perfil de elusión (Figura 4) mostró un único pico con actividad α-amilasa luego de la adición de buffer fosfato 50 mM, pH 7,0 NaCl 0,1 M. Las fracciones con actividad fueron reunidas en el pool CM- pico I, el cual fue dializado contra agua destilada, liofilizado y disuelto en buffer fosfato 50 mM, pH 7,0, alcanzando un grado de purificación final de 61,85. Este pool mostró una sola banda en la electroforesis SDS-PAGE (Figura 5), indicando la purificación hasta la homogeneidad de la enzima.
Peso molecular
La comparación de la movilidad electroforética de la α-amilasa de P. commune con la de los marcadores de peso molecular en una electroforesis SDS-PAGE (Figura 6) permite establecer un peso molecular de 35 kDa. El rango de peso molecular para las α-amilasas oscila entre 10 y 210 kDa (2), sin embargo, la mayoría de las α-amilasas microbianas tienen su peso molecular entre 30 - 70 kDa, rango en el que se encuentra la α-amilasa de P. commune.
Efecto del pH sobre la actividad y la estabilidad de la enzima
Cuando la actividad de la enzima fue ensayada con diferentes valores de pH, la máxima actividad se obtuvo con pH 6,0.
En otros estudios, el pH óptimo de la α-amilasa de Penicillium chrysogenum fue de 5,0 (7) y el de la α-amilasa dePenicilium griseofulvum de 5,5 (8). Aunque el pH óptimo para las α-amilasas varía entre 2,0 y 12,0 (2), la mayoría de las α-amilasas microbianas tienen su pH óptimo en el rango ligeramente ácido a neutro, rango en el que se encuentra el pH óptimo de la α-amilasa de Penicillium commune.
Luego de la incubación de la enzima por 1 h en buffer de diferente pH, se observa que la enzima fue estable en el rango de pH 5,0-7,0. La enzima retuvo 95% de su actividad con un pH 5,0 y 98,8% con un pH 7,0. Rangos de estabilidad en el pH similares han sido reportados para las α-amilasas de Aspergillus awamori (16) y Thricoderma viride (17).
Efecto de la temperatura sobre la actividad y la estabilidad de la enzima
La temperatura a la cual se alcanza la máxima actividad y, por tanto, corresponde a la temperatura óptima de reacción, es 70 °C. Cuando se sobrepasa este valor, la actividad disminuye rápidamente porque la enzima se va desnaturalizando.
Como se puede observar en la Figura 7, cuando la enzima fue incubada durante una hora en buffer fosfato 100 mM, pH 6,0 en un rango de temperatura entre 40 y 92 °C, la actividad decreció rápidamente a partir de 50 °C, indicando que el rango de estabilidad térmica de la enzima es 0-50 °C. Vale la pena destacar que la enzima conserva 35% de su actividad después de ser calentada una hora a 92 °C. Una consecuencia de orden práctico derivada de este hallazgo, es la necesidad de revisar cuál es el tiempo requerido para la inactivación total de la enzima en las medidas de actividad por el método de Nelson-Somogyi.
Con los datos obtenidos en la determinación de la temperatura óptima se construyó una gráfica de Arrhenius (Figura 8) para así poder analizar la inactivación térmica de la enzima. El cambio de pendiente cerca a los 50 °C que se observa en la gráfica, sugiere que la incubación por periodos prolongados de tiempo a esta temperatura induce un cambio conformacional de la enzima. Un caso de comportamiento similar fue reportado por Uchino, para una α-amilasa de Bacillus sp. (18).
Parámetros cinéticos Km y Vmáx
Los valores de Km y Vmáx determinados usando la linelización de Lineweaver-Burk (Figura 9) fueron 0,48 mg/mL y 5,85 jiímol glucosa/min, respectivamente. La α-amilasa de Penicillium commune presenta una cinética típica de Michaelis-Menten y posee una alta afinidad por el almidón soluble respecto a otras α-amilasas microbianas comoThermofibida fusca (0,88 mg/mL), Aureobasidiumpullulans (5,75 mg/mL) y Bacillus sp. (1,64 mg/mL) (18, 19, 20), sin embargo, es muy similar a la del hongo filamentoso Aspergillus fumigatus (0,42 mg/mL) (21).
Efecto de algunos iones metálicos, del EDTA y del SDS sobre la actividad enzimática
El efecto de algunos iones metálicos, del EDTA y del SDS sobre la actividad enzimática de la α-amilasa dePenicillium commune se muestra en la Figura 10. Las α-amilasas son proteínas pequeñas que contienen por lo menos un ión Ca2+ por molécula. La cantidad de iones Ca2+ puede variar de uno a diez dependiendo del origen de la enzima. De acuerdo con Gupta, et al. (2), para lograr una completa remoción de los iones Ca2+ no basta con dializar contra agua destilada, se hace necesario tratar la enzima con EDTA o EGTA. Además, según Nielsen, et al. (22), de los tres iones calcio (CaI, CaII, CaIII) que la α-amilasa de Bacillus halmapalus contiene, es posible remover CaIII sin observar cambios estructurales significativos, pero no CaI o CaII. Lo anterior justifica que luego de la diálisis contra agua destilada no se genere pérdida total de la actividad enzimática y, por lo tanto, se pueda evaluar el efecto de los iones escogidos, del EDTA y del SDS.
Como se puede notar, Ca2+,Ba2+ y Ag+ aumentan significativamente la actividad de la enzima, siendo el ión Ca2+el que tiene el más alto poder activador. El efecto activador del calcio puede estar relacionado con interacciones adicionales favorables que contribuyen a la neutralización de las cargas negativas en la de los dominios estructurales A y B de la enzima (22). Cu2+ no altera significativamente la actividad de la enzima, mientras que Li+ y Fe3+ la disminuyen ligeramente y Co2+ y Hg2+ la disminuyen considerablemente.
La inhibición por iones mercurio sugiere, tal como lo indican Li, et al. (20), que residuos aminoacídicos con grupos sulfihidrilo o imidazol son importantes en la función de la enzima. Esta afirmación concuerda con el hecho de que varios residuos de histidina (His210, His122, numeración para Taka amilasa) están implicados en el mecanismo catalítico de las α-amilasas. El agente quelante EDTA y el surfactante SDS también mostraron acción inhibitoria sobre la actividad de la enzima. La inhibición que ocasiona el EDTA apoya la sugerencia de que la α-amilasa de P. commune contiene calcio, y que su actividad es dependiente de este ión. En cuanto al SDS, se corrobora su efecto sobre la estructura terciaria de la enzima, sin que se presente completa desnaturalización con la concentración ensayada.
Capacidad para hidrolizar el almidón de yuca y productos de hidrólisis
El análisis cromatográfico de los productos de hidrólisis del almidón de yuca por α-amilasa de Penicillium communese muestra en la Figura 11. Entre los principales productos de hidrólisis se encuentran maltosa y glucosa. La producción de trazas de glucosa fue determinada desde los 10 min de reacción, así como la formación de pequeñas cantidades de maltosa y dextrinas, cuya cantidad fue aumentando a medida que aumentaba el tiempo de reacción. Este resultado proporciona evidencia de que la enzima presenta el comportamiento característico de una α-amilasa, ya que es capaz de romper los enlaces glicosídicos α-1,4 del almidón de yuca, lo cual es de interés por su potencial en la producción de biocombustibles.
Resultados similares en la hidrólisis de almidón han sido reportados para las α-amilasas de Penicillium griseofulvumy Penicülium chrysogenum (7, 8).
CONCLUSIONES
Tanto el almidón de yuca como la yuca blanca colombiana (Manihot esculenta crantz) empleados como soporte, permiten el crecimiento de Penicillium commune. En las condiciones usadas en esta investigación, el microorganismo sólo produce una α-amilasa. La comparación de las cinéticas de producción de la enzima en cultivos en FFS y FLS estático, permite establecer que la fermentación en fase sólida con yuca blanca rallada arroja los mejores resultados en cuanto a actividad α-amilasa.
La enzima presenta un pH óptimo de 6,0 y fue estable en un rango de pH entre 5,0 y 7,0 a 37 °C, además tiene una temperatura óptima de 70 °C y presenta máxima estabilidad en el rango 0-50 °C. Con temperaturas superiores probablemente la enzima adquiere un estado conformacional que le permite conservar 35% de su actividad después de ser calentada a 92 °C durante una hora.
La gráfica de Arrhenius presenta un cambio de pendiente cerca a los 50 °C, sugiriendo que la incubación por periodos prolongados de tiempo a esta temperatura induce un cambio conformacional de la enzima.
Dado que Ca2+ tiene el más alto poder activador y el EDTA causa una fuerte inhibición, se confirma que la α-amilasa de Penicillium commune contiene calcio, y que su actividad es dependiente de este ión.
La α-amilasa de Penicillium commune es activa sobre almidón de yuca usado como sustrato, lo cual se evidencia en la producción de maltosa y glucosa en la cromatografía de capa delgada sobre silica gel.
AGRADECIMIENTOS
A la profesora Pilar Meléndez del departamento de farmacia de la Universidad Nacional de Colombia por el suministro de la cepa de Penicillium sp. y al Sr. Gregorio Medina del laboratorio de microbiología del Instituto de Ciencia y Tecnología de Alimentos (ICTA) de la Universidad Nacional de Colombia por el servicio de liofilización.
A las profesoras Luisa Castiblanco y Silvia Restrepo, del laboratorio de micologia y fitopatología (LAMFU) de la Universidad de los Andes de Bogotá, por su valiosa colaboración en la identificación del Penicillium commune.
REFERENCIAS BIBLIOGRÁFICAS
1. Maheshwari, R.; Bharadwaj, G.; Bhat, M. Thermophilic fungi: their physiology and enzymes. Microbiology and Molecular Biology Reviews. 2000. 64: 461-488.
2. Gupta, R.; Gigras, H.; Mohapatra, H.; Goswami, V.; Chauhan, B. Microbial a-amylases: a biotechnological perspective. Process Biochemistry. 2003. 38: 1599-1616.
3. Pandey, A.; Soccol, C.R. New developments in solid state fermentation: I-bioprocesses and products. Process Biochemistry. 2000. 35: 1153-1169.
4. Soni, S. K.; Arshdeep, K.; Gupta, J. K. A solid state fermentation based bacterial a-amylase and fungal glucoamylase system and its suitability for the hydrolysis of wheat starch. Process Biochemistry. 2003. 39: 185-192.
5. Hõlker, U.; Lenz, J. Solid- state fermentation - Are there any biotechno-logical advantages? Current Opinion in Microbiology. 2005. 8: 301-306.
6. McTigue,M. A.; Kelly, C.T.; Doyle, E. M.; Fogarty, W. M. The alkaline amylase of the alkalophilic Bacillus sp.IMD 370. Enzyme and Microbial Technology. 1995. 17: 570-573.
7. Balkan, B. y Ertan, F. Production and properties of a-amylase from Penicillium chrysogenum and its application in starchhydrolysis. Preparative Biochemistry and Biotechnology. 2005. 35: 169-178.
8. Ertan, F.; Yagar, H.; Balkan, B. Some properties of free and inmobilized a-amylase from Penicillium griseofulvumby solid state fermentation. Preparative Biochemistry and Biotechnology. 2006. 36: 81-91.
9. Merck. Manual de medios de cultivo. 1990. p. 77.
10. Sambrook, J.; E. F. Fritsch, and T. Maniatis. 1989. Molecular cloning: a laboratory manual, 2nd ed., vol. I. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.
11. White, T. J.; T. Bruns, S. Lee, and J. Taylor. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics, p. 315-322. In N. Innis, D. Gelfand, J. Sninsky, and T. White (ed.), PCR protocols: a guide to methods and applications. Academic Press, Inc., New York.
12. Nelson, N. A photometric adaptation of the Somogyi method for the determination of glucose. J. Biol. Chem.1944. 153: 375-380.
13. Bradford, M. M. A rapid and sensitive method for the quantization of micrograms quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976. 72: 248-254.
14. Laemmli, U. K. Cleavage of the structure proteins during the assembly of the head of bacteriophage T4.Nature. 1970. 227: 680-685.
15. Hmidet, N.; Bayoudh, A.; Berrin, J. G.; Kanoun, S.; Juge, N.; Nasri, M. Purification and biochemical characterization of a novel a-amylase from Bacillus licheniformis NH1 cloning, nucleotide sequence and expression of amyN gene in Escherichia coli. Process Biochemistry. 2008. 43 (5): 499-510.
16. Bhella, R.S.; Altosaar, I. Purification and some properties of the extracellular a-amylase from Aspergillus awamori. Can J Microbiol. 1985.31: 149-153.
17. Schellart, J. A.; Visser, M. W.; Zandstva, T.; Middlehover, W. J. Starch degradation by the mold Trichoderma viride I. The mechanism of degradation. Antonie Van Leeuwenhock J Microbiol Serol. 1976. 42: 229-238.
18. Uchino, F. A thermophilic and unusually acidophilic amylase produced by a thermophilic acidophilic Bacillus sp.Agrie Biol. Chem.1982. 46 (1): 7-13.
19. Yang, C. H.; Liu, W. H. Purification and properties of a maltotriose-producing a-amylase from Thermobifida fusca. Journal of Industrial Microbiology and Biotechnology. 2004. 35 (2-3): 254-260.
20. Li, H.; Chi, Z.; Wang, X. D.; Ma, L.; Gao, L. Purification and characterization of extracellular amylase from the marine yeast Aureobasidium pullulans N13d and its raw potato starch digestion. Enzyme and Microbial Technology. 2007 . 40: 1006-1012.
21. Planchot, V.; Colonna, P. Purification and characterization of extracellular alpha-amylase from Aspergillus fumigatus. Carbohydrate Research. 1995. 272 (1): 97-109.
22. Nielsen, A. D.; Pusey, M. L.; Fuglsang, C. C.; Westha, P. A proposed mechanism for the thermal denaturation of a recombinant Bacillus halmapalus a-amylase-the effect ofcalcium ions. Biochimica et Biophysica Acta. 2003.1652: 52-63.
PURIFICACIÓN Y CARACTERIZACIÓN DE α-AMILASA DE PENICILLIUM COMMUNE PRODUCIDA MEDIANTE FERMENTACIÓN EN FASE SÓLIDA
PURIFICATION AND CHARACTERIZATION OF α-AMYLASE FROM PENICILLIUM COMMUNE PRODUCED BY SOLID STATE FERMENTATION
PURIFICAÇÃO E CARACTERIZAÇÃO DA α-AMILASA DEPENICILLIUM COMMUNE PRODUZIDA MEDIANTE FERMENTAÇÃO EM FASE SÓLIDA
Esperanza Espinel1,2, Elizabeth López1,3
1 Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá. Bogotá, Colombia.
2 Dirección actual Colegio Marruecos y Molinos IED, SED. Bogotá, Colombia. neespinelb@unal.edu.co
Recibido: 17/12/08 - Aceptado: 21/08/09
RESUMEN
Este estudio reporta la purificación y caracterización parcial de una α-amilasa producida por Penicillium communemediante fermentación en fase sólida, empleando yuca blanca colombiana (Manihot esculenta Crantz) como soporte. La enzima fue purificada por precipitación fraccionada con sulfato de amonio, cromatografía de intercambio aniónico (DEAE-Sephadex A-50), cromatografía de filtración por gel (Sephadex G-75) y cromatografía de intercambio catiónico (CM-Sephadex C-50) obteniendo una actividad específica final de 314,82 U/mg, un grado de purificación del orden de 62 y un rendimiento de 9%. La purificación hasta la homogeneidad fue confirmada por SDS-PAGE. El peso molecular estimado fue 35 kDa. La enzima mostró máxima actividad de hidrólisis de almidón soluble con pH 6,0, y estabilidad en un intervalo de pH de 5,0-7,0. La estabilidad térmica de la enzima se presentó en el intervalo de temperatura 0-50 °C y su temperatura óptima fue 70 °C. Los iones Ca2+,Ba2+ y Ag+aumentaron significativamente la actividad de la enzima, siendo el ión Ca2+ el que tuvo el más alto poder activador. Cu2+ no alteró significativamente la actividad de la enzima, mientras que Li+ yFe3+ la disminuyeron ligeramente (13%), y Co2+ y Hg2+ la disminuyeron 25% y 40% respectivamente. Los valores de Km y Vmáxfueron calculados usando la linealización de Lineweaver-Burk, con el resultado Km = 0,48 mg/mL y Vmáx = 5,85 µmol glucosa/min. Entre los principales productos de hidrólisis del almidón de yuca se encuentran la maltosa y la glucosa, este resultado proporciona evidencia de que la enzima es capaz de romper los enlaces glicosídicos α-1,4 del almidón, comportamiento característico de una α-amilasa.
Palabras clave: α-amilasa, Penicillium commune, fermentación en fase sólida, yuca blanca colombiana.
ABSTRACT
This study reports the purification and partial characterization of an α-amylase from Penicillium communeproduced by solid state fermentation using colombian white tapioca (Manihot esculenta Crantz) as support. The enzyme was purified by ammonium sulphate precipitation, anion exchange chromatography (DEAE-Sep-hadex A-50), gel filtration chromatography (Sephadex G-75) and cation exchange chromatography (CM-Sephadex C-50). A purification factor of 62 with a 9% yield and final specific activity of 314.82 U/mg were recorded. Purification to homogeneity was confirmed by SDS PAGE. The molecular weight was estimated to be 35 kDa. The enzyme shows maximal activity in the soluble starch hydrolysis at pH 6.0, and is stable in a range of pH from 5.0 to 7.0. Thermal stability was in the range of temperature from 0 to 50 °C, and its optimal temperature was 70 °C. Ions Ca2+,Ba2+and Ag+ significantly increase the activity of the enzyme, with ion Ca2+ as the highest activator. Cu2+ does not alter significantly the activity of the enzyme, whereas Li+ and Fe3+ decrease it slightly (13%) and Co2+ and Hg2+decrease it 25% and 40% respectively. Km = 0.48 mg/mL and Vmax = 5.85 /xmol glucose/min were calculated using the linearization of Lineweaver-Burk. Among hydrolysis products of tapioca starch are maltose and glucose, this result provides evidence of the enzyme ability to hydrolyze the starch α-1,4 glucosidic linkages, a characteristic behavior of an α-amylase.
Key words: α-amylase, Penicillium commune, solid state fermentation, colombian white tapioca.
RESUMO
Este estudo reporta a purificação e caracterização parcial de uma α-amilasa produzida por Penicillium communemediante fermentação em fase sólida usando mandioca branca colombiana (Manihot esculenta Crantz) como suporte. A enzima foi purificada por precipitação fraccionada com sulfato de amónio, cromato-grafia de intercambio aniónico (DEAE-Sephadex A-50), cromatografia de filtração por gel (Sephadex G-75) e croma-tografia de intercambio catiónico (CM-Sephadex C-50) obtendo una actividade específica final de 314.82 U/mg, um grau de purificação na ordem de 62 e um rendimento de 9%. A purificação até à homogeneidade foi confirmada por SDS-PAGE. O peso molecular estimado foi de 35 kDa. A enzima mostrou máxima acti-vidade de hidrólises de amido solúvel a pH 6.0, e estabilidade num intervalo de pH de 5.0-7.0. A enzima foi estável num intervalo de temperatura de 0-50 °C, e sua temperatura óptima de reacção foi de 70°C. Íons Ca2+,Ba2+ eAg+ aumentaram significativamente a actividade da enzima, sendo o ião Ca2+, o que teve o mais alto poder indutor. Cu2+ não alterou significativamente a actividade da enzima, enquanto que Li+ eFe3+ a diminuíram ligeiramente (13%), e Co2+ eHg2+ a diminuíram 25% e40% respectivamente. Os valores de Km eVmáx foram calculados usando a linearização de Lineweaver-Burk, obtendo Km = 0.48 mg/mL e Vmáx = 5.85 µmol glucosa/min. Entre os principais produtos de hidrólises do amido de mandioca encontram-se a maltosa e glucosa; este resultado proporciona evidencia de que a enzima é capaz de romper os enlaces glucosídicos α-1,4 do amido, comportamento característico de uma α-amilasa.
Palavras-chave: α-amilasa, Penicillium commune, fermentação em fase sólida, mandioca branca colombiana.
INTRODUCCION
Las α-amilasas son enzimas que catalizan al azar la hidrólisis de enlaces glicosídicos α-1,4 de polisacáridos como el almidón y el glicógeno, para producir maltosa, oligosacáridos de diferentes tamaños y cadenas más o menos ramificadas llamadas dextrinas límite (1). Son de gran importancia en la industria alimenticia, textil, papelera y farmacológica, y aunque las fuentes productoras de α-amilasas incluyen plantas, animales y microorganismos, son las enzimas microbianas las que encuentran mayor demanda en aplicaciones industriales (2). Tradicionalmente la producción de α-amilasas se ha llevado a cabo mediante procesos de fermentación líquida sumergida (FLS) debido al mayor control de factores ambientales como temperatura y pH, sin embargo, la fermentación en fase sólida (FFS) constituye una alternativa interesante puesto que los metabolitos se concentran, y los procesos de purificación son menos costosos (3, 4). Los medios empleados en FFS son semejantes en textura al habitat natural de hongos filamentosos como Penicillium commune lo que genera mayores rendimientos en la producción de enzimas y la mínima degradación por acción de proteasas (5).
Cada una de las aplicaciones industriales de las α-amilasas requiere propiedades únicas respecto a especificidad, estabilidad, temperatura y dependencia del pH (6), y la búsqueda de enzimas que presenten propiedades diferentes a las conocidas se mantiene como un tema de interés en investigación.
Recientemente se ha reportado la producción de α-amilasa por hongos del género Penicillium (7, 8), sin embargo, en estos trabajos no se lleva a cabo la purificación y posterior caracterización de la enzima, etapas fundamentales para establecer su potencial en aplicaciones bio-tecnológicas.
En esta publicación se describe la producción, purificación y caracterización cinética de una α-amilasa obtenida a partir de una cepa nativa de Penicillium commune mediante fermentación en fase sólida, empleando yuca blanca colombiana (Manihot esculenta crantz) como soporte.
MATERIALES Y MÉTODOS
Materiales y microorganismo
Una cepa de Penicillium sp. fue donada por el laboratorio de microbiología del departamento de farmacia de la Universidad Nacional de Colombia. El microorganismo se mantuvo a temperatura ambiente en medio Saboraud agar-maltosa 4%. El almidón de yuca empleado fue adquirido en Ciacomeq Ltda., Bogotá, Colombia. La yuca(Manihot esculenta Crantz)fuecomprada en un supermercado en Bogotá y fue rallada manualmente luego de retirar la cascara empleando un rallador de plástico doméstico convencional.
Identificación del microorganismo
La identificación se realizó mediante técnicas de biología molecular en el laboratorio de micología y fitopatología (LAMFU) de la Universidad de los Andes de Bogotá. El Penicillium sp. fue crecido en medio líquido SDY (sucrosa, dextrosa y extracto de levadura) (9). A partir de la biomasa generada se realizó una extracción de ADN total a través del método de extracción por fenol-cloroformo (10). Posteriormente, se amplificó por PCR la región ITS1- 5,8S-ITS2 de la subunidad ribosomal, con los cebadores universales ITS4 e ITS5 (11). La región amplificada fue secuenciada por la compañía Macrogen (Seúl, Corea). La identificación molecular se realizó comparando la secuencia obtenida contra todas las secuencias nucleotídicas de hongos reportadas en la base de datos del NCBI (National Center for Biotechnology Information: http://www.ncbi.nlm.nih.gov), los análisis bioinformáticos se hicieron utilizando el algoritmo Blastn. Los alineamientos con mayor puntaje y máxima identidad obtenidos (E value= 0; identidad 100%) permiten identificar el microorganismo como perteneciente a la especie P. commune.
Obtención del inoculo
El micelio de P. commune fue suspendido en agua estéril, con agitación constante durante 10 min. se filtró sobre gasa estéril en condiciones asépticas para retirar el micelio sobrenadante, y se realizó el conteo de esporas con un hemacitómetro. Una suspensión de 1x107 esporas/mL se utilizó para inocular los medios de fermentación.
Medio de fermentación y producción enzimática
Los medios de fermentación se prepararon tomando como referencia el medio Czapcek-Dox (9), y se suplementaron con CaCl2. Se formularon dos medios, según la fuente de carbono, almidón de yuca o yuca rallada, y se realizaron dos tipos de fermentaciones, FFS y FLS, en condiciones estáticas.
Para las FFS el medio se preparó con 10 g de almidón ó 10 g de yuca rallada, humedecidos con 10 mL de solución de sales. El medio para la FLS contenía 3,0 g de almidón de yuca ó 3,0 g de yuca rallada, suspendidos en 100 mL de solución de sales diluída 1:10. La solución de sales contenía (g/100 mL de agua destilada): (NH4)2SO4, 3,00; MgSO4, 0,50; KCl, 0,50; FeSO4, 0,01; K2HPO4, 1,00; CaCl2, 0,15.
Los medios se esterilizaron a 121 °C y 15 psi por 15 min, se inocularon con 1 mL de suspensión de esporas de P. commune y se incubaron a 22 °C. Se hizo seguimiento cada 24 horas de la producción de la enzima. Para la FLS se separó el hongo mediante centrifugación por 30 min a 8 000 rpm, en una centrífuga MLW modelo T52; el sobrenadante constituyó el extracto crudo. En el caso de la FFS se adicionaron 50 mL de buffer fosfato 0,1 M pH 7,0, se agitó mecánicamente durante 30 min en un agitador de placa MLW modelo Thys 2 a 80 oscilaciones completas por minuto, se filtró la solución sobre algodón y se centrifugó por 30 min a 8 000 rpm, el sobrenadante constituyó el extracto crudo. Se tomaron 10mL de cada extracto crudo y se dializaron contra agua destilada para realizar medidas de concentración de proteína y actividad enzimática.
El trabajo se continuó empleando la FFS con yuca rallada, por ser el medio en el cual se obtuvo la mayor producción de enzima.
Producción de la enzima por fermentación en fase sólida
Se emplearon bandejas de aluminio (22,50 cm X 16,50 cm X 2,50 cm), en cada una se puso una capa de 1 cm de espesor aproximadamente de la mezcla de 100 g de yuca rallada y 100 mL de solución de sales. Las bandejas con el medio se esterilizarona121 °Cy15psi durante 15 min y se inocularon con 3 mL de la suspensión de esporas. La incubación se realizó a 22 °C durante siete días. Para obtener el extracto crudo se añadieron 150 mL de buffer fosfato 0,1 M pH 7,0, se agitó mecánicamente durante una hora a temperatura ambiente en un agitador de placa MLW modelo Thys 2 a 80 oscilaciones completas por minuto, y se filtró la solución sobre algodón para retirar los sólidos gruesos. Al residuo se le realizó una segunda extracción bajo las mismas condiciones y se juntaron los dos extractos. El filtrado total se centrifugó a 8 000 rpm por 30 min, en una centrifuga MLW modelo T52, el precipitado se descartó y se obtuvo un sobrenadante con un volumen de 2085 mL. De este sobrenadante se tomaron 100 mL para realizar ensayos preliminares de precipitación fraccionada con sulfato de amonio.
Determinación de actividad enzimática y cuantificación de proteínas
Para medir la actividad α-amilasa se utilizó el método de Nelson-Somogyi (12). La mezcla de reacción contiene 1 mL de solución de almidón soluble al 1% (p/v), 200 ,µL de una dilución apropiada de la muestra que contiene la enzima, y 800 ,µL de CaCl2 5mM. Luego de 20 min de reacción a 37 °C, se adicionan 500 ,µL del reactivo de Somogyi y se lleva la mezcla a un baño María a temperatura de ebullición. Pasados 10 min, se retira la mezcla del baño y se adicionan 500 ,µL del reactivo de Nelson, se completa el volumen a 10 mL con agua destilada y se realiza la determinación colorimétrica a 500 nm (espectrofotómetro Genesys 5).
Una unidad de actividad enzimática se define como la cantidad de enzima que libera 1 ,µg de glucosa por minuto bajo las condiciones del ensayo, 37 °C, pH 6,0. La actividad específica se define como las unidades de actividad por miligramo de proteína.
La concentración de proteínas fue determinada por el método colorimétrico de Bradford (13), empleando albúmina sérica bovina como proteína patrón.
Purificación de la enzima
Precipitación con sulfato de amonio
El extracto crudo fue sometido a precipitación fraccionada con sulfato de amonio. La fracción con la proteína de interés precipitó entre 50 y 80% de saturación. Este precipitado se disolvió en el mínimo volumen de agua destilada, se dializó 24 h contra agua destilada y se liofilizó.
Cromatografía de intercambio aniónico
El liofilizado de la etapa anterior se disolvió en el mínimo volumen de buffer fosfato 50 mM, pH 6,0, y se aplicó a una columna de DEAE Sephadex A-50 (2,5 x 30,0 cm) equilibrada con el mismo buffer. La elusión se realizó por medio de un gradiente discontinuo de fuerza iónica (NaCl 0,1 a 0,5 M). La velocidad de flujo fue de 30 mL/h. A cada fracción (5 ml) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que contenían la proteína de interés, se mezclaron en un pool (pool DEAE-pico II), que se dializó contra agua destilada y se liofilizó.
Cromatografía de filtración por gel
El pool DEAE-pico II se disolvió en NaCl al 1% y fue sometido a cromatografía de filtración por gel sobre Sepha-dex G-75 (2,5 X 30,0 cm). La elusión de las proteínas se realizó con NaCl al 1%. La velocidad de flujo fue de 27 mL/h. A cada fracción (4,5 mL) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que mostraron mayor actividad enzimática, se mezclaron en un pool (pool G-75-pico II) que se dializó contra agua destilada y se concentró por liofilización.
Cromatografía de intercambio catiónico
El pool G-75-pico II se disolvió en buffer fosfato0,05M,pH7,0yfue sometidoa cromatografía de intercambio catiónico sobre CM Sephadex C-50 (2,5 x 30,0 cm). La elusión se realizó por medio de un gradiente discontinuo de fuerza iónica (NaCl 0,1 a 0,5 M). La velocidad de flujo fue de 27 mL/h. A cada fracción (4,5 mL) se le midió la absorbancia a 280 nm y la actividad enzimática. Las fracciones que contenían la proteína de interés, se mezclaron en un pool (pool CM-pico I) que se dializó contra agua destilada y se liofilizó.
Caracterización de la enzima
Determinación del peso molecular por electroforesis en condiciones desnaturalizantes
Se corrieron electroforesis SDS-PAGE (14), con geles de poliacrilamida al 12%, los cuales se tiñeron con azul de Coomassie. Los marcadores de peso molecular empleados fueron de la marca Bio-Rad, con las siguientes proteínas como estándares: fosforilasa B (104 kDa), albúmina de suero bovino (83 kDa), ovoalbúmina (49 kDa), anhidrasa carbónica (37 kDa), inhibidor de la tripsina de soya (29 kDa) y lisozima (20 kDa).
Efecto del pH sobre la actividad y la estabilidad de la enzima
El pH óptimo de la enzima fue determinado realizando medidas de actividad en un rango de pH entre 2,0 y 12,0 a 37 °C. Para establecer el efecto del pH sobre la estabilidad, la enzima fue incubada a 37 °C por 1 h en diferentes buffers en un rango de pH entre 2,0 y 12,0 y la actividad residual fue determinada bajo las condiciones normales del ensayo. Se usaron buffers glicina-HCl, acetato-acético, fosfato y glicina-NaOH, todos con concentración 100 mM.
Efecto de la temperatura sobre la actividad y la estabilidad de la enzima
La temperatura óptima de la enzima fue determinada en un rango de temperatura entre 0 y 92 °C en buffer fosfato 100 mM, pH 6,0. El efecto de la temperatura sobre la estabilidad fue establecido incubando por 1 h la enzima en buffer fosfato 100 mM, pH 6,0 en un rango de temperatura entre 40 y 92 °C. La actividad residual fue determinada bajo las condiciones normales del ensayo.
Efecto de la concentración de sustrato
Se utilizaron siete concentraciones diferentes de almidón soluble (0,2-1,4 mg/mL). Las mediciones de actividad se realizaron bajo las condiciones normales del ensayo. La mezcla de reacción contenía 100 ,µL de enzima purificada; 100 ,µL de CaCl2 5 mM; 800,µL de buffer fosfato 100 mM, pH 6,0, y 1 mL de solución de almidón. La estimación de Km y Vmáx se realizó a partir de la linealización de Li-neweaver-Burk.
Efecto de algunos iones metálicos, EDTA y SDS sobre la actividad enzimática
Se utilizaron las siguientes sales: CuSO4.5H2O, CaCl2.2H2O, LiCl, FeCl3.6H2O, AgNO3, HgCl2, BaCl2 y CoCl2. La concentración final de sal en la mezcla de reacción para todos los casos fue 1,0 mM. La enzima, previamente dializada contra agua destilada, se incubó con la solución de la sal durante 30 min a 37 °C, luego se determinó la actividad residual bajo las condiciones normales del ensayo. La actividad sin adición de los iones metálicos fue definida como de 100%. Para medir los efectos de EDTA y SDS, la enzima fue incubada con el componente respectivo por 30 min a 37 °C, luego se realizó la medición de actividad enzimática residual bajo las condiciones normales del ensayo. La concentración final en la mezcla de reacción para ambos compuestos fue 10 mM. La actividad en ausencia de EDTA y SDS fue considerada como de 100%.
Capacidad para hidrolizar el almidón de yuca y productos de hidrólisis
Los productos finales de hidrólisis luego de 10, 20, 30 y 60 min de incubación fueron evaluados según Hmidet et al. (15), mediante comparación con patrones de glucosa y maltosa en una cromatografía de capa delgada (silica gel 60 F254 Merck), la fase móvil fue cloroformo/acético/agua (70:60:10, v/v/v) y el revelado se hizo con H2SO4/metanol (5:95, v/v). Los productos de hidrólisis fueron observados como manchas oscuras luego de adicionar el revelador y calentar a 120 °C por 3 min.
RESULTADOS Y DISCUSIÓN
Producción de la enzima
La cinética de producción de α-amilasa en los diferentes medios de cultivo se presenta en la Figura 1.
En los medios con yuca rallada hay un incremento de la actividad α-amilasa a partir de 48 horas, con un máximo a las 168 horas (siete días), en las que la actividad enzimática fue de 8,21 U/mL para la FFS y 6,15 U/mL para la FLS. En cuanto a los medios con almidón de yuca, la actividad enzimática comienza a aumentar a partir de las 120 horas (5 días) sin alcanzar los valores observados con yuca rallada, no obstante, a partir de las 168 horas (7 días) se aprecia un incremento en la actividad enzimática en la fermentación líquida sumergida que presenta un valor máximo de 7,76 U/mL a los 10 días de observación.
El crecimiento de P. commune, un hongo filamentoso, se favoreció en el medio sólido empleando yuca rallada; este medio ofrecía una mayor área superficial y presentaba una textura más rugosa, semejante a las condiciones de los hábitats usuales de este microorganismo.
Los resultados obtenidos sugieren que la yuca rallada constituye un mejor soporte para la producción de α-amilasa por P. commune y que en caso de usar almidón de yuca en fermentación en fase sólida, la producción de la misma cantidad de α-amilasa tomaría más tiempo.
Purificación de la enzima
La purificación de α-amilasa de P. commune se resume en la Tabla 1. El extracto crudo fue precipitado por adición de sulfato de amonio, la mayor actividad α-amilasa se encontró en la fracción 50-80%, esta fracción fue aplicada a una columna de DEAE Sephadex A-50, cuyo perfil de elusión (Figura 2) mostró un único pico con actividad α-amilasa luego de la adición de buffer fosfato 50 mM, pH 6,0 NaCl 0,2 M. Las fracciones del pico con actividad fueron reunidas en el pool DEAE-pico II, el cual fue dializado contra agua destilada y liofilizado, alcanzando un grado de purificación de 10,53.
Este pool fue aplicado a una columna de Sephadex G-75, la elusión se realizó con NaCl al 1%. El perfil cromatográfico (Figura 3) mostró un único pico de actividad α-amilasa, las fracciones del pico activo fueron reunidas en el pool G-75 pico II, el cual fue dializado contra agua destilada y liofilizado, con este paso se alcanzó un grado de purificación de 28,75.
El pool G-75 pico II se disolvió en buffer fosfato 50 mM, pH 7,0, y fue aplicado a una columna de CM Sephadex C-50. El perfil de elusión (Figura 4) mostró un único pico con actividad α-amilasa luego de la adición de buffer fosfato 50 mM, pH 7,0 NaCl 0,1 M. Las fracciones con actividad fueron reunidas en el pool CM- pico I, el cual fue dializado contra agua destilada, liofilizado y disuelto en buffer fosfato 50 mM, pH 7,0, alcanzando un grado de purificación final de 61,85. Este pool mostró una sola banda en la electroforesis SDS-PAGE (Figura 5), indicando la purificación hasta la homogeneidad de la enzima.
Peso molecular
La comparación de la movilidad electroforética de la α-amilasa de P. commune con la de los marcadores de peso molecular en una electroforesis SDS-PAGE (Figura 6) permite establecer un peso molecular de 35 kDa. El rango de peso molecular para las α-amilasas oscila entre 10 y 210 kDa (2), sin embargo, la mayoría de las α-amilasas microbianas tienen su peso molecular entre 30 - 70 kDa, rango en el que se encuentra la α-amilasa de P. commune.
Efecto del pH sobre la actividad y la estabilidad de la enzima
Cuando la actividad de la enzima fue ensayada con diferentes valores de pH, la máxima actividad se obtuvo con pH 6,0.
En otros estudios, el pH óptimo de la α-amilasa de Penicillium chrysogenum fue de 5,0 (7) y el de la α-amilasa dePenicilium griseofulvum de 5,5 (8). Aunque el pH óptimo para las α-amilasas varía entre 2,0 y 12,0 (2), la mayoría de las α-amilasas microbianas tienen su pH óptimo en el rango ligeramente ácido a neutro, rango en el que se encuentra el pH óptimo de la α-amilasa de Penicillium commune.
Luego de la incubación de la enzima por 1 h en buffer de diferente pH, se observa que la enzima fue estable en el rango de pH 5,0-7,0. La enzima retuvo 95% de su actividad con un pH 5,0 y 98,8% con un pH 7,0. Rangos de estabilidad en el pH similares han sido reportados para las α-amilasas de Aspergillus awamori (16) y Thricoderma viride (17).
Efecto de la temperatura sobre la actividad y la estabilidad de la enzima
La temperatura a la cual se alcanza la máxima actividad y, por tanto, corresponde a la temperatura óptima de reacción, es 70 °C. Cuando se sobrepasa este valor, la actividad disminuye rápidamente porque la enzima se va desnaturalizando.
Como se puede observar en la Figura 7, cuando la enzima fue incubada durante una hora en buffer fosfato 100 mM, pH 6,0 en un rango de temperatura entre 40 y 92 °C, la actividad decreció rápidamente a partir de 50 °C, indicando que el rango de estabilidad térmica de la enzima es 0-50 °C. Vale la pena destacar que la enzima conserva 35% de su actividad después de ser calentada una hora a 92 °C. Una consecuencia de orden práctico derivada de este hallazgo, es la necesidad de revisar cuál es el tiempo requerido para la inactivación total de la enzima en las medidas de actividad por el método de Nelson-Somogyi.
Con los datos obtenidos en la determinación de la temperatura óptima se construyó una gráfica de Arrhenius (Figura 8) para así poder analizar la inactivación térmica de la enzima. El cambio de pendiente cerca a los 50 °C que se observa en la gráfica, sugiere que la incubación por periodos prolongados de tiempo a esta temperatura induce un cambio conformacional de la enzima. Un caso de comportamiento similar fue reportado por Uchino, para una α-amilasa de Bacillus sp. (18).
Parámetros cinéticos Km y Vmáx
Los valores de Km y Vmáx determinados usando la linelización de Lineweaver-Burk (Figura 9) fueron 0,48 mg/mL y 5,85 jiímol glucosa/min, respectivamente. La α-amilasa de Penicillium commune presenta una cinética típica de Michaelis-Menten y posee una alta afinidad por el almidón soluble respecto a otras α-amilasas microbianas comoThermofibida fusca (0,88 mg/mL), Aureobasidiumpullulans (5,75 mg/mL) y Bacillus sp. (1,64 mg/mL) (18, 19, 20), sin embargo, es muy similar a la del hongo filamentoso Aspergillus fumigatus (0,42 mg/mL) (21).
Efecto de algunos iones metálicos, del EDTA y del SDS sobre la actividad enzimática
El efecto de algunos iones metálicos, del EDTA y del SDS sobre la actividad enzimática de la α-amilasa dePenicillium commune se muestra en la Figura 10. Las α-amilasas son proteínas pequeñas que contienen por lo menos un ión Ca2+ por molécula. La cantidad de iones Ca2+ puede variar de uno a diez dependiendo del origen de la enzima. De acuerdo con Gupta, et al. (2), para lograr una completa remoción de los iones Ca2+ no basta con dializar contra agua destilada, se hace necesario tratar la enzima con EDTA o EGTA. Además, según Nielsen, et al. (22), de los tres iones calcio (CaI, CaII, CaIII) que la α-amilasa de Bacillus halmapalus contiene, es posible remover CaIII sin observar cambios estructurales significativos, pero no CaI o CaII. Lo anterior justifica que luego de la diálisis contra agua destilada no se genere pérdida total de la actividad enzimática y, por lo tanto, se pueda evaluar el efecto de los iones escogidos, del EDTA y del SDS.
Como se puede notar, Ca2+,Ba2+ y Ag+ aumentan significativamente la actividad de la enzima, siendo el ión Ca2+el que tiene el más alto poder activador. El efecto activador del calcio puede estar relacionado con interacciones adicionales favorables que contribuyen a la neutralización de las cargas negativas en la de los dominios estructurales A y B de la enzima (22). Cu2+ no altera significativamente la actividad de la enzima, mientras que Li+ y Fe3+ la disminuyen ligeramente y Co2+ y Hg2+ la disminuyen considerablemente.
La inhibición por iones mercurio sugiere, tal como lo indican Li, et al. (20), que residuos aminoacídicos con grupos sulfihidrilo o imidazol son importantes en la función de la enzima. Esta afirmación concuerda con el hecho de que varios residuos de histidina (His210, His122, numeración para Taka amilasa) están implicados en el mecanismo catalítico de las α-amilasas. El agente quelante EDTA y el surfactante SDS también mostraron acción inhibitoria sobre la actividad de la enzima. La inhibición que ocasiona el EDTA apoya la sugerencia de que la α-amilasa de P. commune contiene calcio, y que su actividad es dependiente de este ión. En cuanto al SDS, se corrobora su efecto sobre la estructura terciaria de la enzima, sin que se presente completa desnaturalización con la concentración ensayada.
Capacidad para hidrolizar el almidón de yuca y productos de hidrólisis
El análisis cromatográfico de los productos de hidrólisis del almidón de yuca por α-amilasa de Penicillium communese muestra en la Figura 11. Entre los principales productos de hidrólisis se encuentran maltosa y glucosa. La producción de trazas de glucosa fue determinada desde los 10 min de reacción, así como la formación de pequeñas cantidades de maltosa y dextrinas, cuya cantidad fue aumentando a medida que aumentaba el tiempo de reacción. Este resultado proporciona evidencia de que la enzima presenta el comportamiento característico de una α-amilasa, ya que es capaz de romper los enlaces glicosídicos α-1,4 del almidón de yuca, lo cual es de interés por su potencial en la producción de biocombustibles.
Resultados similares en la hidrólisis de almidón han sido reportados para las α-amilasas de Penicillium griseofulvumy Penicülium chrysogenum (7, 8).
CONCLUSIONES
Tanto el almidón de yuca como la yuca blanca colombiana (Manihot esculenta crantz) empleados como soporte, permiten el crecimiento de Penicillium commune. En las condiciones usadas en esta investigación, el microorganismo sólo produce una α-amilasa. La comparación de las cinéticas de producción de la enzima en cultivos en FFS y FLS estático, permite establecer que la fermentación en fase sólida con yuca blanca rallada arroja los mejores resultados en cuanto a actividad α-amilasa.
La enzima presenta un pH óptimo de 6,0 y fue estable en un rango de pH entre 5,0 y 7,0 a 37 °C, además tiene una temperatura óptima de 70 °C y presenta máxima estabilidad en el rango 0-50 °C. Con temperaturas superiores probablemente la enzima adquiere un estado conformacional que le permite conservar 35% de su actividad después de ser calentada a 92 °C durante una hora.
La gráfica de Arrhenius presenta un cambio de pendiente cerca a los 50 °C, sugiriendo que la incubación por periodos prolongados de tiempo a esta temperatura induce un cambio conformacional de la enzima.
Dado que Ca2+ tiene el más alto poder activador y el EDTA causa una fuerte inhibición, se confirma que la α-amilasa de Penicillium commune contiene calcio, y que su actividad es dependiente de este ión.
La α-amilasa de Penicillium commune es activa sobre almidón de yuca usado como sustrato, lo cual se evidencia en la producción de maltosa y glucosa en la cromatografía de capa delgada sobre silica gel.
AGRADECIMIENTOS
A la profesora Pilar Meléndez del departamento de farmacia de la Universidad Nacional de Colombia por el suministro de la cepa de Penicillium sp. y al Sr. Gregorio Medina del laboratorio de microbiología del Instituto de Ciencia y Tecnología de Alimentos (ICTA) de la Universidad Nacional de Colombia por el servicio de liofilización.
A las profesoras Luisa Castiblanco y Silvia Restrepo, del laboratorio de micologia y fitopatología (LAMFU) de la Universidad de los Andes de Bogotá, por su valiosa colaboración en la identificación del Penicillium commune.
REFERENCIAS BIBLIOGRÁFICAS
1. Maheshwari, R.; Bharadwaj, G.; Bhat, M. Thermophilic fungi: their physiology and enzymes. Microbiology and Molecular Biology Reviews. 2000. 64: 461-488.
2. Gupta, R.; Gigras, H.; Mohapatra, H.; Goswami, V.; Chauhan, B. Microbial a-amylases: a biotechnological perspective. Process Biochemistry. 2003. 38: 1599-1616.
3. Pandey, A.; Soccol, C.R. New developments in solid state fermentation: I-bioprocesses and products. Process Biochemistry. 2000. 35: 1153-1169.
4. Soni, S. K.; Arshdeep, K.; Gupta, J. K. A solid state fermentation based bacterial a-amylase and fungal glucoamylase system and its suitability for the hydrolysis of wheat starch. Process Biochemistry. 2003. 39: 185-192.
5. Hõlker, U.; Lenz, J. Solid- state fermentation - Are there any biotechno-logical advantages? Current Opinion in Microbiology. 2005. 8: 301-306.
6. McTigue,M. A.; Kelly, C.T.; Doyle, E. M.; Fogarty, W. M. The alkaline amylase of the alkalophilic Bacillus sp.IMD 370. Enzyme and Microbial Technology. 1995. 17: 570-573.
7. Balkan, B. y Ertan, F. Production and properties of a-amylase from Penicillium chrysogenum and its application in starchhydrolysis. Preparative Biochemistry and Biotechnology. 2005. 35: 169-178.
8. Ertan, F.; Yagar, H.; Balkan, B. Some properties of free and inmobilized a-amylase from Penicillium griseofulvumby solid state fermentation. Preparative Biochemistry and Biotechnology. 2006. 36: 81-91.
9. Merck. Manual de medios de cultivo. 1990. p. 77.
10. Sambrook, J.; E. F. Fritsch, and T. Maniatis. 1989. Molecular cloning: a laboratory manual, 2nd ed., vol. I. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.
11. White, T. J.; T. Bruns, S. Lee, and J. Taylor. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics, p. 315-322. In N. Innis, D. Gelfand, J. Sninsky, and T. White (ed.), PCR protocols: a guide to methods and applications. Academic Press, Inc., New York.
12. Nelson, N. A photometric adaptation of the Somogyi method for the determination of glucose. J. Biol. Chem.1944. 153: 375-380.
13. Bradford, M. M. A rapid and sensitive method for the quantization of micrograms quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976. 72: 248-254.
14. Laemmli, U. K. Cleavage of the structure proteins during the assembly of the head of bacteriophage T4.Nature. 1970. 227: 680-685.
15. Hmidet, N.; Bayoudh, A.; Berrin, J. G.; Kanoun, S.; Juge, N.; Nasri, M. Purification and biochemical characterization of a novel a-amylase from Bacillus licheniformis NH1 cloning, nucleotide sequence and expression of amyN gene in Escherichia coli. Process Biochemistry. 2008. 43 (5): 499-510.
16. Bhella, R.S.; Altosaar, I. Purification and some properties of the extracellular a-amylase from Aspergillus awamori. Can J Microbiol. 1985.31: 149-153.
17. Schellart, J. A.; Visser, M. W.; Zandstva, T.; Middlehover, W. J. Starch degradation by the mold Trichoderma viride I. The mechanism of degradation. Antonie Van Leeuwenhock J Microbiol Serol. 1976. 42: 229-238.
18. Uchino, F. A thermophilic and unusually acidophilic amylase produced by a thermophilic acidophilic Bacillus sp.Agrie Biol. Chem.1982. 46 (1): 7-13.
19. Yang, C. H.; Liu, W. H. Purification and properties of a maltotriose-producing a-amylase from Thermobifida fusca. Journal of Industrial Microbiology and Biotechnology. 2004. 35 (2-3): 254-260.
20. Li, H.; Chi, Z.; Wang, X. D.; Ma, L.; Gao, L. Purification and characterization of extracellular amylase from the marine yeast Aureobasidium pullulans N13d and its raw potato starch digestion. Enzyme and Microbial Technology. 2007 . 40: 1006-1012.
21. Planchot, V.; Colonna, P. Purification and characterization of extracellular alpha-amylase from Aspergillus fumigatus. Carbohydrate Research. 1995. 272 (1): 97-109.
22. Nielsen, A. D.; Pusey, M. L.; Fuglsang, C. C.; Westha, P. A proposed mechanism for the thermal denaturation of a recombinant Bacillus halmapalus a-amylase-the effect ofcalcium ions. Biochimica et Biophysica Acta. 2003.1652: 52-63.
Cómo citar
IEEE
ACM
ACS
APA
ABNT
Chicago
Harvard
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons (CC. Atribución 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).