Publicado
ENSAMBLES ALGALES EN UN MICROECOSISTEMA NATURAL DE LA PLANTA CARNÍVORA TROPICAL UTRICULARIA FOLIOSA L.
Algal assemblages in freshwater natural microecosystems from the tropical
carnivorous plant Utricularia foliosa L.
JOHN DÍAZ-OLARTE
SANTIAGO R. DUQUE
Facultad de Ciencias, Escuela de Biología, Universidad Industrial
de Santander, 678 Bucaramanga, Colombia. jdiaz@ciencias.uis.edu.co
Instituto Amazónico de Investigaciones-Imani, Universidad Nacional de Colombia, Sede Amazonia, Leticia, Amazonas - Colombia. srduquee@unal.edu.co
RESUMEN
Se estudió la abundancia y la composición de los ensambles algales asociados a Utricularia foliosa en siete plantas localizadas en la quebrada Yahuarcaca (Amazonas - Colombia). Los objetivos fueron determinar los ensambles algales dentro del microecosistema de U. foliosa y sus variaciones de acuerdo con las condiciones de los nutrientes. Los cambios en la riqueza y la abundancia de los ensambles estuvieron influenciados por las fluctuaciones en el nivel del agua y la concentración de PO . En los ensambles de aguas abiertas se observó la dominancia de cianobacterias heterocitadas, diatomeas y organismos de gran capacidad móvil como euglenófitos. Las condiciones del microambiente creadas por U. foliosa controlan la diversidad y las densidades algales. Esto hace muy posible que U. foliosa genere condiciones fisiológicas óptimas que favorecen una alta riqueza de especies tico-epífitas como desmidias y diatomeas perifíticas. Se forma así un microecosistema del cual obtiene más beneficios de la comunidad que de la misma estrategia de la carnivoría desarrollada por U. foliosa. Se analiza además la relación entre la composición algal y las variables físicas y químicas por medio de un análisis de correspondencia canónica distendida.
Palabras clave. Ensambles algales, planta Carnívora, DCCA.
ABSTRACT
Abundance and composition of the algal assemblages associated with Utricularia foliosa were studied at seven plants located in Yahuarcaca creek (Colombian Amazon). The aim of this work was to determine the algal assemblages inside of the microecosystem of U. foliosa and how it varies according to nutrient conditions. The changes in the abundance and richness of phytoplankton of the assemblages are strongly influenced by the water level fluctuations and the PO concentration. The algal assemblages of open waters were dominate by heterocytic Cyanobacteria, diatoms and organism of great mobility capacity such as Euglenoids. The conditions of microenvironments created by U. foliosa exert some control over the algal diversity and density. It is possible that U. foliosa generates optimal physiological conditions that favor a higher richness of thychoepiphytic species such as Desmids and periphytic diatoms. Thus, forming a microecosystems from which most benefits are product of this algal community than from the carnivory strategic itself developed by U. foliosa. The relationships between the algal composition and physical and chemical variables were also analyzed by a Detrended Canonical Correspondence Analysis.
Key words. Algal assemblages, Carnivorous plant, ACCD.
Recibido: 17/08/2007
Aceptado: 24/09/2009
INTRODUCCIÓN
En la Amazonia colombiana se vienen realizando varios trabajos en torno de la ecología de una planta acuática carnívora (Utricularia foliosa L.), que por su capacidad de carnivoría ha desarrollado mecanismos especiales para su supervivencia (Guisande et al. 2000, 2004, Manjares-Hernández et al. 2006) y para establecer relaciones con algunas comunidades como el fitoplancton, el fitoperifiton (Díaz-Olarte et al. 2007), el zooplancton y los macroinvertebrados (Sanabria-Aranda et al. 2006).
En el caso del fitoplancton, los ambientes complejos y heterogéneos con una gran variedad de rasgos físicos proporcionan mayor cantidad de microhábitats (Reed 1978), donde la interacción entre fitoplancton y herbívoros es importante en la determinación de la diversidad y la composición de las comunidades fitoplanctónicas (Porter 1977). Es de esperar que U. foliosa ofrezca variadas oportunidades a estas comunidades algales. Bosserman (1983) fue el primero en proponer que Utricularia forma con el perifiton diversos ensambles de organismos acuáticos, que son indiscutiblemente considerados como microecosistemas. La importancia de la interacción Utricularia y perifiton ha sido reconocida en varios trabajos (Ulanowicz 1995, Jones et al. 1999, Richards 2001, Manjarrés-Hernández et al. 2006, Sanabria-Aranda et al. 2006, Díaz-Olarte et al. 2007).
Las macrófitas sumergidas forman microhábitats que son preferidos por macroinvertebrados pastoreadores y microcrustáceos, más que aquellas que son flotantes-libres (Meyer & Strickler 1978, Balayla & Moss 2003, Meerhoff et al. 2003). Además, juegan un papel muy importante en las comunidades acuáticas, proporcionando refugio principalmente a macroinvertebrados asociados dentro de la red trófica (Bolivar 2001, Morales 2005, Duarte & Capador 2006). Esto ha sido visto con claridad en los lagos de Yahuarcaca, cercanos a la quebrada del mismo nombre (Amazonia colombiana), donde se llevó a cabo esta investigación. Se ha demostrado que esas comunidades de algas provienen del ambiente externo a la planta, y que la abundancia y la riqueza se incrementan sobre el tiempo (Richards 2001).
Las plantas del género Utricularia presentan estructuras especializadas en sus hojas llamadas utrículos, frecuentemente cubiertas con una capa de bacterias y algas epífitas, estas estructuras soportan una comunidad muy diversa de organismos (Schumacher 1960, Botta 1976, Lacoste de Díaz 1981, Richards 2001, Sirova 2003).
Utricularia foliosa es una macrófita acuática sumergida flotante-libre
(mesopleustófita, Schmidt-Mumm 1988), que crece en lagos y quebradas
amazónicas con bajos nutrientes mostrando una cobertura media de 4-18
m2 en área de superficie, en cada lugar donde crece (Guisande et al.
2004, Sanabria-Aranda et al. 2006).
Woelkerling (1976a; 1976b) observó una gran diversidad de desmidias asociadas
con Utricularia más que con otras macrófitas anfitrionas. La información
acerca de fitoplancton asociado a U. foliosa muestra que cerca del 60% de la
riqueza corresponde a las desmidias (Schumacher 1960, Lacoste de Díaz
1981). Botta (1976) encontró que las desmidias filamentosas son las más
abundantes de la comunidad estudiada. En este estudio se probó la hipótesis
de que U. foliosa juega un papel importante en la determinación de ensambles
algales, mayor que el de los factores físicos y químicos propios
de estos ambientes.
Para comprobar la hipótesis se examinó la abundancia y la composición de ensambles algales asociados a U. foliosa en plantas individuales, localizadas en diferentes áreas de la quebrada Yahuarcaca (Amazonas Colombiano). Los objetivos fueron: (i) determinar la variación estacional de la riqueza y la abundancia (durante la estación principal de crecimiento entre marzo-mayo), (ii) ver los cambios espaciales y (iii) conocer la relación entre los factores ambientales, la composición de los ensambles algales y en la distribución de los taxones individuales (dentro de los microecosistemas y en aguas abiertas).
MATERIALES Y MÉTODOS
Área de estudio. El área de estudio comprende la quebrada Yahuarcaca, que se encuentra localizada en el margen izquierdo del curso principal de inundación del río Amazonas (Colombia), ubicados dentro de una zona delimitada por las coordenadas 4º 10' Sur, 69º 57' Oeste y 4º 9' Sur, 69º 57' Oeste sobre la quebrada Yahuarcaca (Fig. 1). El sitio 1 es el más cercano al río Amazonas y el sitio 7 el más alejado.
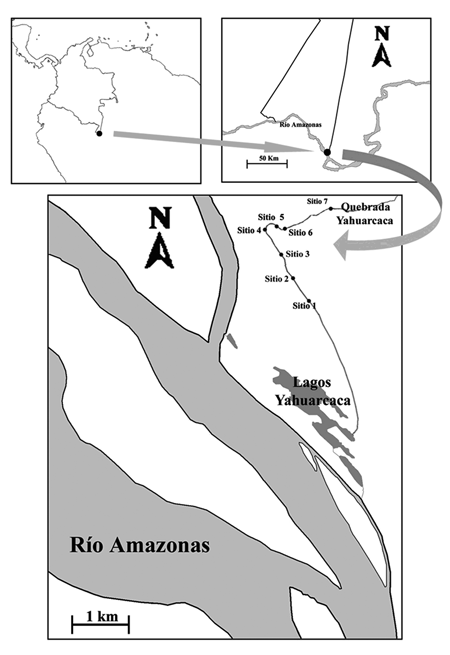
La quebrada Yahuarcaca tiene una cobertura variable de vegetación acuática, en donde predomina U. foliosa durante la estación de crecimiento (marzo-mayo), coincidentemente con el periodo de aguas en ascenso.
Muestreos. Los muestreos se realizaron en siete sitios (Fig. 1). Las muestras fueron colectadas quincenalmente desde el 21 marzo al 30 de mayo de 2005 (excepto el 2 de mayo), justo cuando el sistema de lagos de Yahuarcaca estaba conectado directamente con la quebrada Yahuarcaca como consecuencia del aumento de nivel del río Amazonas. Las variables físicas y químicas se midieron in situ a 0.5 m de profundidad alrededor de la planta (dentro del microecosistema) y por fuera en aguas abiertas (fuera del microecosistema): Transparencia con el disco Secchi, temperatura y oxígeno disuelto (YSI 55 Dissolved Oxygen & Temperature Meter), pH (YSI 60 pH Meter), conductividad (YSI 30 Portable Conductivity & Salinity Meter), así como diversos nutrientes como amonio (NH ), nitrato (NO ), nitrito (NO ), silicato (SiO ) y fosfatos (PO ), para la cual se filtró 50 ml agua con una bomba de vacío portátil (con un filtro de 0.45 µm) y se analizó con un autoanalizador BRAN + LUEBBE AAIII, en la Universidad de Vigo (España).
En cada día de muestreo se tomaron 2 muestras cuantitativas de fitoplancton, una a 0.5 metros de profundidad dentro del microecosistema de U. foliosa y otra en aguas abiertas (fuera del microecosistema) con una botella Van Dorn; la muestra se preservó en proporción 10:1 con solución de lugol concentrado. El fitoplancton se contó (abundancia) en cámaras de sedimentación por el método de Utermöhl (1958), el cual reduce el error de conteo (Lund et al. 1958). Para ello se empleó un microscopio Olympus CK2. En todos los casos, los organismos (unicelulares, filamentosos o coloniales) se contaron en 150 campos; en el caso de muestras con nuevas especies en el listado de algas, se utilizó el método de área mínima; se contaron tantos campos como fueran necesarios para establecer el número de taxones agregados por campo. Las muestras cualitativas para análisis taxonómicos se obtuvieron con una malla para plancton de 24 µm y se fijaron inmediatamente con solución de Transeau en proporción 1:1. Luego los taxones se identificaron a nivel de especie y/o subespecie. Para las determinaciones taxonómicas a nivel de especies o sub-especie se utilizaron los siguientes trabajos: Bicudo et al. (1982, 1984), Coesel (1983, 1985, 1991), Comas (1996), Croasdale et al. (1983), Duque & Donato (1994, 1995), Duque (1995), Echenique (2004), Metzeltin & Horse (1998), Tell & conforti (1986), Pestalozzi (1955), Prescott et al. (1975, 1977, 1981, 1982) y Sala et al. (2002a, 2002b).
La asociación de especies en los diferentes microecosistemas se analizó con un test de Chi-Cuadrado. La diversidad de la comunidad fitoplanctónica se estimó de acuerdo a los índices de Shannon y de equidad de Pielou, calculados según lo propuesto por Ludwig & Reynolds (1988).
Las variables abióticas se analizaron mediante la técnica de ordenación de componentes principales ACP (Legendre & Legendre 1998). Tanto el efecto de las variables ambientales en las abundancias de las especies algales, como la variación espacial y temporal en las propiedades limnológicas y los ensambles algales se analizaron con el método de ordenación DCCA (Análisis de Correspondencia Canónica Distendido) usando el programa CANOCO (ter Braak & Smilaurer 1998). Los análisis se basan en datos de abundancias de especies fitoplanctónicas y de concentraciones de las variables ambientales correspondientes. Se aplicó la transformación de Hellinger para estandarizar las abundancias de especies algales (Legendre & Gallagher 2001), y adicionalmente para disminuir el efecto de las especies raras se eliminaron las que tuvieron menos de cinco ocurrencias sobre el total de las muestras, sólo si representaban menos del 10% del total de las abundancias de la muestra (Izaguirre et al. 2004). La significancia estadística de los dos primeros ejes se estimó por el test de permutación de Monte Carlo.
RESULTADOS
Variables físicas y químicas. Las concentraciones de NO y PO fueron muy bajas en todos los sitios. Sin embargo la concentración de PO fue más alta para los sitios más influenciados por el sistema lagunar de Yahuarcaca, contrario al patrón del NO . El pH exhibió un gradiente espacial, con valores más bajos en los sitios alejados del río Amazonas, donde la concentración de ácidos húmicos es alta debido a la influencia de las aguas negras de la Quebrada Yahuarcaca (Tabla 1). No se encontraron diferencias significativas en las concentraciones de nutrientes entre el microecosistema y aguas abiertas; NH (t1, 68 = 0.32; P = 0.74), NO (t1, 68 = -1.52; P = 0.13), NO (t1, 68=- 0.18; P = 0.85), PO (t1, 68= -0.071; P = 0.94) y SiO (t1, 68= -0.23; P = 0.82).

El análisis de componentes principales (ACP) de estos parámetros muestra grandes cambios. Los dos primeros factores (Ejes) explican el 59% de la variación total de los datos, los porcentajes de varianza estimados para los ejes 1 y 2 son 34 y 24.68%, respectivamente. El primer componente tiene una correlación positiva con nitritos y silicatos, y una correlación negativa con fosfatos, transparencia y oxígeno disuelto; el segundo componente se encuentra correlacionado positivamente con nitratos y negativamente con pH y conductividad (Fig. 2).
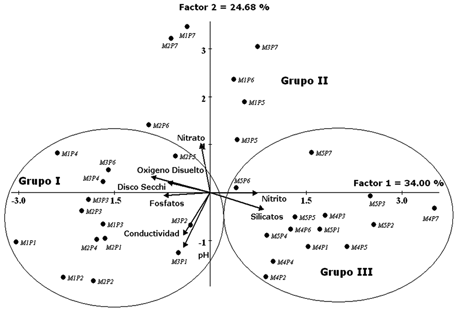
El plano de ordenación muestra la formación de tres grupos. En
el Grupo I están incluidos los sitios 1, 2, 3 y 4 de los tres primeros
muestreos (M1, M2 y M3), explicados por el fosfato, conductividad, transparencia
y oxígeno disuelto. Estos muestreos coinciden con el período de
"aguas en ascenso" cuando aumenta el nivel del Río Amazonas
incrementando la disponibilidad de nutrientes como el fosfato. En el Grupo II
están incluidas muestras de los sitios 5, 6 y 7 de los tres primeros
muestreos (M1, M2 y M3), explicados por el nitrato. Estos sitios estuvieron
influenciados por la Quebrada Yahuarcaca caracterizada por aguas negras y bajos
pH, propio de su naturaleza acida, y por reducidas concentraciones de nutrientes.
El Grupo III corresponde a las muestras de todos lo sitios en los dos últimos
muestreos (M4 y M5), explicados por el silicato y el nitrito. Estos muestreos
coinciden con el último pico de lluvias y con el fin de la estación
lluviosa, que provocan una fluctuación en el nivel del agua, en especial
de la propia quebrada Yahuarcaca (Fig. 3).

La concentración de nutrientes en la Quebrada Yahuarcaca no fue constante durante el periodo de estudio, ya que se incrementó con la entrada de las aguas del Río Amazonas y con las continuas precipitaciones sobre los lagos Yahuarcaca (muestreos 1, 2 y 3), y decreció cuando terminó la época de lluvias y disminuyó el nivel del agua (muestreo 4 y 5). Estos parámetros muestran grandes cambios temporales cuando se presentan fluctuaciones en el nivel del agua.
Fitoplancton. Entre especies y variedades se identificaron 169 taxa distribuidos en 7 grupos algales principales (Tabla 2 y Tabla 3). Las mayores abundancias relativas tanto para el microecosistema como para aguas abiertas correspondieron a Cyanophyceae, Zygnemaphyceae, Bacillariophyceae, Coscinodiscophyceae, Chlorophyceae y Euglenophyceae (Fig. 4).
Tabla 2. Lista de especies para los grupos de Cyanophyecae, Coscinodicophyceae, Bacillariophyceae, Euglenophyceae encontradas en el estudio del fitoplancton dentro del microecosistema y aguas abiertas (Etiquetas y numero al final, usadas en el ACCD).
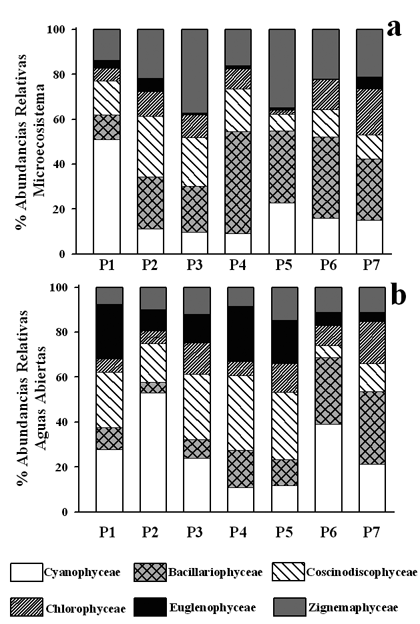
La composición de los ensambles algales se caracterizó en los primeros muestreos por la dominancia consecutiva de algunas diatomeas pennadas perifíticas o bénticas como Eunotia glacialis Meist., Actinella sp1, Navicula phyllepta Kütz., Asterionella sp.1, Navicula cryptocephala Kütz. y Frustulia saxonica Raben.; por diatomeas centrales estrictamente planctónicas como Aulacoseira granulata var.granulata (Ehr.) Sim. y A. granulata var. angustissima (Müll.) Sim.; por cianófitas representadas por organismos filamentosos heterocitados como Anabaena sp1 y Anabaena sp 2; por cloroficeas como Monorhapidium komarkovae Nyga.; por Zygnemafíceas filamentosas como Mougeotia sp.1; y por la Desmidia filamentosa Hyalotheca dissiliens var. dissiliens (Bréd.) Ralfs. Esta flora constituye cerca del 70 % de la abundancia del fitoplancton durante el estudio en los tres primeros muestreos. En los dos últimos muestreos cambió la dominancia a Cianófitos y Euglenófitos (Phacus margaritatus Pochm., Euglena sp. 2 y Phacus triqueter Duj.).
Las algas verde-azules y las diatomeas dominaron en abundancia, mientras que
los Euglenófitos, las Desmidias y otros grupos de Zygnemafíceas
mostraron altos valores de riqueza específica. El número de especies
por grupos fue: Zygnemaphyceae 77 especies, Bacillariophyceae 28 especies, Euglenophyceae
27 especies, Chlorophyceae 22 especies, Cyanophyceae 7 especies, Coscinodiscophyceae
5 especies. Las desmidias y las diatomeas contribuyeron con un alto número
de especies asociadas a macrófitas, de hábitos perifíticos,
bénticos o ticoplanctónicos. Asimismo la riqueza específica
se caracterizó por altos picos dentro del microecosistema debido al incremento
en el número de especies de desmidias.
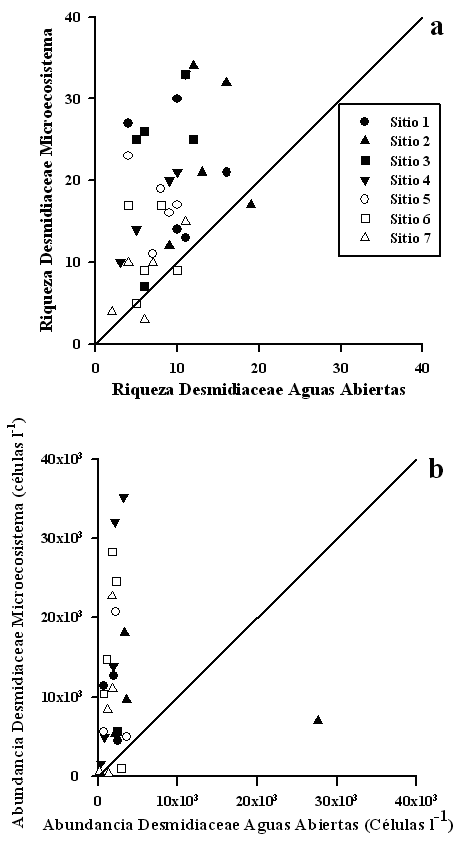
La riqueza de especies en el microecosistema con respecto a la de aguas abiertas,
presentó diferencias significativas para Desmidiaceae (?2 = 15.7, P <
0.01; Fig. 5a) y Euglenophyceae (?2 = 14.88, P < 0.01;
Fig. 6a). Igualmente la abundancia tanto para Desmidiaceae
(?2 = 1387.7, P < 0.01; Fig. 5b) cómo para
Euglenophyceae (?2 = 851.6, P < 0.01; Fig. 6b) presentó
diferencias significativas en el número de individuos entre el microecosistema
y aguas abiertas. La diversidad en el microecosistema no respondió linealmente
al incremento en el número de organismos (r2= 0.165, p>0.1), lo que
hace pensar que la planta crea un ambiente específico que favorece algunos
ensambles algales. Por su parte, la diversidad en aguas abiertas, muestra un
patrón lineal con respecto al número de organismos (r2= 0.28,
p<0.001). La equidad en cambio, es lineal tanto para el microecosistema como
aguas abiertas (Fig. 7).


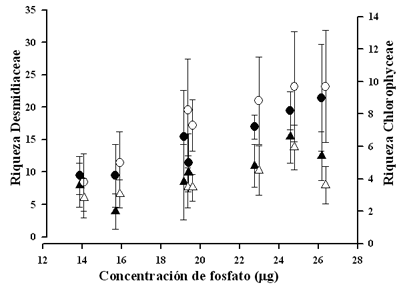
Cuando las concentraciones de nutrientes aumentaron, la abundancia y riqueza del fitoplancton fue alta, lo que corresponde a las respuestas de los ensambles a esta condición. Las riquezas de las Desmidiaceae y de las Chlorophyceae se vieron influenciadas por la concentración de los fosfatos (Fig. 8). Los valores bajos en riqueza se observan al final de la estación de crecimiento de U. foliosa, como resultado de la disminución de especies ticoplanctónicas, ya que la salida del flujo de agua produce cambios en las características físicas y químicas y en el nivel del agua, así como fluctuaciones en la abundancia y la riqueza en los ensambles de fitoplancton.
Análisis de Correspondencia Canónica Distendido. El resumen estadístico de los DCCA se muestra en la Tabla 4. Los ejes 1, 2 y 3 evaluados con el test de Monte Carlo con 999 permutaciones, son altamente significativos (P< 0.01) para los dos DCCA.
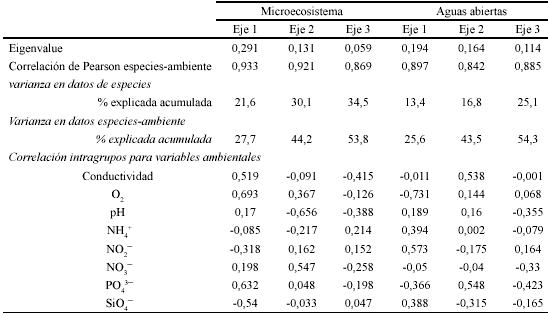
En el DCCA para el microecosistema, la varianza total explicada por la frecuencia especie-ambiente en los tres primeros ejes fue 53.8%. En el primer eje se encontró una fuerte correlación con el oxígeno disuelto, fosfatos y una relación inversa con el silicato, mientras el segundo eje estuvo relacionado positivamente con el nitrato y negativamente con el pH. En el DCCA para aguas abiertas la varianza total explicada en los tres primeros ejes fue de 54.3%. El primer eje estuvo correlacionado positivamente con nitrito y negativamente con oxígeno disuelto; el segundo se correlacionó con el fosfato. En la Fig. 9 se muestran los triplots con las direcciones y longitudes de los vectores de las variables ambientales.

La ordenación de los sitios basados en composición de especies (Fig. 9) muestra los ensambles característicos del microecosistema estudiado, conformados principalmente por desmidias en especial para los sitios 1, 2, 3 y 4 explicados por el pH y el fosfato. Estos ensambles se caracterizan por mayor disponibilidad de nutrientes. En los sitios 5, 6 y 7 los ensambles están formados principalmente por diatomeas y cianófitos. Estos sitios están explicados por el nitrato y por los bajos niveles de fosfatos. En aguas abiertas los ensambles están caracterizados por diatomeas, chlorococales y algunas desmidias para los sitios 1, 2, 3 y 4 explicados por el fosfato y por una alta disponibilidad de nutrientes (Fig. 9b).
Una clara separación para los muestreos 4 y 5 se explica por el amonio, los nitritos y el silicato, lo cual indica el impacto de la fluctuación del nivel de agua sobre los nutrientes como fosfatos y nitrato que afectan directamente los ensambles. En el microecosistema estos ensambles están conformados por diatomeas y desmidias (Fig. 9a), mientras en aguas abiertas los ensambles están conformados por euglenófitos (Fig. 9b).
DISCUSIÓN
Los ensambles algales contribuyen de manera importante al incremento de las tasas de colonización del perifiton en las partes sumergidas de las plantas acuáticas (Sand-Jensen & Borum 1991). Esto da origen a una compleja cadena de interacciones con el zooplancton, los macroinvertebrados y el perifiton, la cual juega un importante papel ecológico en el reciclaje de nutrientes, con una respuesta retroalimentada positivamente en ambientes oligotróficos (Ulanowicz 1995, Sanabria-Aranda et al. 2006, Díaz-Olarte et al. 2007). Los resultados de este estudio muestran que la riqueza de los ensambles algales conformados principalmente por desmidias dentro del microecosistema de U. foliosa está fuertemente influenciada por los cambios en la concentración de PO (Fig. 8), sugiriendo además que la asociación Utricularia- perifiton, derivada desde el ambiente externo, no es solamente incidental, es decir existe y es evidente una interacción directa de la planta y las algas (Richards 2001).
Algunos autores señalan que los cambios en la composición de los ensambles algales asociados a macrófitos se dan principalmente por especies ticoepífitas en asociación con cambios en la fluctuación del nivel de agua (Izaguirre & Vinocur 1994, Tesolin & Tell 1996). Parte de los ensambles presentes en el microecosistema de U. foliosa se derivan tanto de algas adheridas a la capa epifítica como de especies de vida libre que no poseen estructuras especializadas de fijación. Estos ensambles están conformados principalmente por diatomeas del perifiton y desmidias del ticoplancton. Las especies limnéticas como Aulacoseira granulata var. granulata y A. granulata var. angustissima provienen del potamoplancton. La dominancia de organismos filamentosos como Mougeotia sp.1 y Hyalotheca dissiliens var. dissiliens es explicada por su resistencia a las fluctuaciones en el nivel del agua y bajas concentraciones de nutrientes como PO y NO (Tesolin & Tell 1996).
El resumen estadístico registrado en la Tabla 3
para los tres primeros ejes, tanto para el microecosistema como para aguas abiertas,
muestra una fuerte correlación entre los ensambles algales y los factores
ambientales. El oxígeno disuelto, los fosfatos y el pH son las variables
que más influenciaron la distribución de los ensambles algales
dentro del microecosistema, mientras en aguas abiertas lo fueron el oxígeno
disuelto y los fosfatos (Fig. 9). En efecto, el gradiente
al que respondieron los ensambles algales dentro del microsistema y en aguas
abiertas fue la concentración de nutrientes (como el fosfato) en el sistema
Yahuarcaca.
La sensibilidad de los ensambles algales a la concentración de nutrientes,
especialmente fosfatos, se ha observado para otras comunidades asociadas a U.
foliosa como zooplancton, macroinvertebrados y perifiton (Englund & Harms
2003, Sanabria-Aranda et al. 2006, Díaz-Olarte et al. 2007). Kibriya
& Jones (2007) encontraron que el perifiton no fue afectado por la adición
de nutrientes como fósforo o nitrógeno, ni por la interacción
N/P, sus resultados sugieren que el perifiton es independiente de la concentración
de nutrientes y del crecimiento de la planta.
El otro factor que influenció la distribución de los ensambles algales fue el oxígeno disuelto, que presentó una correlación positiva especies-ambiente para el microecosistema, lo que implica un balance positivo en la productividad. De esta manera se crean condiciones óptimas que proporcionan microhabitats para otras especies (Reed 1978, Meerhoff et al. 2003), lo que aumenta, por ejemplo, los valores de riqueza del zooplancton (Sanabria-Aranda et al. 2006). Para aguas abiertas se encontró una correlación negativa especie-ambiente, con ensambles algales principalmente compuestos por Phacus margaritatus, Phacus Mangini y Euglena sp. 2, especies que se desarrollan mejor en cuerpos de agua con abundante materia orgánica en descomposición.
La competencia del fitoplancton es diferente con las macrófitas flotantes-libres de la que se da con las sumergidas. Las macrófitas sumergidas llegan a estar cubiertas por una capa perifítica, que les ocasiona una competencia por la luz, disponibilidad de carbono e igualmente por nutrientes disponibles en la columna de agua (Sand-Jensen & Borum 1991), lo que genera un efecto negativo sobre el crecimiento de las macrófitas sumergidas (Sand-Jensen 1977). Existe evidencia que indica que, además de la disponibilidad de nutrientes como requerimiento para los ensambles algales que colonizan las diferentes partes sumergidas de sus plantas hospederas, existen otros factores que determinan el desarrollo de la capa de perifiton (Jones et al. 1999). También se ha discutido en recientes trabajos que las relaciones mutualistas entre plantas acuáticas sumergidas y macroinvertebrados (Jones et al. 1999, Díaz-Olarte et al. 2007) favorecen el crecimiento de estas plantas acuáticas por remoción de la capa perifítica a través de la actividad del pastoreo. De igual modo, los invertebrados se ven beneficiados por la influencia nutricional ejercida por las plantas acuáticas sumergidas sobre la calidad del perifiton, aunque no se ha encontrado evidencia que estas plantas manipulen su perifiton a su propia conveniencia (Jones et al. 1999, Díaz-Olarte et al. 2007).
Richards (2001) sostiene la hipótesis de que plantas del género
Utricularia obtienen más beneficios desde los productos de la comunidad
planctónica derivada desde el ambiente externo, que de la carnivoría
misma. Algunos estudios mostraron que las altas concentraciones CO2 en el agua
generaron condiciones que permitían un rápido crecimiento de Aldrovanda
visiculosa (Droseraceae; Adamec 1997). Estos beneficios pueden originarse posiblemente
en el microambiente que rodea la planta, donde se desarrollan todas las comunidades
asociadas que, aparte de otros procesos metabólicos, ayudan a la descomposición
de materia orgánica (Richards 2001).
Se ha sugerido que algunos ensambles de algas coexisten en una asociación
en la que se establece cierto grado de interdependencia fisiológica más
que un simple epifítismo, como se observó en U. inflexa con algas
verde-azules (Wagner & Mshigeni 1986). En esta especie estudiada se encontró
que en los utrículos maduros y en el microecosistema a su alrededor se
presentan altas riquezas y abundancias de cianobacterias, por la capacidad fijadora
de nitrógeno de estos organismos (Bota 1976), lo cual apoya la idea de
las relaciones mutualistas.
Las abundancias de los principales grupos algales dentro del microecosistema (Fig. 5b) fueron mayores que en aguas abiertas (Fig. 6b), excepto para los Euglenophyceae. El zooplancton parece no mostrar contrastes en su abundancia dentro del microecosistema y en aguas abiertas, pero sí una clara diferencia en su riqueza de especies, siendo más alta dentro del microecosistema (Sanabria-Aranda et al. 2006). La diversidad de algas en el microecosistema (Fig. 7) presenta un comportamiento diferente a la de las aguas abiertas, lo que da indicios de que los ensambles algales son controlados indirectamente en estos microhábitats por el efecto de las macrófitas sobre las condiciones físicas y químicas (Meerhoff et al. 2003). A pesar de que no se han observado diferencias significativas en las variables físicas y químicas en el microecosistema y aguas abiertas, Scheffer et al. (1993) proponen la existencia de mecanismos biológicos entre macrófitas y fitoplancton para llegar a un estado estable.
Cualitativamente, Utricularia tiene una mayor riqueza de desmidias que otras macrófitas anfitrionas, hecho que se podría explicar porque este género posee mecanismos fisiológicos que podrían favorecer el desarrollo de dicho grupo de microalgas (Bota 1976, Schumacher 1960, Woelkerling 1976a, Lacoste de Díaz 1981). En U. foliosa se han encontrado densidades de desmidias siete veces mayores que en Sphagnum sp (Gough & Woelkerling 1976b) lo que indica que es un excelente hospedero. Estos ensambles de Desmidias son influenciados por el pH y la concentración de CO2, tal como lo observaron Gough & Woelkerling (1976) y Woelkerling (1976a; 1976b). Esta alta biodiversidad contrasta con las condiciones oligotróficas de lagos amazónicos, en los que se presenta limitación de nutrientes durante gran parte del año en el área de estudio.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia - Sede Amazonia, a la XUNTA de GALICIA, y la Universidad de Vigo por el apoyo financiero. Al Laboratorio de Ecología Animal de la Universidad de Vigo por el análisis de nutrientes. Los autores agradecen asimismo a la Dra. Visitación Conforti de la Universidad de Buenos Aires (Argentina) y Dra. Celia Sant'Anna del Instituto de Botánica de São Paulo (Brasil) por su ayuda en la revisión taxonómica de Euglenophyceae y Chlorophyceae y Cyanophyceae, respectivamente. A Lili Marciales del Instituto de Acuacultura de los Llanos (Unillanos) por su asesoría y oportuna colaboración en la fase de laboratorio.
LITERATURA CITADA
1. ADAMEC, L. 1997. Photosynthetic characteristics of the aquatic carnivorous
plant Aldrovanda vesiculosa. Aquatic Botany 59: 297-306.
2. BALAYLA, D. J. & B. MOSS. 2003. Spatial patterns and population dynamics
of plant-associated microcrustacea (cladocera) in an English shallow lake (Little
Mere, Cheshire). Aquatic Ecology 37: 417-435.
3. BICUDO, C. & I. SAMANEZ. 1984. Desmidioflórula paulista III: generos
Bambusina, Desmidium, Groenbladia, Hyalotheca, Onychonema, Phymatodocis, Spondylosium
& Teilingia. J. Cramer.
4. BICUDO, C. & L. SORMUS. 1982. Desmidioflórula paulista II: Micrasterias
C. Agardh ex Ralfs. Cramer.
5. BOLÍVAR, A. 2001. Estudio del aporte de biomasa de los macroinvertebrados
asociados a macrófitos en sistemas fluviolacustres amazónicos
(Leticia, Amazonas). Tesis Ecología, Universidad Pontificia Javeriana.
Bogotá, D.C.
6. BOSSERMAN, R. W. 1983. Elemental composition of Utricularia-periphyton ecosystems
from Okefenokee Swamp. Ecology 64: 1637-1645.
7. BOTTA, S. M. 1976. Sobre las trampas y las victimas o presas de algunas especies
argentinas del género Utricularia. Darwiniana 20: 127-154.
8. COESEL, P. 1983. De desmidiaceeën van nederland -Sieralgen-. Deel 2.
Fam. Closteriaceae. Stiching Uitgeverij koninklijke Nederlandse Naturhistorische
Verening.
9. COESEL, P. 1985. De desmidiaceeë van nederland. Dell 3 fam. Desmidiaceae
(1). Uitgeverij koninklijke Nederlandse Naturhistorische Verening.
10. COESEL, P. 1991. De desmidiaceeën van Nederland. Deel 4 Fam. Desmidiaceae
(2). Stichting Uitgeverij koninklijke Nederlandse Natuurhistorische Vereniging.
11. COMAS, A. 1996. Las Chlorococcales dulciacuícolas de Cuba. J. Cramer.
12. CROASDALE, H., C. BICUDO & G. PRESCOTT. 1983. A synopsis of North American
Desmids. Part II. Desmidiaceae: Placodermae. Section 5. University of Nebraska
Press.
13. DÍAZ-OLARTE, J., V. VALOYES-VALOIS, C. GUISANDE, N. TORRES, A. GONZÁLEZ-BERMÚDEZ,
L. SANABRIA-ARANDA, A. MANJARRÉS- HERNÁNDEZ, S. DUQUE, L. MARCIALES
& M. NUÑEZ-AVELLANEDA. 2007. Periphyton and phytoplankton associated
with the tropical carnivorous plant Utricularia foliosa. Aquatic Botany 87:285-291.
14. DUARTE, Y. & R. CAPADOR. 2006. Entomofauna acuática asociadada
a Paspalum repens (Poacea) en los lagos I y IV del sistema lagunar Yahuarcaca
(Leticia - Amazonas). Universidad Pedagógica Nacional, Facultad de Ciencia
y tecnología, Departamento de Biología, Bogotá, D.C.
15. DUQUE, S. R. & J. CH. DONATO. 1994. Primeros registros de Closterium
(Desmidiaceae, Zygophyceae) en lagos de la orilla colombiana del río
Amazonas. Rev. Acad. Col. Cienc. 19 (73): 259-264.
16. DUQUE, S. R. & J.CH. DONATO. 1995. Primeros registros de desmidias filamentosas
(Zygophyceae) en lagos de la orilla colombiana del río Amazonas. Boletín
Ecotrópica 29. 1-10.
17. DUQUE, S. R. 1995. Euglenofitas pigmentadas de la Amazonia Colombiana. Rev.
Acad. Colomb. Cienc. 19 (75): 651-659.
18. ECHENIQUE, R., NUÑEZ-AVELLANEDA M. & S. R. DUQUE. 2004. Chlorococcales
de la Amazonia colombiana I: Chlorellaceae y Scenedesmaceae. Caldasia 26 (1):
37-51.
19. ENGLUND, G. & S. HARMS. 2003. Effects of light and microcrustacean prey
on growth and investment in carnivory in Utricularia vulgaris. Freshwater Biology
48: 786-794.
20. GOUGH, S. B. & W. WOELKERLING. 1976. Wisconsin Desmids. II. Aufwuchs
and plankton communities of selected soft water lakes, hard water lakes and
calcareous spring ponds. Hydrobiologia 49: 3-25.
21. GUISANDE, C., C. ANDRADE-SOSSA, C. GRANADO-LORENCIO, S. R. DUQUE, &
M. NÚÑEZ-AVELLANEDA. 2000. Effects of zooplankton and conductivity
on tropical Utricularia foliosa investment in carnivory. Aquatic Ecology 34:
137-142.
22. GUISANDE, C., N. ARANGUREN, C. ANDRADE-SOSSA, N. PRAT, C. GRANADO-LORENCIO,
M. BARRIOS, A. BOLIVAR, M. NÚÑEZ-AVELLANEDA & S. R. DUQUE.
2004. Relative balance of the cost and benefit associated with carnivory in
the tropical Utricularia foliosa. Aquatic Botany 80: 271-282.
23. IZAGUIRRE, I., I. O´FARREL, F. UNREIN, R. SINISTRO, M. DOS SANTOS
AFONSO & G. TELL. 2004. Algal assemblages across a wetland, from a shallow
lake to relictual oxbow lakes (Lower Paraná River, South America). Hydrobiologia
511: 25-36.
24. IZAGUIRRE, I. & A. VINOCUR. 1994. Algal assemblages from shallow lakes
of the Salado river basin (Argentina). Hydrobiologia 289: 57-64.
25. JONES, J. I., J. O. YOUNG, G. M. HAYNES, B. MOSS, W. EATON, & K. J.
HARDWICK. 1999. Do submerged aquatic plants influence their periphyton to enhance
the growth and reproduction of invertebrate mutualists?. Oecologia 120: 463-474.
26. KIBRIYA, S. & I. JONES. 2007. Nutrient availability and the carnivorous
habit in Utricularia vulgaris. Freshwater Biology 52: 500-509.
27. LACOSTE DE DIAZ, E. L. 1981. Desmidiaceae en Utricularia foliosa L. Lilloa
35 (3): 67-83.
28. LEGENDRE, P. & L. LEGENDRE. 1998. Numerical Ecology. Developments in
Environmental Modelling 20. Elsevier.
29. LEGENDRE, P. & E.GALLAGHER. 2001. Ecologically meaningful transformations
for ordination of species data. Oecologia 129: 271-280.
30. LUDWIG, J. A. & J. F. REYNOLDS. 1988. Statistical Ecology. A primer
on methods and computing. John Wiley & Sons, Nueva York.
31. LUND, J. W., C. KIPLING & E. D. LE CREEN. 1958. The inverted microscope
method of estimating algal number and the statistical basis of estimations by
counting. Hydrobiologia 11: 143-170.
32. MANJARRÉS-HERNÁNDEZ, A., C. GUISANDE, N. N. TORRES, V. VALOYES-VALOIS,
A. GONZÁLEZ-BERMÚDEZ, J. DÍAZ-OLARTE, L. SANABRIA-ARANDA
& S. R. DUQUE. 2006. Temporal and spatial change of the investment in carnivory
of the tropical Utricularia foliosa. Aquatic Botany 85: 212-218.
33. MEERHOFF, M., N. MAZZEO, B. MOSS & L. RODRÍGEZ-GALLEGO. 2003.
The structuring role of free-floating versus submerged plants in a subtropical
shallow lake. Aquatic Ecology 37: 377-391.
34. METZELTIN, D. & L. HORSE. 1998. Tropical diatoms of South America I.
Koeltz Scientific Books.
35. MEYER, D. G. & J. R. STRICKLER. 1978. Morphological and behavioural
interactions between a carnivorous aquatic plant (Utricularia vulgaris L.) and
a chydorid cladoceran (Chydorus sphaericus O.F.M.). Verhandlungen der Internationalen
Vereinigung für Limnologie 20: 2490-2495.
36. MORALES, J. 2005. Relación entre el gradiente de crecimiento de Paspalum
repens (Poacea) y la estructura de la comunidad e insectos en un lago amazónico.
Tesis grado, Universidad de los Andes, Bogotá, D.C.
37. PESTALOZZI, H. G. 1955. Das phytoplankton des sübwassers, Systematik
und biologie 4. Teil. Euglenophyceen X. Klasse: Euglenophyceae. Stuttgart.
38. PORTER, K. G. 1977. The plant-animal interface in freshwater ecosystems.
American Scientist 65:159-170.
39. PRESCOTT, G.W., H. CROASDALE & W. C. VINYARD. 1975. A synopsis of North
American desmids. Part II. Desmidiaceae: Placoderme, section 1. University of
Nebraska Press.
40. PRESCOTT, G.W., H. T. CROASDALE & W. C. VINYARD. 1977. A synopsis of
North American desmids. Part II. Desmidiaceae: Placoderme, section 2. University
of Nebraska Press.
41. PRESCOTT, G.W., H. CROASDALE, W. C.VINYARD & C. E. BICUDO. 1981. A synopsis
of North American desmids. Part II: Desmidiaceae: Placoderme, section 3. University
of Nebraska Press.
42. PRESCOTT, G.W., C. E. BICUDO & W. C.VINYARD. 1982. A synopsis of north
American desmids Part II. Desmidiaceae: Placoderme, Section 4. University of
Nebraska Press.
43. REED, C. 1978. Species diversity in aquatic microecosystems. Ecology 59:
481-488.
44. RICHARDS, J. H. 2001. Bladder function in Utricularia purpurea (Lentibulariacea):
is carnivory important ? American Journal of Botany 88: 170-176.
45. SALA, S. E., S. R. DUQUE, M. NÚÑEZ-AVELLANEDA & A. A.
LAMARO. 2002a. Diatoms from the Colombian Amazon: some species of the genus
Eunotia (Bacillariophyceae). Acta Amazónica 32(4):123-132.
46. SALA, S. E., S. R. DUQUE, M. NÚÑEZ-AVELLANEDA & A. A.
LAMARO. 2002b. Diatoms from the Colombian Amazon. Cryptogamie Algologie 23(1):75-99.
47. SANABRIA-ARANDA, L., A. GONZÁLEZ-BERMÚDEZ, N. TORRES, C. GUISANDE,
A. MANJARRÉS-HERNÁNDEZ, V. VALOYES-VALOIS, J. J. DÍAZ-OLARTE,
C. ANDRADE-SOSSA, & S. R. DUQUE. 2006. Predation by the tropical plant Utricularia
foliosa. Freshwater Biology 51: 1999-2008.
48. SAND-JENSEN, K. & J. BORUM. 1991. Interactions among phytoplankton,
periphyton and macrophytes in temperate freshwaters and estuaries. Aquatic Botany
41: 137-175.
49. SAND-JENSEN, K. 1977. Effects of epiphytes on eelgrass photosynthesis. Aquatic
Botany 3: 55-63.
50. SCHMIDT-MUMM, U. 1988. Notas sobre la vegetación acuática
de Colombia, II: Fisonomía. Revista Facultad de Ciencias Universidad
Javeriana 3: 85-119.
51. SCHUMACHER, G. 1960. Further notes on the occurrence of desmids in Utricularia
Bladders. Castanea 25: 62-65.
52. SHEFFER, M., S. H. HOSPER, M. L. MEIJER, B. MOSS & E. JEPPESEN. 1993.
Alternative equilibria in shallow lakes. Trends in Ecology and Evolution 8:
275-279.
53. SIROVA, D., L. ADAMEC, & J. VRBA. 2003. Enzymatic activities in traps
of four aquatic species of the carnivorous genera Utricularia. New Phytologist
159: 669-675.
54. Tell, G., & V. Conforti. 1986. Euglenophyta pigmentadas de la Argentina.
Berlin-Stuttgart. Ed. Cramer Bibl. Phycol. 75.
55. TER BRAAK, C. J. & P. SMILAUER. 1998. CANOCO Version 4.0, Software for
Canonical Community Ordination. Microcomputer Power Ithaca, New York.
56. TESOLÍN, G. & G. TELL. 1996. The epiphytic algae on floating
macrophytes of a Paraná river floodplain lake. Hydrobiologia 333: 111-120.
57. UTERMÖHL, H. 1958. Zur Vervollkommnung der quantitativen Phytoplankton-Methodik.
Mitteilungen der Internationale Verhandlungen für Limnologie 9: 1-38.
58. ULANOWICZ, R. 1995. Utricularia´s secret: the advantage of positive
feedback in oligotrophic environments. Ecological Modelling 79: 49-57.
59. WAGNER, G., & K. MSHIGENI. 1986. The Utricularia-Cyanophyta association
and its nitrogen-fixing capacity. Hydrobiologia 141: 255-261.
60. WOELKERLING, W. J. 1976a. Wisconsin Desmids. I: Aufwuchs and plankton communities
of selected acid bogs alkaline bogs, and closed bogs. Hydrobiologia 48: 209-232.
61. WOELKERLING, W. & S. GOUGH. 1976b. Wisconsin Desmids. III: Desmid community
composition and distribution in relation to lake type and water chemistry. Hydrobiologia:
51:3-32.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2009 Caldasia

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cual estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).

























