Aislamiento y caracterización de cepas de Bacillus spp. con actividad contra Tetranychus urticae Koch en cultivos comerciales de rosas
Isolation and characterization of strains of Bacillus spp. With activity against Tetranychus urticae Koch in commercial crops of roses
DOI:
https://doi.org/10.15446/rev.colomb.biote.v17n2.54291Palabras clave:
Citohistoquímica, Efectores Biocatalíticos (EBc©), foco de infección, control biológico, agrosistemas, Citohistochemistry, Biocatalytic Effectors (EBc©), source of infection, biological contro, agrosystems (es)Título en ingles: Aislamiento y caracterización de cepas de Bacillus spp. con actividad contra Tetranychus urticae Koch en cultivos comerciales de rosas
Una de las especies de ácaros que producen considerables pérdidas cualitativas y cuantitativas en el cultivo de rosas bajo invernadero en Ecuador es Tetranychus urticae, donde el control con agroquímicos convencionales no es efectivo; por lo cual se busca identificar cepas de Bacillus spp. aisladas a partir de T. urticae y determinar sus escenarios anatómicos patogénicos para un futuro control con bacterias. La fase de campo se realizó en la florícola Naranjo Roses S.A. en Latacunga en un cultivo de rosas bajo condiciones orgánicas, en donde se recolectaron hojas de cada tercio de seis plantas con presencia de T. urticae Koch. Las muestras fueron trasladadas para ser procesadas en Plantsphere Laboratories (PSL) en Quito. Se identificaron y cuantificaron los diferentes estadios de la plaga y se aislaron algunos individuos para determinar la presencia de cepas patogénicas de Bacillus spp., las cuales fueron aisladas, purificadas e identificadas. Los tratamientos de verificación patogénica fueron las cepas, agua destilada (testigo) y Bacillus thuringiensis biovar acari (testigo positivo). Los eventos patogénicos se evaluaron en hembras adultas de T. urticae mediante citohistoquímica, por medio de la cual se reportó ruptura de paredes externas, precipitación de contenido celular y malformaciones cuticulares. Se determinó que el mayor número de individuos plaga se localizan en el tercio bajo (59,4%) con mayor presencia de huevos (63,3%). Mediante análisis de componentes principales (ACP) de los tratamientos, se determinó las cepas más eficientes como Efectores Biocatalíticos (EBc©)siendo estas la PSL 104, 113, 114 y Bacillus thuringiensis biovar acari.
One of the species of mites that cause considerable qualitative and quantitative losses in roses growing under greenhouses in Ecuador is Tetranychus urticae, where conventional agrochemicals control is not effective; therefore seeks to identify strains of Bacillus spp. Isolated from T. urticae and determine their anatomical pathogenic scenarios for future control with bacteria. The field phase took place in Naranjo Roses S.A. in Latacunga in a growing roses under organic conditions, where they were collected sheets of each third of six plants with presence of T. urticae Koch. The samples were taken to be processed in Plantsphere Laboratories (PSL) in Quito. They were identified and quantified the different stages of the pest and some individuals were isolated for the presence of pathogenic strains of Bacillus spp., which were isolated, purified and identified. Check treatments of pathogenic were strains, distilled water (control) and Bacillus thuringiensis biovar acari(positive control). Pathogenic events were evaluated in adult females of T. urticae by citohistochemistry, where breakout of the outer walls, precipitation of cell contents and cuticular malformations were reported. It was determined that the largest numbers of pest individuals are located in the lower third (59.4%) with greater presence of eggs (63.3%). Using principal component analysis (PCA) of the treatments, the PSL 104, 113, 114 and Bacillus thuringiensis biovar acari was determined as the most efficient Biocatalytic Effectors (EBc©).
Key words: citohistochemistry, Biocatalytic Effectors (EBc©), source of infection, biological control, agrosystems.
DOI: https://doi.org/10.15446/rev.colomb.biote.v17n2.54291
ARTÍCULO CORTO
Aislamiento y caracterización de cepas de Bacillus spp. con actividad contra Tetranychus urticae Koch en cultivos comerciales de rosas
Isolation and characterization of strains of Bacillus spp. With activity against Tetranychus urticae Koch in commercial crops of roses
Isabel Larrea Izurieta*, Carlos Falconí Borja**, Andrea Arcos Andrade***
* Agrobiotecnologa, Escuela de Biología Aplicada, Facultad de Ciencias Médicas de la Salud y la Vida, Universidad Internacional del Ecuador, Collacoto - Quito, Ecuador; y Responsable de laboratorio, Plantsphere Laboratories, Bellavista de Carretas - Quito, Ecuador. marisa.larrea@hotmail.com
** Doctor en Ciencias Naturales, Gerente General, Plantshphere Laboratories, Bellavista de Carretas - Quito, Ecuador. drfalconi-labs@biosftware.de
*** Ingeniera Biotecnóloga, Docente Escuela de Biología Aplicada, Facultad de Ciencias Médicas de la Salud y la Vida, Universidad Internacional del Ecuador, Collacoto - Quito, Ecuador. aarcos.47@gmail.com
Recibido: enero 24 de 2015 Aprobado: octubre 30 de 2015
Resumen
Una de las especies de ácaros que producen considerables pérdidas cualitativas y cuantitativas en el cultivo de rosas bajo invernadero en Ecuador es Tetranychus urticae, donde el control con agroquímicos convencionales no es efectivo; por lo cual se busca identificar cepas de Bacillus spp. aisladas a partir de T. urticae y determinar sus escenarios anatómicos patogénicos para un futuro control con bacterias. La fase de campo se realizó en la florícola Naranjo Roses S.A. en Latacunga en un cultivo de rosas bajo condiciones orgánicas, en donde se recolectaron hojas de cada tercio de seis plantas con presencia de T. urticae Koch. Las muestras fueron trasladadas para ser procesadas en Plantsphere Laboratories (PSL) en Quito. Se identificaron y cuantificaron los diferentes estadios de la plaga y se aislaron algunos individuos para determinar la presencia de cepas patogénicas de Bacillus spp., las cuales fueron aisladas, purificadas e identificadas. Los tratamientos de verificación patogénica fueron las cepas, agua destilada (testigo) y Bacillus thuringiensis biovar acari (testigo positivo). Los eventos patogénicos se evaluaron en hembras adultas de T. urticae mediante citohistoquímica, por medio de la cual se reportó ruptura de paredes externas, precipitación de contenido celular y malformaciones cuticulares. Se determinó que el mayor número de individuos plaga se localizan en el tercio bajo (59,4%) con mayor presencia de huevos (63,3%). Mediante análisis de componentes principales (ACP) de los tratamientos, se determinó las cepas más eficientes como Efectores Biocatalíticos (EBc©) siendo estas la PSL 104, 113, 114 y Bacillus thuringiensis biovar acari.
Palabras clave: citohistoquímica, Efectores Biocatalíticos (EBc©), foco de infección, control biológico, agrosistemas.
Abstract
One of the species of mites that cause considerable qualitative and quantitative losses in roses growing under greenhouses in Ecuador is Tetranychus urticae, where conventional agrochemicals control is not effective; therefore seeks to identify strains of Bacillus spp. Isolated from T. urticae and determine their anatomical pathogenic scenarios for future control with bacteria. The field phase took place in Naranjo Roses S.A. in Latacunga in a growing roses under organic conditions, where they were collected sheets of each third of six plants with presence of T. urticae Koch. The samples were taken to be processed in Plantsphere Laboratories (PSL) in Quito. They were identified and quantified the different stages of the pest and some individuals were isolated for the presence of pathogenic strains of Bacillus spp., which were isolated, purified and identified. Check treatments of pathogenic were strains, distilled water (control) and Bacillus thuringiensis biovar acari (positive control). Pathogenic events were evaluated in adult females of T. urticae by citohistochemistry, where breakout of the outer walls, precipitation of cell contents and cuticular malformations were reported. It was determined that the largest numbers of pest individuals are located in the lower third (59.4%) with greater presence of eggs (63.3%). Using principal component analysis (PCA) of the treatments, the PSL 104, 113, 114 and Bacillus thuringiensis biovar acari was determined as the most efficient Biocatalytic Effectors (EBc©).
Key words: citohistochemistry, Biocatalytic Effectors (EBc©), source of infection, biological control, agrosystems.
Introducción
Existen aproximadamente 1500 microorganismos que poseen propiedades insecticidas, nematicidas, etc. (Niedmann y Meza, 2006). Bacillus spp., es considerado como el principal agente de control biológico o Efector Biocatalítico (EBc®), patógeno de invertebrados versátil por sus mecanismos de acción (Flores et al., 2011 y Falconí, 2013a). Este tipo de bacterias son localizadas fácilmente en el suelo, aire, agua, plantas, etc. (Veitía et al., 2003; Layton et al., 2011). Dichos microorganismos son considerados EBc© ya que actúan por medio de diversos procesos y mecanismos, en la regulación de sistemas individuales o colectivos que evidencian alteración o desequilibrio (Falconí, 2014a).
Según Expoflores (2013) Tetranychus urticae es un ácaro polífago conocido comúnmente como araña roja, en la antigüedad no era considerada una plaga de importancia económica, por la presencia de enemigos naturales los cuales mantenían el equilibrio de dicha plaga; debido al uso indiscriminado de pesticidas desde la segunda guerra mundial, dicho equilibrio empezó a desaparecer. Cerna et al. Dice que actualmente se la considera una de las especies que ocasiona mayor perjuicio en la agricultura a nivel mundial. En rosas es el más abundante causando oscurecimiento y debilitamiento en la producción de botones, en sí pérdida en la calidad de la flor, siendo en el cultivo de rosas en el Ecuador un problema recalcitrante (Rojas et al., 2011; Yánez et al., 2014).
Mediante diferentes técnicas de laboratorio se puede identificar microorganismos, por ejemplo la aplicación de tinción de Gram (Gómez, s/a) y pruebas bioquímicas que permiten determinar la localización taxonómica de microorganismos por su comportamiento metabólico (García y Silva, 2004). Mientras que, la citohistoquímica es un proceso que produce reacciones de contraste que se traducen en matices de coloración patogénica en componentes celulares y tejidos, permitiendo así identificar mediante microscopio las áreas afectadas de una muestra (Rodak, 2005; Falconí, 2014b).
Debido a que los agroquímicos convencionales para el control de ácaros no son eficientes, en este estudio se busca aislar e identificar cepas de Bacillus spp. a partir de T. urticae y evaluar sus eventos de patogenicidad en comparación a un testigo y Bacillus thuringiensis biovar acari como testigo positivo, el cual ha mostrado ser eficiente en condiciones de campo (Lozada, 2011), como potenciales Efectores Biocatalíticos (EBc®) de T. urticae.
Materiales y métodos
Área de estudio
La toma de muestras se realizó en la florícola Naranjo Roses S.A. ubicada a 0°59'46.44¨ de latitud sur y a 78°36'23.52¨ de longitud oeste en Latacunga provincia de Cotopaxi, se identificó el bloque de rosas tipo orgánico con mayor presencia de T. urticae y en el que no fue aplicado ningún tipo de acaricida. La fase de laboratorio se realizó en Plantsphere Laboratories (PSL) en Quito, provincia de Pichincha, donde se procesaron las diferentes muestras de hojas de rosas con presencia de T. urticae.
Muestreo
En el invernadero de rosas variedad Freedom, se localizaron tres focos de infección (plantas infectadas) con presencia de T. urticae y en cada uno de estos se colectaron 15 hojas de cada tercio (superior, medio y bajo). Se realizaron dos muestreos con una diferencia de 15 días. Las hojas colectadas fueron colocadas en fundas plásticas sin evacuar el aire, procurando formar volúmenes físicos de aire para afectar lo menos posible la integridad de las muestras biológicas, estas fueron cerradas y debidamente etiquetadas para ser transportadas al laboratorio (Adaptado de Falconí, 2013b).
Cuantificación e identificación de poblaciones de T. urticae
La metodología utilizada fue adaptada de Falconí (2013b). Se utilizaron cajas plásticas con tapa (6x28x18cm), cuidadosamente desinfectadas con alcohol (70%), en la base de estas se localizó papel filtro con las dimensiones de la base de la cámara, humedecido con agua destilada estéril. En cada cámara se colocaron las hojas de rosas recolectadas, direccionadas con el envés hacia abajo. Las cámaras fueron ubicadas en un lugar claro, no expuestas directamente al sol, simulando las condiciones naturales respecto a la luz en las que se localiza la plaga en campo; cada caja debidamente etiquetada con el código referente al foco de infección, tercio al que pertenecen y la fecha de recolección. Con un microscopio, a 20X y 40X se observaron cada una de las hojas, procediendo a identificar y cuantificar los diferentes estadios de los ácaros (huevo, larva, protoninfa, deutoninfa, hembra y macho) (figura 1).
A medida que se realizaba el conteo se consideró la presencia de posibles patógenos que se podían evidenciar en los ácaros, los cuales se manifestaban en forma de necrosis, tumoraciones, lisis, precipitación de fluidos, disolución de tejido.
Se prepararon 18 cajas Petri (para los dos muestreos) con medio de cultivo Papa Dextrosa Agar (PDA), como medio básico, en los cuales se colocaron 20 ácaros debidamente distribuidos, se utilizó una caja Petri por cada cámara húmeda. Durante el periodo de incubación en las cámaras húmedas en ciclos de 24 horas, se consideró que si un individuo presentaba algún tipo de patología debidamente verificado mediante la observación a 20X y 40X, este era aislado y colocado directamente en PDA. Debido a que no todos los individuos manifestaban algún tipo de patología, se aislaron respectivamente al azar cuatro huevos, cuatro larvas, cuatro protoninfas, cuatro deutoninfas y cuatro adultos (hembras y machos), por cada uno de los tercios. Cada caja Petri fue etiquetada con el código y la fecha de aislamiento, además en la base se escribió un código para saber el estadio: H (Huevo), L (Larva), P (Protoninfa), D (Deutoninfa), A (Hembra), M (Macho). Las cajas Petri fueron incubadas a 28°C, fueron observadas a diario durante tres días para identificar algún microorganismo con características de Bacillus.
Aislamiento e identificación de Bacillus spp.
Las cepas bacterianas fueron identificadas como "típicas de Bacillus" cuando poseían bordes irregulares, aplanados, de color blanco mate, brilloso, aspecto harinoso, ceroso, seco o cremoso. Simultáneamente eran aisladas en una nueva caja Petri con PDA para su purificación, además fueron debidamente etiquetadas con números y códigos PSL, se incubaron a 28°C y se observó a diario durante un periodo de cinco días para determinar que no hubiese contaminación. Posteriormente se realizó tinción de Gram para determinar bacterias Gram+ utilizando la metodología de Carrea (2009) y 4 pruebas bioquímicas:
- Prueba de la catalasa, adaptado de Zapata (2012) –– Cada cepa fue sembrada por estría cruzada en medio de cultivo Agar Nutritivo, se incubó a 28°C por 24 horas.
- Prueba en Agar Hierro Triple Azucar (Cuervo, 2010)
- Voges Proskauer (Aquiahuatl et al., 2012)
- Prueba de la hidrólisis del almidón (Carrera, 2009)
–– Por cada cepa se colocó en un portaobjetos codificado tres gotas de agua oxigenada (H2O2).
–– Con un palillo se tomó un poco de la colonia y se colocó en la primera gota, lo mismo se realizó para las dos gotas restantes con diferentes palillos, teniendo así tres repeticiones para comprobar la reacción.
–– La prueba fue positiva una vez que se observó la formación de burbujas debido a la producción de O2 por la actividad enzimática.
Patogenicidad
Para el desarrollo de esta fase, se adaptó la metodología de Falconí (2014b).
Cosecha de cepas de Bacillus spp.
Bajo condiciones de asepsia usando la cámara de flujo laminar, cada una de las cepas identificadas como Bacilllus spp., se sembraron en PDA por inoculación masiva incubándolas a 28 °C durante cuatro días. En botellas de vidrio de 300ml, se prepararon 100ml de Buffer fosfato con tween 80 (10ul) estériles. El PDA en el que creció cada una de las cepas fue cortado en cuadrados pequeños de aproximadamente 2 x 2 cm con ayuda de un bisturí flameado y colocados individualmente en las botellas con buffer, se agitó en el vórtex y posteriormente se filtraron, obteniendo así una solución base de cada una de las cepas.
Selección de Efectores Biocatalíticos©
La primera selección de los Efectores Biocatalíticos© fueron realizadas en cámaras húmedas (cajas Petri) en donde se colocó una hoja de rosa variedad Freedom la cual presentaba T. urticae. Se realizó tres cámaras húmedas (repeticiones) por cada una de las 15 cepas, más el testigo (agua destilada) y el tratamiento positivo con Bacillus thuringiensis biovar acari. La evaluación se la realizó mediante la observación a 20X y 40X contabilizando el número de individuos y estadios para proceder a la inoculación de cepas bacterianas aisladas y caracterizadas genéricamente. En tubos de ensayo se colocó 1ml de la solución bacteriana y con ayuda de un aspersor se procedió a impregnar de bacterias dos veces tanto en el haz como el envés de la hoja. Constantemente se controló que las cámaras húmedas conserven el 50% de humedad. Después de 8 días se observó en el microscopio (20X – 40X) si los individuos presentaban o no algún tipo de anomalía patogénica, originados por efecto de la actividad metabólica de una o más sustancias involucradas en procesos de mortalidad de la plaga (Falconí, 2013b).
Citohistoquímica
Las hojas infectadas se colocaron en un porta objetos sanitizado con alcohol al 98% y luego tratadas con tres gotas del reactivo de citohistoquimica PSL-CHQ 127, se dejó reposar a temperatura ambiente durante tres minutos, posteriormente a 20X y 40X se observaron los individuos de T. urticae. Donde en cada uno de los tratamientos se identificaron tres hembras, una por cada gota y evaluadas al microscopio (1000X). En cada una de las muestras se procuró determinar alguna alteración en la morfología externa de cada individuo, como por ejemplo disolución de paredes celulares, tejidos dañados, necrosis, etc. determinando así que áreas se encontraban más afectadas por las cepas de Bacillus spp., comparándose con las placas testigo. Las evidencias de patogenicidad se verifican con técnicas de citohistoquímica las cuales tiene como propósito visualizar tejidos, sistemas, órganos afectados por mecanismos de control bacteriano (Falconí, 2013b).
Análisis de datos
Para determinar si las diferencias entre las medias poblacionales de los grupos (superior (Ts), medio (Tm) y bajo (Tb)) son significativas o no (95% de confiabilidad), se utilizó análisis de varianza de una vía (ANOVA) y la prueba de diferencia mínima significativa (DMS) para la comparación múltiple entre las medias (95% de confiabilidad). Los datos fueron procesados empleando el paquete estadístico IBM® SPSS STATISTICS 22.0. Se determinó el análisis porcentual para determinar el número de individuos en cada tercio (superior (Ts), medio (Tm) y bajo (Tb)). Dentro de ese mismo esquema se determinó la cantidad promedio de individuos por estadio, que se presentaba en cada uno de los tercios en los focos de infección.
Se determinó el número de colonias con características de Bacillus spp. presentes en los diferentes individuos de T. urticae aislados a partir de hojas de rosas de los diferentes tercios. La tinción de Gram y pruebas bioquímicas se determinaron mediante la reacción positiva y negativa determinándose así el porcentaje de las cepas que produjeron una reacción positiva.
Se realizó un Análisis de Componente Principales (PCA) como método de síntesis y ordenación de los tratamientos que produjeron un mismo tipo o similar tipo de afección patológica en hembras adultas de T. urticae. Para esto se utilizó el programa estadístico mencionado anteriormente (IBM® SPSS STATISTICS 22.0).
Resultados y discusión
Número de individuos e identificación de estadios de T. urticae.
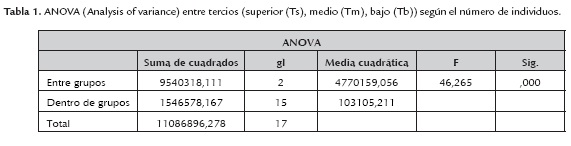
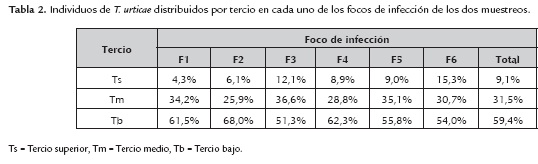
En la tabla 1 se observan los resultados obtenidos por el ANOVA (P=00) donde se comprueba que existe diferencias en el número de individuos entre cada uno de los tercios. En la tabla 2 se muestra que el número de individuos de T. urticae disminuye a medida que se alejan del sistema basal, ya que de los 21211 individuos contabilizados en los seis focos de infección, el 59,4% (12606) se encontró en el tercio inferior, lo cual es corroborado por Rojas et al. (2011) en donde localizaron una mayor infestación de la plaga en la parte baja de las plantas de rosas por la alta densidad de hojas. Además, se ha determinado que esta es una estrategia para multiplicarse y protegerse ya que se encuentran más aislados de los factores físicos, químicos del manejo cultural y agronómico del cultivo, lo cual indica que es un mecanismo de sobrevivencia de la plaga, por lo que es importante valorizar la información de los sistemas de control de ácaros (Falconí, 2013b). Estos resultados se obtuvieron en los dos muestreos que fueron realizados con una diferencia de 15 días.
En todos los tercios se encontró huevos (62,6%) de T. urticae, observándose que en proporción al desarrollo del individuo hasta llegar al estadio adulto esta va disminuyendo como lo muestra la tabla 3. Esto a causa de que el muestreo fue realizado cuando la temperatura dentro del invernadero fluctuaba entre los 22°C, el óptimo de temperatura es de 25°C para el desarrollo de T. urticae y las hembras durante su ciclo de vida (20 a 28 días) ovipositan de 100 a 120 huevos. En tanto que la relación hembras adultas a machos adultos en este estudio es de 6:1, en promedio en diferentes cultivos la relación sexual es de 3:1 (Zhang, 2003).
Presencia de colonias con características de Bacillus spp.
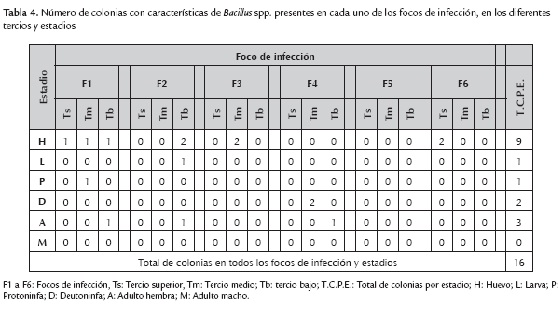
El mayor número de colonias con características de Bacillus spp. se encontraron en el estadio de huevo (9), seguido de la presencia en hembras adultas (3), deutoninfas (2) y en un solo individuo en los estadios de larva y de protoninfa, en total se determinaron 16 cepas con características morfológicas de Bacillus spp. (tabla 4), con bordes irregulares, aplanados, de color blanco mate, aspecto harinoso, ceroso, seco o cremoso al igual que las cepas de Bacillus aisladas a partir de suelo identificadas en el estudio de Carrera (2009) y Lozada (2010) quién aisló Bacillus subtilis y Bacillus sphaericus a partir de fertilizantes, con las mismas características de identificación morfológica para llegar a género y posteriormente realizaron pruebas bioquímicas para llegar a la especie. Además se demuestra en agrosistemas que la presencia numérica de los reguladores naturales tiene enorme trascendencia en el control de patógenos durante algunas estaciones de las épocas productivas (Falconí y Mendgen, 1993; Falconí y Blanco, 2001). Además se pudo observar que Bacillus se desarrolla en PDA, es así que en el estudio de Zhiqiong et al. (2013) realizan pruebas de antagonismo de Bacillus contra Fusarium oxysporum, Alternaria solani, Botrytis cinérea y Colletotrichum gloeosporioides, haciendo que tanto la bacteria como el hongo se desarrollen en el medio de cultivo mencionado para realizar sus respectivas evaluaciones; de igual manera Swain y Ray (2006) evaluaron en platos de PDA la inhibición de crecimiento in vitro de hongos colocando cepas de Bacillus subtilis aisladas a partir de estiércol de vaca.
Identificación de Bacillus spp.
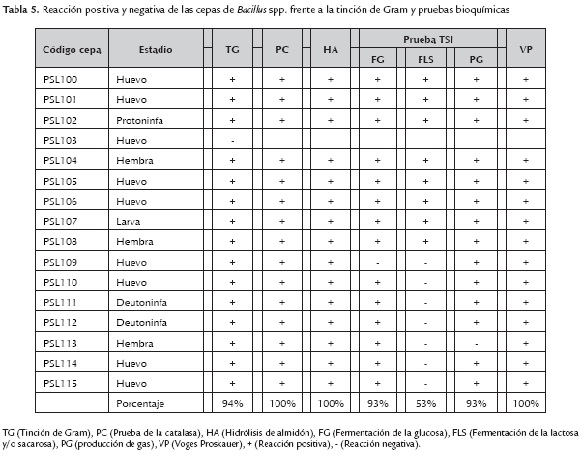
De las 16 cepas, la PSL 103 fue la única Gram-, por lo que fue descartada para realizar las pruebas bioquímicas (tabla 5), atribuible al aislamiento de una bacteria "tipo pseudomona", las cuales morfológicamente presentan bordes ligeramente irregulares, aspecto mucoide y con características de pigmentos fluorescentes (Todar, 2012), mientras que todas las demás resultaron ser bacterias Gram+. En las pruebas bioquímicas de la catalasa, hidrólisis de almidón y Voges Proskauer todas las cepas dieron positivo. En la fermentación de la glucosa, a excepción de la cepa 109, todas tuvieron una reacción positiva. Las cepas PSL 100, 101, 102, 104, 105, 106, 107 y 108 fermentan la lactosa y/o sacarosa, mientras que las cepas restantes no lo hacen y casi todas las cepas producen gas, menos la cepa PSL 113.
Patogenicidad de los diferentes tratamientos
En la tabla 6 se observa que los componentes 1 y 2 son los que mayor porcentaje de varianza acumulan (88,48%), (72,57% y 15,9% respectivamente) y los componentes 3 (9,07%) y 4 (2,45%) no se toman en cuenta para el presente análisis ya que su aporte es muy bajo.
En la figura 2 se observa que los tratamientos se agrupan conforme afectan patogénicamente al gnathosoma, prodorsum, opistosoma y/o patas en hembras adultas de T. urticae. Podemos observar que los tratamientos PSL 104 (figura 3a), PSL 113, PSL 114 y Bacillus thuringiensis biovar acari están estrechamente relacionados afectando a las 4 partes evaluadas (ganahosom, prodorsum, opistosoma y patas), las cuales pueden ser aplicadas para la trazabilidad en los procesos productivos de manejo integral del cultivo mediante técnicas moleculares (Leibinger, et al., 1997). El ingrediente activo Bacillus thuringiensis biovar acari por su contenido de substancias activas tanto bacterias como metabolitos, el efecto de control se produce por bioacumulación originando el colapso de centros nerviosos, digestivos y reproductivos reduciendo drásticamente la actividad biológica de la plaga (Biocontrol Science, 2009), incluso bajo condiciones de campo (Lozada, 2011). Mientras que PSL 107 (figura 3c) y PSL 110 se diferencian de los tratamientos anteriormente mencionados porque afectan en menor proporción al gnathosoma y prodorsum. Los tratamientos PSL 105, 115, 109, 100 y 112 están relacionados a causa de la patogenicidad en el opistosoma y patas, mientras que las cepas PSL 101, 106 y 108 afectan ligeramente a las patas, PSL 111 afecta altamente a las patas y muy poco al opistosoma y prodorsum. Finalmente los tratamientos PSL 102 y Testigo no presentan ningún tipo de patogenicidad en hembras adultas de T. urticae.
Conclusiones y recomendaciones
El efecto poblacional de T. urticae indica que el mayor número de individuos se localiza en el tercio bajo, donde la proporción sexual de T. urticae en rosas fue de seis hembras por cada macho, además se localizó una mayor cantidad de huevos (62,6%). Por lo que se recomienda que al momento de hacer la aplicación en campo, el control debe cubrir si es posible toda el área de la planta ya que siempre permanecen individuos que están lejos de ser afectados por los diferentes tipos de control.
El estudio reporta a 15 cepas de Bacillus spp. mediante caracterización morfológica y reconfirmación por Tinción de Gram y cuatro pruebas bioquímicas (Prueba de la catalasa, Hidrólisis de almidón, Prueba TSI y Voges Proskauer) en la cuales se obtuvieron resultados positivos para determinar el género Bacillus. Se recomienda aplicar la metodología de tinción de endosporas, ya que la presencia de estas es otra de las características fundamentales del género mencionado; existen varias técnicas, el método más empleado es el de Schaeffer Fulton con la utilización de verde malaquita. Además, se recomienda realizar pruebas bioquímicas específicas para determinar la especie de Bacillus con la que se está trabajando, o mediante la aplicación de técnicas moleculares.
Debido a que el muestreo fue realizado en una sola época en donde la temperatura fluctuaba entre los 22°C, se recomienda evaluar la presencia de las cepas bacterianas detectadas en el transcurso de periodos climatológicos extremos caracterizados por condiciones de deltas con afección a plantas y organismos en general.
Mediante la técnica de citohistoquímica se pudo evaluar escenarios anatómicos patogénicos de Bacillus spp. causados en hembras de Tetranychus urticae, en los cuales se observó ruptura de las paredes externas, precipitación de contenido celular, entre otras, siendo las cepas PSL 104, 113 y 114 las mejores ya que actuaron de igual manera que el tratamientos de control positivo con Bacillus thuringiensis biovar acari, señalando de esta forma la existencia de reguladores naturales bajo condiciones de alta intensidad agronómica del cultivo de rosas, lo cual demuestra ser eficiente para irrumpir sitios vitales de la plaga, reduciendo el daño que este produce al cultivo. Es importante establecer estudios similares en función de la búsqueda de escenarios de la variabilidad bacteriana del género Bacillus para ampliar el espectro de mecanismos y modos de acción destinado al control de importantes plagas agrícolas y en función del ciclo. Se recomienda hacer pruebas en campo de las cepas que se evidenciaron como las más letales en laboratorio y determinar su efectividad en programas de manejo de fincas de flores en control biológico.
Realizar la extracción de ingredientes activos bacterianos de las cepas más eficientes, en tanto que uno de los principales componentes en los acaricidas son los metabolitos microbianos de Bacillusthuringiensis biovar acari.
Agradecimientos
A Plantsphere Laboratories (PSL) por el apoyo en conocimiento y económico brindado durante toda la investigación y a la florícola Naranjo Roses S.A. por permitirnos el acceso a la misma para realizar los muestreos y proporcionarnos la información necesaria.
Referencias
Aquiahuatl, M., Volke, T., Prado, L., Shirai, K., Ramírez, F. y Salazar, M. (2012). Manual de prácticas de laboratorio microbiología general. División de Ciencias Biológicas y de la Salud. Universidad Autónoma Metropolitana. Unidad Iztapalapa. México D.F. pp. 78.
Biocontrol Science. (2009). Ficha técnica BIOSAN, acaricida - insecticida, ingrediente activo Bacillus thuringiensis biovar acari. Producto con la garantía del Departamento de Agricultura y Tecnología BIOSOFTWARE (Alemania). Distribuido por BioCiencia (BC) pp. 6.
Carrera, M. (2009). Producción de Bacillus thuringiensis, Berliner a nivel de laboratorio. Escuela de Bioquímica y Farmacia. Facultad de Ciencias. ESPOCH. Riobamba - Ecuador. pp. 87.
Cerna, E., Landeros, J., Ochoa, Y., Luna, J., Vázquez, M. y Ventura, O. (2009). Tolerancia de ácaro Tetranychus urticae Koch a cuatro acaricidas de diferente grupo toxicológico. Investigación y Ciencia. 44, 4-10.
Cuervo, J. (2010). Aislamiento y caracterización de Bacillus spp. como fijadores biológicos de nitrógeno y solubilizadores de fosfatos en dos muestras de biofertilizantes comerciales. Pontificia Universidad Javeriana. Facultad de Ciencias Básicas. Carreara de Microbiología Agrícola y Veterinaria. Bogotá - Colombia. pp. 28.
Expoflores. (2013). Ensayo de una alternatia para el control de ácaros (Tetranichus urticae) en rosas en sala de poscosecha. Comisión Técnica Expoflores Flor Ecuador. Recuperado el 18 de junio de 2014, de http://expofloresflorecuador.blogspot.com/2013/04/ensayo-de-una-alternativa-para-el.html.
Falconí, C. y Mendgen, K. (1993). Epiphytic fungi on apple leaves and their value for control of the postharvest pathogens Botrytiscinerea, Moniliniafructigena and Penicilliumexpansum. J. Plant Dis. Prot. 101, 38.
Falconí, C. y Blanco, J. (2001). Reguladores Naturales de plagas Agrícolas. Parasitoides y predatores. CD Multimedia. BIOSOFTWARE (Alemania).
Falconí, C. (2013a). Fitopatógenos & Efectores BioCataliticos (EBc®) de cultivos del Ecuador. BIONIKA-Diseño Biocatalitico Inteligente BDKID. Department of Agriculture, Technology and Environment. Ecuador- Germany.
Falconí, C. (2013b). Protocolo No. 24472. Patología microbiana de ácaros fitopatógenos. Plantsphere Laboratories (PSL)-BIONIKA. Quito - Ecuador. pp. 2.
Falconí, C. (2014a). Comunicación personal: Efectores Biocatalíticos (EB©). Gerente General Planthsphere Laboratories (PSL). Quito-Ecuador.
Falconí-Borja, C. (2014b). Protocolo No. 24482. Protocolo de inoculación de Bacillus thutingiensis var. Aracni en Tetranychus urticae. Plantsphere Laboratories (PSL)-BIONIKA. Quito - Ecuador. pp. 4.
Flores, A., Egúsquiza, R., Alcarraz, M., Woolcott, J., Benavides, E., Godoy, J., Huerta, D., Jesús, Y. y Patiño, A. (2011). Biodiversidad de Bacillus thuringiensis aislados de agroecosistemas peruanos y evaluación del potencial bioinsecticida. Facultad de Farmacia y Bioquímica. Ciencia e Investigación. Chile. 14(1), 29-34.
García, M. y Silva, M. (2004). Manual del Técnico Superior de Laboratorio de Análisis Clínicos. Identificación bioquímica y tipado microbiológico. Unidad didáctica 55. pp. 346.
Gómez, R. s/a. Laboratorio 4: Tinción de microorganismos. Recinto Universitario de Mayaguez. Universidad de Puerto Rico. Recuperado el 5 de mayo de 2014, de http://academic.uprm.edu/∼lrios/3725/Ejercicio4.pdf.
Layton, C., Maldonado, E., Monroy, L., Corrales, L. y Sánchez, L. (2011). Bacillus spp., perspectiva de su efecto biocontrolador mediante antibiosis en cultivos afectados por fitopatógenos. Universidad Colegio Mayor de Cundinamarca. Bogotá - Colombia. pp. 177-187.
Leibinger, W., Breuker, B., Hahn, M. y Mendgen, K. (1997). Control of postharvest pathogens and colonization of the apple surface by antagonistic microorganisms in the field. Phytopathology, 87,1103-1110.
Lozada, J. (2010). Aislamiento y caracterización de Bacillus spp. como fijadores biológicos de nitrógeno y solubilizadores de fosfatos en dos muestras de biofertilizantes comerciales. Carrera de Microbilogía Agrícola y Veterinaria. Facultad de Ciencias Básicas. Pontificia Universidad Javeriana. Bogota D.C. - Colombia. pp. 35.
Lozada, A. (2011). Evaluación de productos orgánicos para el control de araña roja (Tetranychus urticae Koch) en el cultivo de fresa (Fragaria vesca). Facultad de Ingeniería Agronómica. Universidad Técnica de Ambato. Ambato - Ecuador. pp. 101.
Niedmann, L. y Meza, L. (2006). Evaluation of native strains of Bacillus thuringiensis as an alternative of integrated management of the tomato leaf miner (Tuta absoluta Meyrick; Lepidoptera: Gelechiidae) in Chile. Agricultura técnica. Chile. 66(3), 235-246.
Rodak. F. (2005). Hematología, Fundamentos y aplicaciones clínicas. Capítulo 28. 2da edición. Editorial Médica Panamericana.
Rojas, F., Torres, P., Rodríguez, D. y Cantor, F. (2011). Efecto de tres densidades de Tetranychus urticae (Acari: Tetranychidae) sobre el crecimiento de plantas de rosa. Ingeniería Agroecológica. UNIMINUTO.
Swain, M. y Ray, R. (2006). Biocontrol and other beneficial activities of Bacillus subtilis isolated from cowdung microflora. Microbiological Research, 164 (2009),121-130.
Todar, K. (2012). Pseudomonas aeruginosa. Todar's Online Textbook of Bacteriology. Wisconsin - Estados Unidos. Recuperado el 27 de septiembre de 2014, de http://textbookofbacteriology.net/pseudomonas.html.
Veitía, M., Feitó, E., Benítez, M., García, V. y Izquierdo, D. (2003). Evaluación de cepas de Bacillus thuringiensis en el control del ácaro del vaneado del bulbo Eriophys tulipae Keifer en el cultivo del ajo (Allium sativum L.). Fitosanidad, 7(2), 37-41.
Yánez, P., Escoba, A., Molina, C. y Zapata, G. (2014). Comparación de la actividad acaricida de los aceites esenciales de Ocimum basilicum, Coriandrum sativum y Thymus vulgaris contra Tetranychus urticae. La Granja: Revista de Ciencias de la Vida. 19(1), 21-33.
Zapata, S. (2012). Manual de laboratorio, microbiología de alimentos. Ingeniería en Procesos Biotecnológicos. Universidad San Francisco de Quito. pp. 87.
Zhang, Z. (2003). Mites of Green houses. Identification, biology and control. School of Life Sciences, Fudan University. CABI Publishing. China, UK, USA. pp. 256.
Zhiquiong T., Lin, B. y Zhang, R. (2013). A novel antifungal protein of Bacillus subtilis B25. SpringerPlus, 2, 543. Doi 10.1186/2193-1801-2-543.
Referencias
Aquiahuatl, M., Volke, T., Prado, L., Shirai, K., Ramírez, F. y Salazar, M. (2012). Manual de prácticas de laboratorio microbiología general. División de Ciencias Biológicas y de la Salud. Universidad Autónoma Metropolitana. Unidad Iztapalapa. México D.F. pp. 78.
Biocontrol Science. (2009). Ficha técnica BIOSAN, acaricida – insecticida, ingrediente activo Bacillus thuringiensis biovar acari. Producto con la garantía del Departamento de Agricultura y Tecnología BIOSOFTWARE (Alemania). Distribuido por BioCiencia (BC) pp. 6.
Carrera, M. (2009). Producción de Bacillus thuringiensis, Berliner a nivel de laboratorio. Escuela de Bioquímica y Farmacia. Facultad de Ciencias. ESPOCH. Riobamba – Ecuador. pp. 87.
Cerna, E., Landeros, J., Ochoa, Y., Luna, J., Vázquez, M. y Ventura, O. (2009). Tolerancia de ácaro Tetranychus urticae Koch a cuatro acaricidas de diferente grupo toxicológico. Investigación y Ciencia. 44, 4–10.
Cuervo, J. (2010). Aislamiento y caracterización de Bacillus spp. como fijadores biológicos de nitrógeno y solubilizadores de fosfatos en dos muestras de biofertilizantes comerciales. Pontificia Universidad Javeriana. Facultad de Ciencias Básicas. Carreara de Microbiología Agrícola y Veterinaria. Bogotá – Colombia. pp. 28.
Expoflores. (2013). Ensayo de una alternatia para el control de ácaros (Tetranichus urticae) en rosas en sala de poscosecha. Comisión Técnica Expoflores Flor Ecuador. Recuperado el 18 de junio de 2014, de http://expofloresflorecuador.blogspot.com/2013/04/ensayo-de-una-alternativa-para-el.html.
Falconí, C. y Mendgen, K. (1993). Epiphytic fungi on apple leaves and their value for control of the postharvest pathogens Botrytis cinerea, Monilinia fructigena and Penicillium expansum. J. Plant Dis. Prot. 101, 38.
Falconí, C. y Blanco, J. (2001). Reguladores Naturales de plagas Agrícolas. Parasitoides y predatores. CD Multimedia. BIOSOFTWARE (Alemania).
Falconí, C. (2013a). Fitopatógenos & Efectores BioCataliticos (EBc®) de cultivos del Ecuador. BIONIKA-Diseño Biocatalitico Inteligente BDKID. Department of Agriculture, Technology and Environment. Ecuador- Germany.
Falconí, C. (2013b). Protocolo No. 24472. Patología microbiana de ácaros fitopatógenos. Plantsphere Laboratories (PSL)-BIONIKA. Quito – Ecuador. pp. 2.
Falconí, C. (2014a). Comunicación personal: Efectores Biocatalíticos (EB©). Gerente General Planthsphere Laboratories (PSL). Quito-Ecuador.
Falconí-Borja, C. (2014b). Protocolo No. 24482. Protocolo de inoculación de Bacillus thutingiensis var. Aracni en Tetranychus urticae. Plantsphere Laboratories (PSL)-BIONIKA. Quito – Ecuador. pp. 4.
Flores, A., Egúsquiza, R., Alcarraz, M., Woolcott, J., Benavides, E., Godoy, J., Huerta, D., Jesús, Y. y Patiño, A. (2011). Biodiversidad de Bacillus thuringiensis aislados de agroecosistemas peruanos y evaluación del potencial bioinsecticida. Facultad de Farmacia y Bioquímica. Ciencia e Investigación. Chile. 14(1), 29-34.
García, M. y Silva, M. (2004). Manual del Técnico Superior de Laboratorio de Análisis Clínicos. Identificación bioquímica y tipado microbiológico. Unidad didáctica 55. pp. 346.
Gómez, R. s/a. Laboratorio 4: Tinción de microorganismos. Recinto Universitario de Mayaguez. Universidad de Puerto Rico. Recuperado el 5 de mayo de 2014, de http://academic.uprm.edu/~lrios/3725/Ejercicio4.pdf
Layton, C., Maldonado, E., Monroy, L., Corrales, L. y Sánchez, L. (2011). Bacillus spp., perspectiva de su efecto biocontrolador mediante antibiosis en cultivos afectados por fitopatógenos. Universidad Colegio Mayor de Cundinamarca. Bogotá – Colombia. pp. 177–187.
Leibinger, W., Breuker, B., Hahn, M. y Mendgen, K. (1997). Control of postharvest pathogens and colonization of the apple surface by antagonistic microorganisms in the field. Phytopathology, 87,1103-1110.
Lozada, J. (2010). Aislamiento y caracterización de Bacillus spp. como fijadores biológicos de nitrógeno y solubilizadores de fosfatos en dos muestras de biofertilizantes comerciales. Carrera de Microbilogía Agrícola y Veterinaria. Facultad de Ciencias Básicas. Pontificia Universidad Javeriana. Bogota D.C. – Colombia. pp. 35.
Lozada, A. (2011). Evaluación de productos orgánicos para el control de araña roja (Tetranychus urticae Koch) en el cultivo de fresa (Fragaria vesca). Facultad de Ingeniería Agronómica. Universidad Técnica de Ambato. Ambato – Ecuador. pp. 101.
Niedmann, L. y Meza, L. (2006). Evaluation of native strains of Bacillus thuringiensis as an alternative of integrated management of the tomato leaf miner (Tuta absoluta Meyrick; Lepidoptera: Gelechiidae) in Chile. Agricultura técnica. Chile. 66(3), 235-246.
Rodak. F. (2005). Hematología, Fundamentos y aplicaciones clínicas. Capítulo 28. 2da edición. Editorial Médica Panamericana.
Rojas, F., Torres, P., Rodríguez, D. y Cantor, F. (2011). Efecto de tres densidades de Tetranychus urticae (Acari: Tetranychidae) sobre el crecimiento de plantas de rosa. Ingeniería Agroecológica. UNIMINUTO.
Swain, M. y Ray, R. (2006). Biocontrol and other beneficial activities of Bacillus subtilis isolated from cowdung microflora. Microbiological Research, 164 (2009),121-130.
Todar, K. (2012). Pseudomonas aeruginosa. Todar´s Online Textbook of Bacteriology. Wisconsin – Estados Unidos. Recuperado el 27 de septiembre de 2014, de http://textbookofbacteriology.net/pseudomonas.html.
Veitía, M., Feitó, E., Benítez, M., García, V. y Izquierdo, D. (2003). Evaluación de cepas de Bacillus thuringiensis en el control del ácaro del vaneado del bulbo Eriophys tulipae Keifer en el cultivo del ajo (Allium sativum L.). Fitosanidad, 7(2), 37-41.
Yánez, P., Escoba, A., Molina, C. y Zapata, G. (2014). Comparación de la actividad acaricida de los aceites esenciales de Ocimum basilicum, Coriandrum sativum y Thymus vulgaris contra Tetranychus urticae. La Granja: Revista de Ciencias de la Vida. 19(1), 21-33.
Zapata, S. (2012). Manual de laboratorio, microbiología de alimentos. Ingeniería en Procesos Biotecnológicos. Universidad San Francisco de Quito. pp. 87.
Zhang, Z. (2003). Mites of Green houses. Identification, biology and control. School of Life Sciences, Fudan University. CABI Publishing. China, UK, USA. pp. 256.
Zhiquiong T., Lin, B. y Zhang, R. (2013). A novel antifungal protein of Bacillus subtilis B25. SpringerPlus, 2, 543. Doi 10.1186/2193-1801-2-543.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. T. A. Quiñones-Muñoz, A. M. Villares-Bueno, G. Hernández-Ramírez, R. Hernández-Martínez, M. A. Lizardi-Jiménez, V. Bocanegra-García. (2020). Bacillus spp. characterization and his intervention as a possible non-traditional etiology of chronic renal insufficiency in Tierra Blanca, Veracruz, Mexico. Scientific Reports, 10(1) https://doi.org/10.1038/s41598-020-61313-7.
2. K Mantilla, M Suárez-Barrera, N J Rueda-Forero, O D Guarín, F R Gómez, S M Durán, L C Tiria. (2019). Characterization of biodeteriorating microorganisms in buildings in Bucaramanga, Colombia. Journal of Physics: Conference Series, 1386(1), p.012104. https://doi.org/10.1088/1742-6596/1386/1/012104.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).