Obtención de ácido cítrico a partir de suero de leche por fermentación con Aspergillus spp.
Citric acid production from whey by fermentation using Aspergillus spp.
Palabras clave:
Aspergillus carbonarius, Aspergillus niger, biorreactor, simulación, p-galactosidasa, Aspergilluscarbonarius, bioreactor, simulation, p-galactosidase. (es)|
|
||
|
Obtención de ácido cítrico a partir de suero de leche por fermentación con Aspergillus spp.
Citric acid production from whey by fermentation using
Aspergillus spp.
Óscar Julián Sánchez Toro*, María Cristina Ortiz Buriticá**, Adriana Lorenza Betancourt Garcés***
|
||
|
|
||
|
RESUMEN
El suero de leche se ha constituido en el principal desecho de la industria láctea, a pesar de los constantes esfuerzos por aprovecharlo. El presente trabajo tuvo por objeto estudiar la obtención de ácido cítrico por fermentación sumergida con hongos del género Aspergillus, utilizando lactosuero en calidad de sustrato con miras a su aprovechamiento y a la reducción del impacto ambiental que causan los vertimientos de este subproducto en los cursos de agua. Se utilizaron las siguientes cepas: A. carbonarius NRRL 368, A. carbonarius NRRL 67 y A. niger NRRL 3. Fue seleccionado el mejor medio de adaptación para la propagación del inóculo. El diseño experimental planteado para evaluar la biosíntesis de ácido cítrico a partir de suero de leche modificado mediante diferentes tratamientos, dio como resultado que las dos cepas de A. carbonarius no presentaran diferencias significativas en la formación del ácido, mientras A. niger NRRL 3 alcanzó mayores concentraciones cuando se utilizó suero de leche desproteinizado, evaporado y con lactosa hidrolizada con f>-galactosidasa. A. carbonarius arrojó concentraciones promedio de ácido cítrico mayores que las encontradas para A. niger, lo que sugiere la necesidad de profundizar en su estudio como productor potencial. Se obtuvo la cinética de crecimiento celular, consumo de sustrato y formación del ácido en un biorreactor de tanque agitado con aireación de 3 L para el caso de A. niger, la cual fue simulada mediante modelos matemáticos no estructurados.
Palabras clave: Aspergillus carbonarius, Aspergillus niger, biorreactor, simulación, p-galactosidasa.
ABSTRACT
Whey has become the main dairy-industry waste product, despite continuous efforts aimed at finding a way to use it. The aim of this research was to investigate citric acid production by submerged fermentation using Aspergillus genus fungi, using whey as substrate to take economical advantage of it and to reduce the environmental impact caused by discharging this by-product into nearby streams. The following three strains were used: A. carbonarius NRRL 368, A. carbonarius NRRL 67 and A. niger NRRL 3. The best adaptation medium for inoculum propagation was selected. Proposed experimental design for evaluating citric acid biosynthesis from whey modified through different treatments showed that the two A. carbonarius strains did not present significant differences in acid production whereas A. niger NRRL 3 reached higher concentration when evaporated, deproteinised and p-galactosidase lactose-hydrolysed whey was used. However, A. carbonarius gave higher average citric acid titres than those found for A. niger. This suggests the need for carrying out further research on it as a potential producing strain. Cell growth, substrate consumption and acid production kinetics in a 3-L stirred-tank bioreactor with aeration were developed in the case of A. niger; kinetics were simulated through non-structured mathematical models.
Key words: Aspergilluscarbonarius, Aspergillus niger, bioreactor, simulation, p-galactosidase.
INTRODUCCIÓN medio 4.9% de lactosa, 0.9% de proteína, 0.6% de
cenizas y 0.3% de grasas, entre otros componentes
El suero de leche es un líquido claro, de color amari- (Baena et al., 1994; Marwaha y Kennedy, 1988). Este llo verdoso, resultante de la coagulación de la leche subproducto se ha constituido en el principal dese-durante la elaboración del queso, y contiene en pro- cho de la industria láctea. A pesar de los constantes
|
||
|
|
||
|
Ingeniero Químico, M.Sc., Departamento de Ingeniería, Universidad de Caldas, calle 65 No. 26-10, Manizales, Colombia.
Correo electrónico: osanchez@ucaldas.edu.co
Bacterióloga, Departamento de Ciencias Biológicas, Universidad de Caldas.
Universidad Nacional de Colombia, sede Manizales.
Recibido: marzo 8 de 2004. Aceptado: abril 12 de 2004.
|
||
|
|
||
|
43
|
||
|
|
||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 43 - 54
|
|||
|
|
|||
|
esfuerzos por aprovechar el suero, la mayoría de los volúmenes producidos son vertidos directamente en los cursos de agua naturales provocando un impacto ambiental negativo debido a su elevado contenido de materia orgánica, que alcanza una DBO5 de 30.000-50.000 mg/L (Baena et al., 1994; Marwaha y Kennedy, 1988). En la actualidad, la legislación prohíbe el vertimiento directo del suero a los cursos de agua sin un tratamiento previo, que consiste principalmente en la remoción de la lactosa y las proteínas. Sin embargo, son justamente estos componentes los más valiosos en el momento de aprovechar el lactosuero como medio de cultivo para fermentaciones industriales (García et al., 1993; Moulin y Galzy, 1984).
Como medio de cultivo, el suero de leche puede suministrar las fuentes de carbono y de energía necesarias para el desarrollo de diferentes microorganismos y la producción de metabolitos de alto valor. El número de microorganismos que tienen la capacidad de asimilar la lactosa es limitado, pero al hidrolizar este disacárido y obtener glucosa y galactosa mediante un proceso enzimático empleando p-galactosidasa (lactasa), se amplían significativamente las perspectivas de aprovechamiento del suero en procesos de fermentación (García et al., 1993). Adi-cionalmente, se ha iniciado el estudio del suero de leche como medio alternativo para el cultivo de microorganismos recombinantes (Souza et al., 2001; Domingues et al., 2001).
El suero de leche ha sido utilizado para la propagación de inóculos en queserías (Huggins 1984; Lamboley et al., 1997) y la obtención de lactasa (González, 1994; Rech et al., 1999), poligalacturonasa (García et al., 1987), proteína unicelular (El-Hawary et al., 1991; Hosseini et al., 2003; Ben-Hassan y Ghaly, 1994), etanol (Domingues et al., 2001; Grba et al., 2002; Ghaly y El-Taweel, 1995) y ácidos orgánicos, entre otros productos. La producción de ácidos orgánicos representa gran interés por cuanto estos metabolitos obtenidos a partir del suero pueden ser utilizados a su vez como aditivos de origen natural en la misma industria láctea. A partir de suero de leche se ha obtenido ácido láctico (Trujillo et al., 1998; Tejayadi y Cheryan, 1995), acético (Huang y Yang, 1998; Talabardon et al., 2000), propiónico (Colomban et al., 1993; Yang et al., 1994), glucónico (Vanhuynh et al., 1986), succínico (Lee et al., 2000) y cítrico.
|
El ácido cítrico es ampliamente utilizado en la industria de alimentos, bebidas, química y farmacéutica, entre otras. Es empleado como agente acidificante y resaltador del sabor, como antioxidante para prevenir la rancidez de grasas y aceites, como amortiguador en mermeladas, y como estabilizante en gran variedad de alimentos. La industria farmacéutica emplea alrededor del 16% de la producción de este ácido. Se estima que su producción anual es de 400.000 ton para un mercado de cerca de 1.400 millones de dólares por año. Su consumo se está incrementando por lo que se continúa investigando en la implementación de nuevos procesos tecnológicos más rentables y ecológicamente limpios (Demain, 2000).
La obtención industrial de ácido cítrico se lleva a cabo empleando el hongo Aspergillus niger en medios ricos en carbohidratos como las melazas de caña y de remolacha. También se utiliza sacarosa, almidón de papa, hidrolizados de almidón y jarabes de glucosa (Vorob'eva, 1989). Se ha explorado la posibilidad de emplear levaduras para la producción de ácido cítrico en procesos por lotes (Kubicek y Röhr, 1986; Moresi, 1994; Kim y Roberts, 1991) y continuos (Klasson et al., 1989).
Uno de los microorganismos que tiene la capacidad de sintetizar ácido cítrico es el Aspergillus carbonarius según lo reportan diferentes bancos de cepas (NRRL, ATCC, CABI, DSMZ, entre otros). Este hongo recientemente ha sido investigado en la obtención de productos de aplicación industrial como poligalacturonasas (Devi y Rao, 1996) y fitasa (Al-Asheh y Duvnjak, 1995), aunque son muy pocos los trabajos publicados.
Igualmente, existen pocos reportes sobre la producción de ácido cítrico a partir de suero. Somkuti y Bencivengo (1981) realizaron ensayos en erlenmeyers, mientras Hossain et al. (1983), intentaron optimizar el proceso en biorreactores a nivel de laboratorio utilizando cepas mutantes y modificando las condiciones del cultivo sumergido. En estos cultivos se empleó el hongo A. niger, pero no se hidrolizó la lactosa ni se evaporó el suero. Abou-Zeid et al. (1983) reportaron la obtención de ácido cítrico a partir de una mezcla de semillas de dátiles y suero de leche utilizando Candida lypolitica. El-Samragy et al. (1996) investigó la producción de ácido cítrico a partir de
|
||
|
|
|||
|
44
|
|||
|
|
|||
|
|
|||
|
OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE SUERO DE LECHE
|
|||
|
|
|||
|
suero de leche con la adición de sal y metanol para dos cepas de A. niger, pero las concentraciones obtenidas fueron muy bajas. El-Holi y Al-Delaimy (2003) adicionaron concentraciones significativas de diferentes azúcares al suero de leche, así como metanol, fosfatos y riboflavina, con el fin de aumentar la concentración de ácido cítrico en cultivos superficiales utilizando A. niger, con resultados positivos. Sin embargo, la concentración obtenida sin aditivos fue sus-tancialmente baja. En estos estudios tampoco se ensayó la hidrólisis previa de la lactosa del suero.
El presente trabajo tuvo por objeto estudiar la obtención de ácido cítrico por fermentación sumergida con A. niger y A. carbonarius, hongos de la sección Nigri del género Aspergillus, utilizando suero de leche dulce en calidad de sustrato, con miras a su aprovechamiento y a la reducción del impacto ambiental que causan los vertimientos de este subproducto en los cursos de agua naturales.
MATERIALES Y MÉTODOS Microorganismos y medios de producción
Se utilizaron tres cepas de hongos: Aspergillus carbonarius NRRL 67, A. carbonarius NRRL 368 y A. niger NRRL 3, suministradas por el National Center for Agricultural Utilization Research del Departamento de Agricultura de Estados Unidos. Las cepas liofilizadas se reconstituyeron en Caldo Triptona Soya (Oxoid, Inglaterra) donde permanecieron de 2 a 3 h, para luego transferirlas a diferentes medios de cultivo.
A fin de determinar una conidiogénesis óptima, las cepas se sembraron en diferentes medios de cultivo sólido recomendados para este género de hongos (Smith y Onions, 1983; Domsch et al., 1980) y se incubaron a dos temperaturas (37 y 25 °C) durante 10 días. Los medios empleados fueron: Agar Czapek (Difco, EUA), Agar Sabouraud Dextrosa (Difco, EUA), PDA (Oxoid, Inglaterra), MEA, Agar Czapek Malta y Agar Czapek Malta modificado mediante la adición al agar Czapek de 4 g de extracto de malta, 0.1 mL de ZnSO4.7H2O al 1% y 0.1 mL de CuSO4.5H2O al 0.5 % c.s.p. 100 mL. Todas las cepas fueron conservadas en tubos con agar Sabouraud inclinado cubiertas con aceite mineral estéril bajo refrigeración y subcultivadas cada dos meses (Smith y Onions, 1983).
|
Suero de leche
Se utilizó suero dulce de leche que fue suministrado por una fábrica local de productos lácteos. Según los requerimientos del diseño experimental al lactosuero se le realizaron diferentes procesamientos: desproteinización del suero por termocoagulación a 90 °C a un pH de 6.0 seguido de centrifugación a 6000 rpm; hidrólisis enzimática de la lactosa del suero con lactasa comercial (Maxilact L 2000® de DSM, Holanda) a 40 °C a un pH de 6.6 durante 1 h con una dosificación de enzima de 0.4 mL/100 mL de suero para alcanzar un 80% de hidrólisis; evaporación del suero hasta un 50% de su volumen inicial.
Diseño experimental
Con el objetivo de llevar a cabo la etapa de adaptación, los hongos fueron transferidos del medio de crecimiento donde presentaron desarrollo óptimo, a dos medios de cultivo líquido. El medio de adaptación 1 tuvo la siguiente composición (en g/L): glucosa, 145; (NH4)NO3, 2.23; K2HPO4, 1.0; MgSO4.7H2O, 0.23. El medio de adaptación 2 consistió en (en g/L): glucosa, 60; (NH4)2SO4, 3.0; MgSO4.7H2O, 0.8; licor de remojo de maíz 1.5 mL/L.
La fase de adaptación se realizó en erlenmeyers de 250 mL que contenían 100 mL de los medios mencionados ajustados a un pH de 5.0. Todos los medios preparados y el material de vidrio fueron esterilizados en autoclave a 121 °C, a 15 psi durante 20 min. Los medios fueron inoculados con una suspensión de conidias provenientes del medio de crecimiento. El cultivo se llevó a cabo a 30 °C en un termostato de recirculación digital con agitación (Julabo SW21/ 1, Alemania) a 180 rpm durante 8 días.
Para evaluar la biosíntesis de ácido cítrico por parte de las cepas estudiadas en medios de producción basados en suero de leche, se planteó un diseño experimental de un factor a cuatro niveles (tratamientos) y con tres réplicas por nivel. Los tratamientos realizados fueron: suero entero, suero desproteinizado, suero desproteinizado e hidrolizado y suero desproteinizado, hidrolizado y evaporado. El análisis de varianza y la validación de los supuestos (Díaz, 1999; Walpole et al., 1998) se realizó mediante el paquete estadístico Statgraphics v. 5.2. El cultivo se realizó en erlenmeyers de 250 mL con un volumen de medio de 100 mL. A los medios así preparados no se les agregó ningún componente adicional. El pH inicial de los medios se ajustó a un valor de 3.0 (Vorob'eva, 1989; Crueger y Crueger,
|
||
|
|
|||
|
45
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 43 - 54
|
|||
|
|
|||
|
1993). El porcentaje del inóculo fue de un 5%, el cual se adicionó a los medios en condiciones asépticas. El cultivo se llevó a cabo a 30 °C en el termostato de recirculación digital con agitación a 180 rpm durante 10 días. Durante la fermentación no se controló el pH.
Estudio cinético de la fermentación
De los resultados obtenidos en el diseño experimental se seleccionaron la cepa y el medio de producción que presentaron la mayor concentración de ácido cítrico. Se preparó un volumen suficiente de medio de producción que fue vertido en un biorreactor enchaquetado de 3 L con un impulsor de turbina Rushton (Applikon mod. Z61103CT04, Holanda) empleando un volumen de trabajo del 50%. El medio fue esterilizado en autoclave a 121 °C a 15 psi durante 20 min, ajustándose su pH a un valor de 3.0 y se le adicionó antiespumante natural. El equipo fue esterilizado con vapor vivo de caldera durante 1 1/2 horas. El volumen del inóculo correspondió a un 5% del volumen del medio de producción; la inoculación se llevó a cabo a partir del cultivo procedente del medio de adaptación en condiciones asépticas. El proceso de fermentación se inició inyectando aire purificado por un filtro de lana de vidrio a razón de 0.33 vvm a 200 rpm, manteniéndose la temperatura a 30 °C mediante la circulación por la chaqueta del biorreactor de agua de calentamiento procedente de un termostato. Estas condiciones se mantuvieron durante los dos primeros días de cultivo. Durante los nueve días siguientes se aumentó la aireación a un nivel de 0.62 vvm y la agitación a 300 rpm. Se acondicionó un sistema de toma de muestras de tal forma que no se contaminara el contenido del biorreactor.
Se tomaron muestras cada 6 horas durante 11 días de fermentación, analizándose la concentración de ácido cítrico, azúcares reductores, proteína y biomasa. Con los datos obtenidos se construyeron las curvas de concentración de sustrato, biomasa y producto en función del tiempo. Se simuló la cinética de la fermentación utilizando modelos matemáticos no estructurados con ayuda de los siguientes programas: MS Excel, Visual Basic y Statgraphics.
Técnicas analíticas
La concentración de sustrato se midió por el método espectrofotométrico de determinación de azúcares reductores utilizando ácido dinitrosalicílico (Miller, 1959). El ácido cítrico fue determinado por un método espectrofotométrico comercial que utiliza la enzima
|
citrato-liasa (Boehringer Mannheim/R-Biopharm®, Alemania) llevándose a cabo la medición a una longitud de onda de 340 nm en un espectrofotómetro UV (Unicam modelo UV530, Inglaterra). La biomasa se determinó centrifugando las muestras de caldo de cultivo; el precipitado obtenido se depositó sobre papel filtro Whatman no. 1 previamente secado y pesado y se secó en una mufla hasta peso constante. La determinación de proteína en el caldo de cultivo se realizó por el método de Biuret (Weaver, 2003).
RESULTADOS
A las tres cepas seleccionadas con base en su habilidad reportada para sintetizar ácido cítrico (banco de cepas NRRL WDCM97 del Agricultural Research Service Culture Collection del National Center of Agricultural Utilization Research, Peoria, Illinois, EUA) se les evaluó su conidiogénesis óptima en diferentes medios de cultivo sólido. De la experimentación con todos los medios utilizados, se observó que ambas cepas de A. carbonarius presentaron conidiogénesis pobre en Agar Czapek, a pesar de que éste es el medio seleccionado para el aislamiento de hongos del suelo que posean la capacidad de usar nitrógeno inorgánico (Difco Laboratories, 1998), por lo que se decidió utilizar Agar Czapek Malta y Agar Czapek Malta modificado con la adición de sales de zinc y cobre. Lo anterior en razón de que la adición de cobre favorece la formación de conidias y el zinc ayuda a mantener la síntesis celular y controla las relaciones entre el metabolismo de carbono y nitrógeno (Domsch et al., 1980; Volcy y Pardo, 1994). Los resultados obtenidos confirman una profusa conidiogénesis para el medio modificado, lo cual garantiza un adecuado suministro de material de siembra para la preparación del inóculo.
Los medios de cultivo que mejor conidiogénesis presentaron fueron Agar Czapek Malta modificado y Agar Sabouraud para las dos cepas de Aspergillus carbonarius, y Agar Czapek, Agar Czapek Malta modificado y Agar Sabouraud para el Aspergillus niger NRRL 3. Lo anterior indica las mayores exigencias nutricionales del A. carbonarius en cuanto a formación de conidias se refiere. La temperatura óptima de cultivo en medios de crecimiento fue de 25 °C para las cepas de A. carbonarius. La cepa de A. niger NRRL 3 presenta una profusa conidiogénesis tanto a 25 °C como a 37 °C si se selecciona el medio adecuado. Para las siguientes etapas del estudio se seleccionó el medio Czapek Malta modificado para las cepas de A. carbonarius y Czapek para la cepa de A. niger.
|
||
|
|
|||
|
46
|
|||
|
|
|||
|
|
|||||||||||||||||||||||||||||||||||||
|
OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE SUERO DE LECHE
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
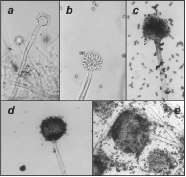
En las figuras 1a y 1b se pueden observar las estructuras morfológicas presentadas durante la conidiogénesis del A. carbonarius NRRL 368 al inicio de la maduración: conidióforo, cabezuela, métulas, fiálides y conidias hialinas. A medida que el hongo madura, va adquiriendo una pigmentación oscura (Figuras 1c, 1d y 1e) en todas sus estructuras con excepción del conidióforo. El hongo presentó conidióforo de pared gruesa y conidias equinuladas oscuras. Características similares se observaron en A. carbonarius NRRL 67 y A. niger NRRL 3, las cuales coinciden con las descritas en la literatura para los hongos del género Aspergillus de la sección Nigri (Domsch et al., 1980; Vélez, 1989).
La suspensión de conidias procedentes del medio de crecimiento seleccionado para cada cepa fue transferida a los dos medios líquidos de adaptación con el fin de disponer de material de siembra para la inoculación de los diferentes medios basados en suero de leche. El medio que mejores resultados presentó en cuanto a formación de biomasa fue el medio de adaptación 2, a causa de la presencia en su composición de una fuente orgánica de nitrógeno: el licor de maceración de maíz. No se apreció la presencia de conidias debido a que éstas germinaron favoreciendo el crecimiento micelial, lo cual es explicable por la intensa agitación a la que fue sometido el cultivo. En las tres cepas estudiadas se observaron aglomeraciones de hifas de pigmento verde oscuro al finalizar la etapa de adaptación (ver figura 2).
|
 |
||||||||||||||||||||||||||||||||||||
|
Figura 2. Micrografía (10X) de la aglomeración de hifas de A. carbonarius NRRL 368 al finalizar la etapa de adaptación.
|
|||||||||||||||||||||||||||||||||||||
|
En la tabla 1 se evidencia la efectividad del procedimiento empleado para la desproteinización del suero. Igualmente se observa el aumento en la concentración de azúcares reductores con la hidrólisis enzimática de la lactosa y con la evaporación del suero.
|
|||||||||||||||||||||||||||||||||||||
|
Tabla 1. Concentración de azúcares reductores totales y proteína de acuerdo con los diferentes tratamientos utilizados
|
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||
|
Los resultados del diseño experimental planteado para evaluar la biosíntesis de ácido cítrico en diferentes medios basados en suero de leche se compilan en la tabla 2 para cada una de las cepas estudiadas.
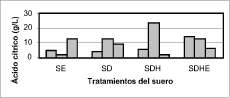
Los resultados obtenidos para el hongo A. carbonarius NRRL 368 se muestran en la figura 3. El análisis de varianza de los datos obtenidos mostró que no existe diferencia significativa entre los diversos tratamientos a un nivel de significancia del 5% (Pvalue = 0.876), lo que implica que se acepta la hipótesis nula, es decir, la media de los tratamientos es igual. Los supuestos fueron validados, en particular la prueba de Barttlet para verificar la homocedasticidad de la varianza, lo que permite comprobar que no hay diferencia entre las varianzas de los tratamientos.
|
|||||||||||||||||||||||||||||||||||||
|
Figura 1. Micrografías de las etapas del desarrollo de la estructura fructífera del hongo A. carbonarius NRRL 368: a y b (10X) - inicio de la maduración; c, d (10X) y e (40X) - estructuras maduras.
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
47
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 43 - 54
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 2. Resultados del diseño experimental para evaluar la biosíntesis de ácido cítrico obtenidos para cada cepa de hongos de acuerdo con el tratamiento de suero empleado
|
Lo anterior indica que desde el punto de vista de la biosíntesis de áci
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
do cítrico esta cepa del hongo, a semejanza de la anterior, metaboliza los diferentes tipos de suero independientemente de la forma como esté presente la fuente de carbono (lactosa o lactosa hidrolizada). Igualmente, la desproteinización del suero no representó una ventaja en la biosíntesis de ácido cítrico por A. carbonarius NRRL 67.
Los resultados obtenidos para el hongo A. niger NRRL 3 muestran que las mayores concentraciones de ácido cítrico obtenidas corresponden al suero desproteinizado, hidrolizado y evapora
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Lo anterior indica que desde el punto de vista de la biosíntesis de ácido cítrico, el hongo metaboliza los diferentes tipos de suero independientemente de la forma como esté presente la fuente de carbono (lactosa o lactosa hidrolizada). Igualmente, la desproteinización del suero no representó una ventaja en la biosíntesis de ácido cítrico por A. carbonarius NRRL 368.
Los resultados obtenidos para el hongo A. carbonarius NRRL 67 se muestran en la figura 4. Del análisis de varianza realizado se concluye que no se encontró diferencia significativa entre los diferentes tratamientos a un nivel de significancia del 5% (Pvalue = 0.416), lo que implica que se acepta la hipótesis nula, es decir, la media de los tratamientos es igual. Los supuestos fueron validados, en particular la prueba de Barttlet para verificar la homocedasticidad de la varianza, lo que permite comprobar que no hay diferencia entre las varianzas de los tratamientos.
|
do (ver figura 5), con un promedio para el tratamiento de 5,77 g/L. Lo anterior indica que conforme aumenta la concentración de sustrato de tratamiento en tratamiento, aumenta también la cantidad de ácido cítrico producida. Por lo tanto, A. niger no asimila adecuadamente la lactosa, lo que se puede comprobar al observar las bajas concentraciones obtenidas del ácido en el tratamiento de suero con lactosa no hidrolizada. Igualmente, la desproteinización del suero no parece tener un efecto significativo sobre la biosíntesis del ácido, al no observarse diferencias relevantes en las concentraciones obtenidas con suero entero o desproteinizado.
El análisis de varianza realizado corrobora las conclusiones anteriores al indicar que existe una diferencia significativa entre los tratamientos a un nivel de significancia del 5% (Pvalue = 0.000). Al realizar la prueba LSD (mínima diferencia significativa) para determinar cuáles tratamientos presentaron diferen-
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 3. Producción de ácido cítrico por el hongo A. carbonarius NRRL 368 después de 10 días de incubación utilizando diferentes tratamientos de suero de leche. SE - Suero entero. SD - Suero desproteinizado. SDH - Suero desproteinizado, hidrolizado. SDHE - Suero desproteinizado, hidrolizado, evaporado.
|
Figura 4. Producción de ácido cítrico por el hongo A. carbonarius NRRL 67 después de 10 días de incubación utilizando diferentes tratamientos de suero de leche. SE - Suero entero. SD - Suero desproteinizado. SDH - Suero desproteinizado, hidrolizado. SDHE - Suero desproteinizado, hidrolizado, evaporado.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
48
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE SUERO DE LECHE
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
el cultivo entró en fase estacionaria. La concentración de sustrato disminuyó ostensiblemente hasta el séptimo día; sin embargo, al final de la fermentación no se alcanzaron a consumir todos los azúcares reductores disponibles en el medio, lo que indica que es necesario aumentar la conversión del sustrato. El porcentaje de utilización del sustrato fue de 75.5%.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
_ 8
í
I
o
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
SE SD SDH
Tratamientos del suero
|
SDHE
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 5. Producción de ácido cítrico por el hongo A. niger NRRL 3 después de 10 días de incubación utilizando diferentes tratamientos de suero de leche. SE - Suero entero. SD - Suero desproteinizado. SDH - Suero desproteinizado, hidrolizado. SDHE - Suero desproteinizado, hidrolizado, evaporado.
cias significativas, se observa que no existen diferencias entre los sueros entero y desproteinizado, mientras que sí existe entre éstos y los medios basados en suero con lactosa hidrolizada. Así mismo, se determinó que sí existían diferencias significativas entre el suero desproteinizado e hidrolizado y el suero desproteinizado, hidrolizado y evaporado.
Después de 8 días de cultivo del hongo A. niger NRRL 3 en erlenmeyers de 250 mL, se pudo apreciar la profusa formación de pellets con un diámetro promedio de 5 mm. La forma esférica adquirida por el hongo se debió a la prolongada agitación a la que fue sometido durante la fermentación.
Considerando los resultados obtenidos se decidió utilizar el hongo A. niger NRRL 3 y el tratamiento con suero de leche desproteinizado, hidrolizado y evaporado, en razón de que dicho hongo es el que se utiliza industrialmente y que sí presentó diferencias significativas entre tratamientos, lo que permite evaluar la influencia de la hidrólisis de lactosa sobre los rendimientos de ácido cítrico.
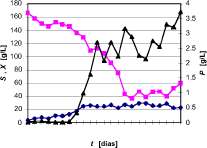
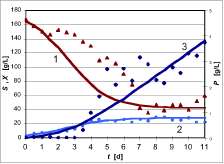
En la figura 6 se observan los resultados obtenidos durante 11 días de fermentación empleando el medio líquido seleccionado en un biorreactor agitado de 3 L con aireación. Para efectos de claridad en la presentación de los resultados, sólo se muestran dos datos por día. A lo largo de la fermentación se pudieron apreciar los agregados miceliales del hongo. Durante los cultivos preliminares se formó abundante cantidad de espuma, por lo que se hizo necesario la adición de antiespumantes naturales. De los datos cinéticos obtenidos se puede observar el crecimiento celular hasta el cuarto día, a partir del cual
|
 01 23456789 10 11
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Sustrato (S)
|
Biomasa (X) ■
|
Ácido Cítrico (P)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 6. Consumo de sustrato, crecimiento de biomasa y biosíntesis de ácido cítrico durante el cultivo sumergido de suero de leche desproteinizado, hidrolizado y evaporado con A. niger NRRL 3.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La concentración de ácido cítrico obtenida es menor que la alcanzada durante el diseño experimental, debido entre otras razones al cambio de escala. Sin embargo, la cepa empleada demostró su capacidad de biosintetizar el ácido. Se diferencia claramente la trofofase (etapa de formación de biomasa) de la idiofase (etapa de biosíntesis de producto). El seguimiento a la concentración de proteína en el medio de cultivo durante la fermentación no tuvo cambios significativos indicando que el mayor consumo de nitrógeno orgánico se llevó a cabo durante el primer día de fermentación, manteniéndose constante el contenido de proteína en un nivel cercano a 8 g/L.
Con base en los datos experimentales se calcularon los rendimientos aparentes de biomasa y ácido cítrico, expresados como gramos de biomasa formada por gramo de sustrato consumido, y gramos de ácido cítrico producidos por gramo de sustrato consumido. Los valores obtenidos fueron 0.177 g biomasa/g sustrato y 0.034 g ácido cítrico/g sustrato.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
49
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 43 - 54
|
|||||||||
|
|
|||||||||
|
La máxima velocidad observada de producción de ácido cítrico fue de 71 mg/(L.h).
A partir de los datos biocinéticos se llevó a cabo el modelamiento matemático del proceso de fermentación. Para ello se planteó el siguiente modelo no estructurado:
|
les que se muestran en la figura 7. Los datos fueron ajustados mediante regresiones polinomiales para obtener así curvas suavizadas que reflejaran los resultados obtenidos. Mediante un análisis de regresión se estimaron los parámetros cinéticos.
|
||||||||
|
0.8
0.7
0.6
5 0.5
* 0.4
0.3
^ 0.2
0.1
0
|
y = -0,0286x + 0,8069 R2 = 0,996
|
||||||||
|
dt dS
dt dP
|
1 dX
|
Sistema (1)
|
|||||||
|
YX dt
T"
|
 |
||||||||
|
|
|||||||||
|
0
|
10
|
20
|
30
|
||||||
|
|
|||||||||
|
X [g/L]
|
|||||||||
|
|
|||||||||
|
Éste está basado en un modelo definido en un trabajo anterior (Vinarov et al., 1996), para la formulación, del cual se tuvieron en cuenta las siguientes suposiciones: (1) La fuente de carbono principal se gasta durante la biosíntesis, mayoritariamente en la producción de biomasa; (2) la velocidad de formación de biomasa durante la biosíntesis se limita por la interacción entre las células cuando se consume el sustrato; (3) la velocidad de producción de ácido cítrico depende de la concentración de los microorganismos productores en el medio líquido; (4) el proceso ocurre en condiciones aeróbicas no limitadas por déficit de oxígeno; (5) el modelo describe el proceso cinético cuando una cierta cantidad de inóculo es transferida al biorreactor o cuando se alcanza la concentración celular inicial (X0) en el caso de siembra con suspensión de conidias.
La primera ecuación del Sistema (1) corresponde a un modelo logístico, el cual describe la fase de crecimiento y la fase estacionaria de una fermentación por lotes. La segunda ecuación muestra que la velocidad de consumo de sustrato (dS/dt) es directamente proporcional a la velocidad de formación de biomasa (dX/dt). Finalmente, la tercera ecuación revela que la velocidad de formación de producto (dP/ dt) es directamente proporcional a la concentración de biomasa y no a su velocidad de formación, lo cual es válido para la biosíntesis de metabolitos relacionados indirectamente con el crecimiento celular.
Los parámetros cinéticos del modelo planteado se determinaron con base en los datos experimenta-
|
Figura 7. Determinación de los parámetros cinéticos de la ecuación logística que modela la formación de biomasa
|
||||||||
|
Los valores de y p se hallaron con base en la regresión lineal de los puntos obtenidos al graficar (1/X).(dX/dt) vs. X. La pendiente de la recta obtenida corresponde a -p, mientras el intercepto con el eje de las ordenadas corresponde a £ (ver figura 7). Los valores de dX/dt se obtuvieron diferenciando numéricamente los datos experimentales de concentración de biomasa en función del tiempo. De la misma manera se procedió para determinar Y^ y qP, construyendo las gráficas de dS/dt vs. dX/dt y dP/dt vs. X y realizando las regresiones lineales correspondientes. Las pendientes de las ecuaciones lineales obtenidas correspondieron a los valores de Y^ y qP.
En la figura 8 se observan los resultados de la simulación de la fermentación con base en el modelo matemático propuesto de acuerdo con el Sistema (1), el cual se resolvió por el método de Runge-Kutta de cuarto orden con paso fijo. Los valores de los parámetros cinéticos empleados son los s¡gu¡entes:£= 0.8069, p = 0.0286, YX/S = 0.2038 y qP = 0.0163. Es de anotar que el valor obtenido del rendimiento aparente de biomasa a partir de sustrato corresponde al 86.9% del valor del rendimiento de biomasa a partir de sustrato obtenido de la simulación, lo cual indica que la mayor parte del sustrato consumido se destinó a la formación de biomasa celular.
|
|||||||||
|
|
|||||||||
|
50
|
|||||||||
|
|
|||||||||
|
|
|||
|
OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE SUERO DE LECHE
|
|||
|
|
|||
|
El análisis de varianza realizado para verificar si el modelo describe adecuadamente los datos experimentales muestra que el comportamiento de la biomasa y del ácido cítrico se ajusta al modelo propuesto. Sin embargo, la curva de sustrato generada por el modelo no simula adecuadamente los datos experimentales.
DISCUSIÓN
Los procesos comerciales para la producción de ácido cítrico se llevan a cabo por fermentación de melazas empleando A. niger. Las melazas tienen como fuente de carbono principal la sacarosa. La utilización de suero de leche para la producción de ácido cítrico implica la selección de microorganismos que tengan la capacidad de asimilar la lactosa del suero.
|
en el presente trabajo (0.34 g/L) como en otros estudios reportados. Por ejemplo, en el estudio de El-Holi y Al-Delaimy (2003) se obtuvo una concentración de 2.28 g/L a los 10 días de fermentación empleando suero sin suplementar en cultivo superficial. En el caso del trabajo de Hossain et al. (1983) se reporta una concentración de 5.0 g/L a los 10 días de cultivo sumergido para la mejor cepa productora de A. niger de las 10 cepas estudiadas, siendo las restantes muy inferiores en producción; sólo llevando a cabo un programa de mutación para esta cepa se logró incrementar la concentración de ácido cítrico hasta un nivel de 8.3 g/L para el permeado de suero sin suplementos adicionales (ver tabla 3).
Sin embargo, se hace necesario profundizar en las condiciones de cultivo del A. carbonarius, en vista de que no se presentaron diferencias significativas al variar los tratamientos a los que fue sometido el suero de leche en las fermentaciones realizadas. La variabilidad observada para todas las muestras tomadas y los tratamientos empleados en las concentraciones de ácido cítrico obtenidas por A. carbonarius, hace necesario ahondar en su estudio, tanto más si se tiene en cuenta que en la literatura disponible no existen reportes detallados sobre las regularidades que rigen la biosíntesis de este ácido en el caso de este hongo.
En especial, sería necesario establecer las temperaturas y valores de pH óptimos de cultivo para las cepas estudiadas. De otro lado, es necesario estudiar las condiciones de preadaptación de este hongo al medio basado en lactosuero para identificar cómo las condiciones de precultivo pueden afectar los rendimientos de ácido durante la etapa de producción.
Los procesos industriales operan con una concentración inicial de sacarosa de aproximadamente 140 g/L, por lo que es particularmente importante explorar la posibilidad de las diferentes cepas de asimilar los azúcares reductores obtenidos de la hidrólisis enzimática de la lactosa del suero de leche y que alcanzan concentraciones de aproximadamente 83 g/L. Evaporando el lactosuero hidrolizado se pueden obtener concentraciones de hasta 165 g/L, lo que implica una disponibilidad suficiente de sustrato para el cultivo de diferentes tipos de microorganismos, entre ellos de los hongos productores de ácido cítrico. Precisamente, la cepa de A. niger NRRL 3 demostró mayores rendimientos con el suero desproteinizado, hidrolizado y evaporado. El efecto de la hidrólisis y la evaporación indiscutiblemente aumenta la concen-
|
||
 |
|||
|
Figura 8. Simulación de la fermentación para la producción de ácido cítrico a partir de suero de leche con A. niger N RRL 3. Datos experimentales: () Sustrato, S; () Biomasa, X; () Producto, P. Curvas calculadas a partir del modelo: 1 - Sustrato; 2 - Biomasa; 3 - Producto. Las líneas continuas corresponden a los datos calculados por el modelo, las curvas con puntos discretos corresponden a los datos experimentales.
|
|||
|
Este estudio demuestra la viabilidad de utilizar las cepas NRRL 368 y NRRL 67 de A. carbonarius para biosintetizar ácido cítrico a partir de suero de leche. Los resultados alcanzados son perspectivos considerando las concentraciones obtenidas (tabla 2), en comparación con A. niger que es el microorganismo utilizado en todo el mundo como productor de ácido cítrico en fermentaciones industriales. En particular, la cepa de A. carbonarius NRRL 368 presentó un promedio de concentraciones de ácido cítrico para todos los tratamientos de 9.27 g/L, que es mayor a la concentración alcanzada para A. niger tanto
|
|||
|
|
|||
|
51
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 43 - 54
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
tración de azúcares fermentables. Sin embargo, la desproteinización del suero no influyó sobre la producción de ácido cítrico por A. niger; lo anterior indica que los estudios subsiguientes pueden realizarse con suero sin desproteinizar. Se propone la realización de ensayos con medios basados en suero de leche suplementados con fuentes adicionales de carbono y nitrógeno como metanol y extracto de levadura. Esta suplementación eventualmente puede incrementar los rendimientos del ácido al aportar nutrientes clave en su biosíntesis, aunque eleva los costos de una potencial fermentación industrial, lo mismo que la evaporación del medio.
Otra opción a considerar para aumentar la producción de ácido cítrico tanto en el caso de A. niger, como en el de A. carbonarius, consiste en explorar la mutación inducida de los microorganismos estudiados con el fin de obtener cepas productoras de ácido cítrico de mayor rendimiento. De esta manera, la combinación de esta técnica con los diferentes tratamientos de suero aquí estudiados permitiría aumentar las concentraciones de ácido obtenidas en el presente trabajo.
Los resultados de la fermentación en el biorreactor de 3 L con A. niger revelan que los azúcares reductores no son completamente utilizados (porcentaje de utilización del 75.5%) por lo que se puede explorar la posibilidad de aumentar su tasa de utilización en futuros trabajos. En este aspecto es fundamental profundizar en la determinación de los valores óptimos de las condiciones de cultivo (pH, temperatura, aireación) que contribuyan a una mayor asimilación del sustrato y producción de ácido cítrico. Igualmente, es necesario hacer un seguimiento a la
|
concentración de nitrógeno inorgánico en el medio para correlacionarlo con la biosíntesis del ácido.
La formación de ácido cítrico en el tiempo demuestra que este metabolito está indirectamente relacionado con el crecimiento celular, ya que se puede observar un desfase entre las curvas correspondientes. Lo anterior fundamenta la elección del modelo utilizado para la simulación de la formación del producto.
Las curvas generadas por el modelo matemático se ajustaron a los datos experimentales de biomasa y ácido cítrico, no así a los de sustrato. Para simular el comportamiento de los azúcares reductores se deben emplear otros modelos que tengan en cuenta tanto el consumo de sustrato para la formación de biomasa como para la biosíntesis del ácido.
La comparación realizada con los resultados de la simulación obtenidos anteriormente para un cultivo sumergido de A. niger en un medio basado en glucosa (Vinarov et al., 1996), muestra que las principales regularidades cinéticas se conservan cuando el medio de cultivo es reemplazado por suero de leche desproteinizado, con lactosa hidrolizada y evaporado. En particular, la formación de biomasa se pudo describir de la misma forma que para el caso del medio basado en glucosa. De otro lado, aunque el modelo utilizado para la formación de ácido cítrico en el trabajo de Vinarov y col. tuvo en cuenta una inhibición al final de la fermentación, durante la mayor parte del tiempo de cultivo se verificó la proporcionalidad entre la formación de producto y la concentración de biomasa; finalmente, el consumo de sustrato no pudo ser descrito con las mismas expresiones cinéticas.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
52
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
OBTENCIÓN DE ÁCIDO CÍTRICO A PARTIR DE SUERO DE LECHE
|
|||
|
|
|||
|
CONCLUSIONES
Con el presente trabajo se demuestra que el suero de leche es un medio de cultivo que proporciona los nutrientes necesarios para el desarrollo de las cepas de Aspergillus spp. empleadas, así como para la biosíntesis de ácido cítrico.
|
así como a la doctora Carmen Dussán, directora del Departamento de Matemáticas de la Universidad de Caldas, por su valiosa asesoría estadística. Este trabajo fue financiado por la vicerrectoría de Investigaciones y Posgrados de la Universidad de Caldas.
Nomenclatura
|
||
|
|
|||
|
El hongo A. carbonarius ha sido poco estudiado en cuanto a formación de productos de valor agregado se refiere, por lo que se requiere la realización de estudios posteriores con el objetivo de utilizarlo como un microorganismo adicional de potencial aplicación industrial.
Se demuestra que el hongo A. niger no asimila adecuadamente la lactosa del suero de leche. Su hidrólisis y la concentración del suero por evaporación representan una estrategia válida para aumentar la disponibilidad de sustratos fermentables e incrementar los rendimientos del ácido. Sin embargo, la evaporación de grandes cantidades de lactosuero implica grandes costos energéticos al momento de escalar el proceso a nivel industrial.
Se hace necesario emplear otras técnicas y estrategias para maximizar la obtención de ácido cítrico a partir de suero de leche, debido a que los rendimientos obtenidos son muy inferiores en comparación con los procesos industriales a partir de melazas. No obstante, el suero de leche continúa siendo una alternativa potencial considerando su gran disponibilidad, su contenido de nutrientes y la necesidad de ser aprovechado para minimizar el impacto ambiental que causa su vertimiento a los cursos de agua naturales.
El modelamiento matemático de la biocinética demostró ser una potente herramienta para la simulación del proceso de fermentación al describir adecuadamente el crecimiento de la biomasa y la formación del ácido cítrico. Estos modelos son de gran utilidad durante el diseño del proceso y constituyen el primer paso para la simulación de la transferencia de masa, de calor y las condiciones hidráulicas del cultivo en biorreactores comerciales.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al doctor Stephen W. Peterson, curador de la colección de Aspergillus y Penicillium del National Center for Agricultural Utilization Research en Peoria, Illinois (EUA), por el suministro de las cepas objeto de este estudio,
|
P = Concentración de producto, g/L
qP = Velocidad específica de formación de producto, g producto/(g biomasa.d)
S = Concentración de sustrato, g/L
í = Tiempo, d
X = Concentración de biomasa, g/L
Y^ = Rendimiento de biomasa a partir de sustrato, g biomasa/g sustrato
p = Coeficiente de interacción celular, L/(g.d)
E = Coeficiente de velocidad de formación de biomasa, d 1
BIBLIOGRAFÍA
Abou-Zeid, A. Z.; Baghlaf, A. O.; Khan J. A.; Makhasin S. S. 1983. Utilization of date seeds and cheese whey in the production of citric acid by Candida lipolytica. Arab Gulf J. scient. Res. 1 (1): 267-283.
Al-Asheh, S.; Duvnjak, Z. 1995. The effect of phosphate concentration on phytase production and the reduction of phytic acid content in canola meal by Aspergillus carbonarius during a solid-state fermentation process. Appl. Microbiol. and Biotechnol. 43 (1): 25-30.
Baena, S.; Campos, C.; Rojas, G. 1994. Aguas residuales de la industria láctea: naturaleza y composición de las aguas residuales. Revista Ambiente y Desarrollo. Pontificia Universidad Javeriana. 2 (2 y 3): 83-93.
Ben-Hassan, R. M., Ghaly, A. E. 1994. Continuous propagation of Kluyveromyces fragilis in cheese whey for production potential reduction. Applied Biochemistry and Biotechnology Journal. 44 (3): 89-105.
Boehringer Mannheim/R-Biopharm. Citric Acid. UV method for the determination of citric acid in foodstuffs and other materials. Cat. No. 0 139 076.
Colomban, A.; Roger, L.; Boyaval P. 1993. Production of propionic acid from whey permeate by sequential fermentation, ultrafiltration and cell recycling. Biotechnol. Bioeng. 42: 1091-1098.
Crueger, W.; Crueger, A. 1993. Biotecnología: manual de biotecnología industrial. Zaragoza, España: Acribia. 413.
Demain, A. L. 2000. Small bugs, big business: the economic power of the microbe. Biotechnology Advances. 18: 499-514.
Devi, N. A.; Rao, A. G. A. 1996. Fractionation, purification and preliminary characterization of polygalacturonases produced by Aspergillus carbonarius. Enzyme Microb. Technol. 18: 59-65.
Díaz, A. 1999. Diseño estadístico de experimentos. Medellín, Colombia: Universidad de Antioquia. 346.
Difco Laboratories. 1998. Manual Difco. Sparks, Maryland, EUA.
Domingues, L.; Lima, N.; Teixeira, J. A. 2001. Alcohol production from cheese whey permeate using genetic modified flocculating yeast cells. Biotechnol. Bioeng. 72: 507-514.
|
||
|
|
|||
|
53
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 43 - 54
|
|||
|
|
|||
|
Domsch, K. H.; Gams W.; Anderson, T-H. 1980. Compendium of soil fungi. Volumen 1. Londres, Inglaterra: Academic Press. 859.
El-Hawary, F. I.; Mehanna A. S. 1991. Production of single cell protein from yeast grown in whey. Acta Alimentaria. 20: 205-213.
El-Holi, M. A.; Al-Delaimy, K. S. 2003. Citric acid production from whey with sugars and additives by Aspergillus niger. African J. Biotechnol. 2 (10): 356-359.
El-Samragy, Y. A.; Khorshid, M. A.; Foda M. I.; Shehata A. E. 1996. Effect of fermentation conditions on the production of citric acid from cheese whey by Aspergillus niger. Int. J. Food Microbiol. 29 (2 y 3): 411 -416.
García, M.; Quintero, R.; López-Munguía, A. 1993. Biotecnología alimentaria. México D.F., México: Limusa. 636.
García, M.; Gómez, L.; Bárzana, E. 1987. Studies on the simultaneous production of single-cell protein and endo-polygalacturonase from Kluyveromyces fragilis. Biotechnol. Lett. 9 (6): 411-416.
Ghaly, A. E.; El-Taweel, A. A. 1995. effect of nutrient supplements addition on ethanol production from cheese whey using Candida pseudotropicalis under batch conditions. Applied Biochemistry and Biotechnology Journal. 53 (1): 107-132.
González, M. I. 1994. _-Galactosidase production by Kluyveromyces lactis on milk whey: batch versus fed-batch cultures. Proc. Biochem. 29 (7): 565-568.
Grba, S.; Stehlik-Tomas, V.; Stanzer, D.; Vah_i_, N.; _krlin, A. 2002. Selection of yeast strain Kluyveromyces marxianus for alcohol and biomass production on whey. Chem. Biochem. Eng. Q. 16 (1): 13-16.
Hossain, M.; Brooks, J. D.; Maddox, I.S. 1983. Production of citric acid from whey permeate by fermentation using Aspergillus niger. New Zealand Journal of Dairy Science and Technology. 18: 161-168.
Hosseini, M.; Shojaosadati, S. A.; Towfighi, J. 2003. Application of a bubble-column reactor for the production of a single-cell protein from cheese whey. Ind. Eng. Chem. Res. 42: 764-766.
Huang, Y. ; Yang, S.T. 1998. Acetate production from whey lactose using co-immobilized cells of homolactic and homoacetic bacteria in a fibrous-bed bioreactor. Biotechnol. Bioeng. 60 (4): 498-507.
Huggins, A. R. 1984. Progress in dairy starter culture technology. J. Food Technol. 38 (6): 41-50.
Kim, E. K.; Roberts, R. S. 1991. Rate equation for the vigorous stationary phase fermentation of citric acid by Saccharomycopsis lipolytica. Biotechnol. Bioeng. 37 (6): 985-988.
Klasson, T. K.; Clausen, E. C.; Gaddy, J. L. 1989. Continuous fermentation for the production of citric acid from glucose. Appl. Biochem. Biotechnol. 20/21: 491-509.
Kubicek, C. P., Röhr, M. 1986. Citric acid fermentation. CRC Crit. Rev. Biotechnol. 3: 331-373.
Lamboley, L. ; Lacroix, C. ; Champagne, C. P.; Vuillemard, J. C. 1997. Continuous mixed strain mesophilic lactic starter production in supplemented whey permeate medium using immobilized cell technology. Biotechnol. Bioeng. 56: 502-516.
Lee, P. C.; Lee, W. G.; Kwon, S.; Lee, S. Y., Chang, H. N. 2000. Batch and continuous cultivation of Anaerobiospirillum
|
succiniciproducens for the production of succinic acid from
whey. Appl. Microbiol. Biotechnol. 54: 23-27. Marwaha, S. S.; Kennedy, J. F. 1988. Whey-pollution problem
and potential utilization. Int. J. Food Sci. Technol. 23:
323-336. Miller, G. L. 1959. Use of dinitrosalicylic acid reagent for
determination of reducing sugars. Analytical Chemistry.
31 (3): 426-428. Moresi, M. 1994. Effect of glucose concentration of citric acid
production by Yarrowia lipolytica. J. Chem. Technol.
Biotechnol. 60 (4): 387-395. Moulin, G.; Galzy, P. 1984. Whey, a potential substrate for
biotechnology. Biotechnology and Genetic Engineering
Reviews. 1: 347-373. Rech, R.; Cassini, C. F.; Secchi, A.; Ayub, M. A. Z. 1999.
Utilization of protein-hydrolyzed cheese whey for
production of _-galactosidase by Kluyveromyces
marxianus. J. Ind. Microbiol. Biotechnol. 23 (2): 91-96. Smith, D.; Onions, A. H. S. 1983. The preservation and
maintenance of living fungi. Kew, Reino Unido:
Commonwealth Mycological Institute. Somkuti, G. A.; Bencivengo, M. M. 1981. Citric acid
fermentation in whey permeate. Dev. Ind. Microbiol. 22:
557-563. Souza, C. G.; Ledingham, W. M.; Morais, M. A. 2001. Utilization
of cheese whey as an alternative growth medium for
recombinant strains of Kluyveromyces marxianus.
Biotechnol. Lett. 23 (17): 1413-1416. Talabardon, M.; Schwitzguébel, J. P.; Péringer, P. 2000.
Anaerobic thermophilic fermentation for acetic acid
production from milk permeate. Journal of Biotechnology.
76: 83-92. Tejayadi, S.; Cheryan, M. 1995. Lactic acid from cheese whey
permeate. Productivity and economics of a continuous
membrane bioreactor. Appl. Microbiol. Biotechnol. 43 (2):
242-248. Trujillo, M.; Suárez, F.; Gallego, D. 1998. Fermentación láctica en
continuo a partir de suero dulce de leche desproteinizado.
Revista Colombiana de Biotecnología. 1 (1): 45-50. Vanhuynh, N.; Decleire, M.; Voets, J. C.; Motte, J. C., Monseur,
X. 1986. Production of gluconic acid from whey
hydrolysate by Gluconobacter oxydans. Process
Biochem. 21 (1): 31-32. Vélez, H. 1989. Curso avanzado de hongos oportunistas.
Medellín, Colombia: Universidad de Antioquia. 211. Vinarov, A.Yu.; Sánchez, O. J.; Gordeev, L.S. 1996. Simulation
and optimization of citric acid biosynthesis. Theoretical
Foundations of Chemical Engineering. 30 (5): 478-485. Volcy, C.; Pardo, V. M. 1994. Principios de micología. Medellín, Colombia: Universidad Nacional de Colombia. 141. Vorob'eva, L. I.1989. Promishlennaya mikrobiologiya. Moscú,
Rusia: MGU. 294. Walpole, R. E.; Myers, R. H.; Myers, S. L. 1998. Probabilidad
y estadística para ingenieros. México D.F., México:
Prentice-Hall Hispanoamericana. 739. Weaver, C. 2003. The food chemistry laboratory: A manual for
experimental foods, dietetics and food scientists. Nueva
York, Estados Unidos: CRC Press LLC. 152. Yang, S. T.; Zhu, H.; Li, Y.; Hong, G. 1994. Continuous propionate
production from whey permeate using a novel fibrous bed
bioreactor. Biotechnol. Bioeng. 43: 1124-1130.
|
||
|
|
|||
|
54
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2004 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















