Análisis de iridoides y expresión de genes que codifican enzimas tempranas en la síntesis de alcaloides indol terpenoicos en Catharanthus roseus
Analysis of iridoids content and expression studies of genes encoding early enzymes in the indol terpenoid biosynthesis pathway in Catharanthus roseus
Palabras clave:
metabolismo secundario, alcaloides indol terpenoicos, jasmonato de metilo, vía del mevalonato, secologanina, Secondary metabolism, terpenoid indol alcaloids, methyl jasmonate, mevalonate pathway, secologanin (es)|
|
||
|
Análisis de iridoides y expresión de genes que codifican
enzimas tempranas en la síntesis de alcaloides indol
terpenoicos en Catharanthus roseus
Analysis of iridoids content and expression studies of genes
encoding early enzymes in the indol terpenoid biosynthesis
pathway in Catharanthus roseus
Natalia Palacios-Rojas*, Mark Leech**
|
||
|
|
||
|
RESUMEN
Los alcaloides indol terpenoicos (TIA) son metabolitos secundarios de importancia medicinal por sus propiedades como agentes anticancerígenos, entre otras. Sin embargo, su explotación en la industria farmacéutica se ha visto limitada, ya que la acumulación de estos compuestos en las plantas que los producen es mínima. Dichos alcaloides son biosintetizados por la vía del shikimato y de los terpenoides, los cuales proveen los precursores: secologanina y triptamina, respectivamente. La secologanina es sintetizada vía terpenoides, y estudios preliminares sugieren que es sintetizada vía del 2-C-metil-D-eritrol-4-fosfato (MEP) y no vía acetato/ácido mevalónico. Se cree que la secologanina es una de las moléculas limitantes en la biosíntesis de TIA. En el presente estudio se cuantif ican y evalúan por HPLC los niveles de este compuesto y sus predecesores iridoides, ácido logánico y secologanina, en diferentes partes de la planta medicinal Catharanthus roseus. La distribución de estos iridoides varía según el tejido analizado, encontrándose mayor acumulación de secologanina en el segundo par de hojas de la planta. Los niveles de transcriptos de las enzimas involucradas en los pasos tempranos de la vía de los iridoides fueron monitoreados también en diferentes tejidos usando la técnica transferencia de ARN, Northern blots. Adicionalmente, las plantas se elicitaron con jasmonato de metilo (MeJA), con el fin de estudiar el efecto de esta molécula en la transcripción de genes que codifican enzimas involucradas en los pasos tempranos de la vía de los iridoides. Los resultados obtenidos en este estudio sugieren que la vía del MEP puede estar más activa que la vía del acetato/ácido mevalónico en tejidos aéreos jóvenes de la planta. Adicionalmente, es evidente que el MeJA afecta la biosíntesis de TIA estimulando la transcripción de diferentes genes.
Palabras clave: metabolismo secundario, alcaloides indol terpenoicos, jasmonato de metilo, vía del mevalonato, secologanina.
ABSTRACT
Terpenoid indole alkaloids (TIA) are of pharmaceutical importance, however the industrial use of these compouds is very limited because its accumulation is very low in plant tissues. TIA are derived f rom the shikimate and terpenoid pathways, which supply secologanin and tryptamine, the indole and iridoid moieties, respectively. Secololganin is a terpenoid which is belived to be synthesised the MEP pathway rather than by the acetate/mevalonic acid pathway. Secologanin is thought to be a limiting molecule in the biosynthesis of TIAs. Levels of loganic acid, loganin and secologanin were measured by HPLC using tissue derived from different parts of Catharanthus roseus plants. Higher levels of secologanin were found in second pair of leaves. Transcript levels of genes encoding enzymes involved in the early steps of the iridoid pathway were also monitored by northern blots of RNA f rom C. roseus plants. The effect of the elicitor molecule methyl jasmonate in the transcription of genes was also studied. The results obtained in the present work suggest that in young aerial tissues of the plant, the MEP pathway could be more active than the acetate/mevalonic acid pathway. Moreover, there is a clear effect of MeJA in the transcription of the genes studied.
Key words: Secondary metabolism, terpenoid indol alcaloids, methyl jasmonate, mevalonate pathway, secologanin.
|
||
|
|
||
|
Ph. D. Dirección actual: Max Planck Institute for Plant physiology. Am Muehlenberg 1 14476 Golm-Alemania. Correo electrónico: soicalap@yahoo.com " Ph. D. Jefe de grupo. Molecular biotechnology unit. John Innes Center, Norwich NR4 7UH, UK.
Recibido: marzo 25 de 2004. Aceptado: mayo 17 de 2004.
|
||
|
|
||
|
36
|
||
|
|
||
|
|
|||
|
ANÁLISIS DE IRIDOIDES Y EXPRESIÓN DE GENES EN LA SÍNTESIS DE TIA EN C. roseus
|
|||
|
|
|||
|
INTRODUCCIÓN
Los metabolitos secundarios son compuestos que sin ser esenciales para la supervivencia de células individuales, tienen un papel importante en la vida y supervivencia del organismo como un todo (Walton et al., 1999). Las plantas han desarrollado complejas vías para la biosíntesis de metabolitos secundarios, dichos compuestos están involucrados en interacciones planta-microorganismos, planta-insectos, planta-planta e interacciones planta-vertebrados. Igualmente, los metabolitos secundarios proveen protección contra condiciones abióticas adversas, irradiaciones UV, tolerancia a bajas temperaturas, etc. Desde el punto de vista antropocéntrico, los metabolitos secundarios derivados de plantas han sido utilizados en el transcurso de la historia como saborizantes, esencias, colorantes y como fármacos tradicionales (Kutchan, 1995).
Dentro del gran complejo de metabolitos secundarios se encuentran los alcaloides, los cuales están presentes en un 20-30% de las especies de angiospermas (Harborne, 1982). Catharanthus roseus es una planta medicinal que ha servido de modelo para el estudio y elucidación de la síntesis de alcaloides. Su importancia radica en que acumula, aunque en mínimas cantidades (0.003% peso seco), entre otros compuestos, los alcaloides indol terpenoicos (TIA): vinblastina y vincristina, los cuales tienen gran valor comercial como anticancerígenos (Moreno et al., 1995).
 Triptofano
Triptamina •
Desacetoxi-vindolina
|
te, la enzima 1-deoxi-D xilulosa 5-fosfato sintasa (DXS) cataliza el paso final de la vía del MEP. Así, tanto HMGR como DXS catalizan pasos enzimáticos que ocurren en la interfase entre el metabolismo primario y el metabolismo secundario. Muchas de las reacciones posteriores para la síntesis de secologanina aún no están claramente elucidadas. Pocas son las enzimas que se han purificado y menos aún los genes que se han clonado hasta la fecha. El geraniol es convertido a 10-OH-geraniol por la enzima geraniol-10 hidroxilasa, la cual está asociada a la membrana de la vacuola y, posteriormente, dentro de dicho compartimiento, se sintetiza la secologanina. Estudios recientes en C. roseus (Contin et al., 1998) y en Rauvolfia serpentina(Eichinger, et al., 1999), han sugerido que la loganina es derivada principalmente de la vía del MEP.
Dado que la secologanina es uno de los factores limitantes en la síntesis de TIA, el presente trabajo tiene como objetivo contribuir al estudio de su síntesis y acumulación en la planta. Mediante estudios bioquímicos y moleculares contribuimos a la elucidación e información sobre esta molécula en plantas de C. roseus. Usando HPLC determinamos la
|
||
|
CITOPLASMA
|
|||
|
,- 10-OH-geraniol . . N Mevalonato / v Triptamina
Ó Acido logánico /
oLAMT 4™ Loganina / ^
Estrictosidi na Secologanina
|
|||
|
|
|||
|
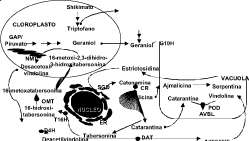
Los intermediarios necesarios para la biosíntesis de TIA son derivados de las vías del shikimato y de los terpenoides; así, los TIA contienen un esqueleto indólico derivado de triptófano y una parte iridoidal dada por secologanina (ver figura 1). Estudios detallados en la regulación de la biosíntesis de TIA han mostrado que la síntesis de secologanina es un factor limitante (Moreno et al., 1993).
Los terpenos son sintetizados a partir de dos vías diferentes del metabolismo primario, la vía del acetato/ácido mevalónico (MVA) y la vía del 2-C-metil-D-eritrol- 4- fosfato (MEP) (Lichtenthaler, et al., 1997). En la vía del acetato/ácido mevalónico, el paso final en la producción de mevalonato es catalizado por la enzima: HMGR (3-hidroxi-3- metil glutaril coenzima A reductasa). Por su par-
|
Vindolina *
|
||
|
Figura 1. Biosíntesis de alcaloides indol terpenóicos en C. roseus. Abreviaturas de las enzimas: TDC: Triptofan decarboxilasa; G10H: geraniol 10-hidroxilasa; LAMT: S-adenosil-L-metionina: lO-metil transferasa del ácido logánico; STR: estrictosidina sintasa; SGD: estrictosidina ß-glucosidasa; CR: catenamina reductasa dependiente de NADPH; POD: peroxidasa; T16H: tabersonina 16-hidroxilasa; OMT: S-adenosil-L-metionina: 16-hidroxitabersonina-16-O-metiltransferasa; NMT: S-adenosil-L-metionina: 16-metoxi-2,3-dihidro-3-hidroxitabersonina-N-metilltransferasa; D4H: desacetoxi-vindolina 4-hidroxilasa; DAT: acetilcoenzima; A: 4-O deacetilvindolina 4-O-acetiltransferasa. Otras abreviaturas, ER: retículo endoplásmico; GAP: gliceraldehído-3-fosfato; AVBL: a-3',4'-anhidrovinblastina.
|
|||
|
|
|||
|
37
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No. 1 Julio 2004 36 - 42
|
|||
|
|
|||
|
distribución de la secologanina y sus precursores, loganina y ácido logánico en la planta. Además, la disponibilidad de cADN que codifican para las enzimas DXS, HMGR y G10H (Maldonado y Nessler, 1992; Collu, et al., 2001), que catalizan las reacciones iniciales en la biosíntesis de secologanina (figura 1), nos ha permitido estudiar la expresión de dichos genes en diferentes partes de la planta de C. roseus. Por último, presentamos el efecto de la molécula elicitora, jasmonato de metilo (MeJA), en los niveles de estos transcriptos en diferentes partes de la planta adulta.
MATERIALES Y MÉTODOS
Propagación de plantas en el invernadero. Las semillas de C. roseus se germinaron en una mezcla 1:1 de compost:suelo y crecieron individualmente en macetas a 25 °C durante el día y 20 °C en la noche, con 16 horas de foto-periodo.
Tratamiento de plantas adultas de C. roseus con jasmonato de metilo (MeJA). Se sembraron individualmente semillas de C. roseus (L). G. Don cv. Little Delicata (J. Moles & Son, Colchester, UK) en suelo para germinación en el invernadero. En todos los experimentos se utilizaron plantas adultas de 8 semanas de edad, contando desde el día de la siembra de la semilla. Las raíces de las plantas fueron lavadas con agua cuidadosamente, con el fin de remover todo el suelo adherido. Luego, 10 plantas fueron sumergidas en 300 mL de solución 100 ^M de MeJA (experimentos M24) y 10 plantas en agua sola (experimentos H24). La caja que contenía las plantas y la solución de MeJA fue puesta dentro de una caja aún más grande, la cual contenía aproximadamente 500 mL de agua; dicha caja fue sellada con parafilm y las plantas fueron incubadas por 24 h bajo las condiciones descritas.
Diferentes partes de la planta fueron colectadas independientemente: ápex y primer par de hojas, segundo par de hojas, tercer par de hojas, tallos y raíces. En experimentos control paralelos, 20 plantas fueron mantenidas en suelo. En el tiempo 0 y 24 h, las raíces de 10 plantas (10 raíces para el tiempo 0 y 10 raíces para el tiempo 24 h) fueron lavadas y colectadas. Estos experimentos fueron llamados P0 y P24.
Extracción de ARN total. Todo el material y los reactivos utilizados para trabajo con ARN estaban libres de ARNasas. La extracción de ARN se hizo
|
con el reactivo Trizol (Gibco BRL) y siguiendo el protocolo propuesto por la casa comercial. Entre 100 y 500 mg peso fresco de tejido fueron macerados con nitrógeno líquido y mezclados con 1 mL de Trizol, luego las muestras fueron incubadas a temperatura ambiente por 10 min. Posteriormente se adicionaron a cada muestra 200 ^L de cloroformo y se mezcló por inversión. Las muestras fueron centrifugadas a 13.000 x g por 10 min a 4 °C. El sobrenadante fue colectado y después de adicionar 500 ^L de isopropanol, las muestras fueron incubadas toda la noche a 4 °C. Luego los ácidos nucléicos fueron colectados por centrifugación a 13 000 x g a 4 °C por 10 min. El precipitado fue lavado con etanol al 70% y secado al aire, para posteriormente resuspenderlo en 50 ^L de agua destilada estéril que contenía 1U de ADNsa, libre de ARNsa. Las muestras se incubaron a 37 °C por 30 min, y para inactivar la enzima las muestras se incubaron 15 min a 65 °C. El volumen de cada muestra fue completado a 100 ^L con agua destilada estéril y luego fueron adicionados 50 ^L de LiCl. Después de incubación toda la noche a 4 °C, el ARN fue colectado por centrifugación a 10.000 x g durante 15 min a 4 °C. Después de disolver el pellet en 100 ^L de agua destilada estéril, el ARN fue reprecipitado con 10 ^L de acetato de sodio 3M pH 5.2 y 250 ^L de etanol 100%. Luego de dos horas de incubación a -20 °C, el ARN fue colectado por centrifugación a 13.000 x g durante 15 min a 4 °C y lavado con 900 ^L de etanol al 70%. Una vez precipitado y secado al vacío, el ARN fue disuelto en 30 ^L de agua destilada estéril y almacenado a -80 °C.
Electroforesis e hibridación de ácidos nucléicos.
Las muestras de ARN total (10- 15 \ig) fueron mezcladas con dos volúmenes de buffer de carga (1 mL de formamida, 350 ^L de formaldehido al 37%, 100 \iL de buffer MOPS/EDTA 10X (acetato de sodio 50 mM, MOPS 0.2 M pH 7.0, EDTA 10 mM) y 3.5 mg de azul de bromofenol). El marcador de peso molecular de ARN fue mezclado con dos volúmenes de buffer de carga y 0.1 ng/mL de bromuro de etidio.
La igualdad en la cantidad de ARN puesto en el gel fue corroborada por tinción del gel, después de la electroforesis, con bromuro de etidio. Posteriormente el gel fue lavado dos veces con agua destilada estéril y el ARN transferido por capilaridad, toda la noche, a una membrana de nylon hybond N (Amersham) usando 2X SSC como buffer de trans-
|
||
|
|
|||
|
38
|
|||
|
|
|||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ANÁLISIS DE IRIDOIDES Y EXPRESIÓN DE GENES EN LA SÍNTESIS DE TIA EN C. roseus
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
A.
|
 |
ferencia. La membrana fue lavada una vez con 2X SSC y el ARN fijado a la membrana aplicando 1200 mJoules por 30 seg.
Los filtros fueron pre-hibridados durante 2 h en dextran sulfato al 10%, buffer SET 4X (NaCl 3M, EDTA pH 8 20 mM, Tris- HCl pH 8 0.6M, tetrasodio pirofosfato 11mM), solución Denhardt's 10X y SDS al 0.1%. Luego, la sonda radiactiva marcada por la técnica de anillamiento al azar fue adicionada y los filtros hibridados toda la noche a 65 °C. Los filtros fueron lavados dos veces con 2X SSC, 0.5% SDS y una vez con 0.1X SSC, 0.5% SDS, cada lavado fue hecho por 20 min. La membrana fue expuesta a películas de rayos X a -80 °C.
Extractos crudos de proteínas. Las muestras (500 mg peso fresco) fueron maceradas en nitrógeno líquido y mezcladas con 0.5 mg de polivinipirrolidona (PVPP) y 500 \iL de buffer frío de extracción (buffer fosfato de sodio pH 7.2 0.2 M, DTT 2 mM, leupetina 10 nM, disulfito de sodio 20 mM). Luego, los extractos fueron centrifugados a 13.000 x g por 20 min a 4 °C. Con el fin de remover las sales, los extractos crudos fueron pasados a través de una columna de Sefadex G-25 equilibrada y eluida con buffer fosfato de sodio pH 7.2 que contenía DTT 2 mM a 4 °C. La concentración de proteínas fue determinada por el método de Bradford usando BSA como estándar (Palacios Rojas, 2000).
Extracción de alcaloides e iridoides. Diferentes órganos de la planta (hojas, tallos, raíces) fueron colocados en nitrógeno líquido y macerados hasta obtener un polvo fino, el cual se secó en frío. Diez miligramos de dicho polvo fueron mezclados con 200 ^L de ácido trifluoroacético al 0.06%, luego las mezclas fueron sonicadas por 30 min y centrifugadas a 13.000 x g por 30 min a temperatura ambiente. El sobrenadante fue transferido a un nuevo tubo y centrifugado a 13.000 x g por 2 min a temperatura ambiente. Las muestras fueron usadas inmediatamente para análisis por HPLC.
Como estándares para el análisis por HPLC se utilizaron ácido logánico, loganina y secologanina comerciales (Extrasinthese, Francia) a una concentración de 20^M en 0.06% ácido trifluoroacético. Los iridoides fueron separados en una columna de Novapack-phenyl usando como buffer fosfato 50 mM (pH 2.15): acetonitrilo: 2-metoxi-etanol: 92.5:2.5:5
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
B.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
C.
|
 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
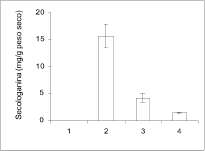
Figura 2. Niveles de iridoides en tejidos de plantas de C. roseus: 1: Primer par de hojas; 2: segundo par de hojas; 3: tallo; 4: raíz. Los niveles de iridoides fueron determinados usando HPLC. A. Ácido logánico. B. Loganina. C. Secologanina. Los resultados son los promedios ± error estándar, n=5 muestras de diferentes plantas.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
39
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 36 - 42
|
||||||
|
|
||||||
|
como eluyente. El sistema estaba equipado con un detector de ultravioleta. La detección de iridoides se realizó a 240 nm.
El análisis de alcaloides (estrictosidina, ajmalicina y serpentina) por HPLC se realizó utilizando los estándares correspondientes comprados en Sigma. Para la separación de dichos compuestos se utilizó una columna LiChosphere 60 RP (Van der Heijden et al., 1987). La detección de alcaloides se realizó a 280 nm.
Ensayo de actividad de metil transferasa del ácido logánico (LAMT). La enzima LAMT cataliza la conversión de ácido logánico a loganina. Una vez removidas las sales de los extractos protéicos, éstos se incubaron a 30 °C por 3 h con 13.5 ^L de ácido logánico 40 mM, 13.5^L de DTT 80 mM y 13.5 ^L de SAM (S- adenosil- L- metionina) 8 mM, en un volumen final de 135 ^L. Para parar la reacción se adicionaron 50 nL de TCA 40%, luego las muestras fueron centrifugadas a 14.000 x g durante 5 min y el sobrenadante se inyectó en la columna de HPLC sistema para detección de irioides con el fin de medir la concentración de loganina (producto final de la reacción enzimática).
RESULTADOS
Niveles de iridoides en plantas de C. roseus. Se
utilizaron diferentes partes de plantas de C. roseus de 8 semanas para determinar en ellas los niveles de iridoides. El ácido logánico fue detectado en todas las partes analizadas (figura 2a), pero los mayores niveles fueron encontrados en el tallo (0.050±0.13 mg/g peso seco). A pesar de la presencia de ácido logánico, no se detectó ninguna actividad de LAMT en los extractos preparados. La loganina fue detectada en raíces (figura 2b) pero los niveles fueron mucho más bajos que los niveles de ácido logánico detectados en el mismo tejido (0.24 ± 0.06 y 0.493 ± 0.08 mg/g peso seco, respectivamente). La secologanina fue detectada en todos los tejidos analizados sin incluir el primer par de hojas. Los mayores niveles de dicho compuesto se encontraron en el segundo par de hojas (15.7 ± 2.16 mg/g peso seco) (figura 2c).
Efecto del jasmonato de metilo en los niveles de transcriptos de genes que codifican enzimas tempranas en la biosíntesis de precursores terpenoides.
Plantas de 8 semanas fueron tratadas con MeJA a 100 ^M durante 24 h. Diferentes partes de la planta fueron colectadas para extracción de ARN y posterior
|
detección de niveles de hmgr, dxs y g10h. En ninguna de las partes de la planta analizadas se detectaron transcriptos de hmgr por hibridación. Por el contrario, experimentos preliminares usando RT-PCR (trascripción reversa-reacción en cadena de la polimerasa), mostraron amplificados en el primer y segundo par de hojas (datos no mostrados). Lo anterior sugiere una baja expresión de hmgr en los tejidos analizados inclusive después de tratamiento con MeJA.
Por otro lado, no se detectaron transcriptos de dxs en raíces en ninguno de los experimentos. Los niveles de dichos transcriptos fueron mayores en el primer par de hojas comparado con los transcriptos encontrados en el segundo par de hojas. El tratamiento de las plantas con MeJA por 24h no tuvo ningún efecto en los niveles de transcriptos de dxs (figura 3).
|
|||||
|
P1 P2 P3 S
|
||||||
|
PO
|
dxs g10h
|
 |
2.1 Kb 1.5 Kb
|
|||
 |
||||||
|
P24
|
dxs g10h
|
 |
2.1 Kb 1.5 Kb
2.1 Kb 1.5 Kb
|
|||
|
H24
|
dxs g10h
|
 |
||||
 |
||||||
|
M24
|
dxs g10h
|
 |
2.1 Kb 1.5 Kb
|
|||
|
Figura 3. Análisis de Northern de plantas de C. roseus con dxs and g1 0h. Las plantas fueron tratadas con MeJA por 24 h. El primer par de hojas y apex (P1), segundo par de hojas (P2), tercer par de hojas (P3) y tallo (S) fueron colectados después del tratamiento. P0: plantas no colocadas en el sistema experimental y colectadas el dia del experimento; P24: plantas no colocadas en el sistema experimental y colectadas 24 h después; H24: tejidos de plantas tratadas con agua durante 24 h bajo las mismas condiciones que las plantas tratadas con MeJA; M24: tejidos de plantas tratadas con MeJA durante 24 h. La cantidad igual de ARN en el gel fue examinada con tinción de bromuro de etidio antes de la transferencia a la membrana.
|
||||||
|
|
||||||
|
40
|
||||||
|
|
||||||
|
|
|||
|
ANÁLISIS DE IRIDOIDES Y EXPRESIÓN DE GENES EN LA SÍNTESIS DE TIA EN C. roseus
|
|||
|
|
|||
|
No se detectaron transcriptos para g10h en raíces. Se detectaron bajos niveles de transcriptos de g10h en plantas P0, P24 y H24. El MeJA incrementó los niveles de transcriptos de g10h en primer, segundo y tercer par de hojas (figura 3).
DISCUSIÓN Y CONCLUSIONES
Varios estudios han demostrado que la regulación de las enzimas involucradas en la biosíntesis de TIA es específica de célula, tejido, órgano, estado de desarrollo y condiciones medio-ambientales (Verpoorte et al., 1998). Además, estudios recientes usando hibridación in situ e inmunolocalización han demostrado la ubicación celular específica de transcriptos y proteínas de algunas de las enzimas de dicha vía metabólica (St- Pierre et al., 1999). Estudios detallados de la expresión génica se han concentrado en la vía indólica en los primeros pasos de la biosíntesis de TIA (tdc y str) o en los últimos pasos de la biosíntesis de vindolina (d4h y dat) (ver figura 1). La disponibilidad de cADN que codifican para DXS, HMGR y G10H, proteínas que catalizan las primeras reacciones en la biosíntesis de secologanina, facilitó los estudios de expresión de los genes correspondientes en plantas adultas de C. roseus. Adicionalmente se detectaron los niveles de precursores de secologanina en plantas adultas de C. roseus.
Se detectó loganina en las raíces de C. roseus pero en muy bajos niveles comparado con secologanina y ácido logánico. Parece ser que la loganina no se acumula en la planta y que, por el contrario, es rápidamente convertida en secologanina. Otra alternativa podría ser que la ruta principal de la biosíntesis de secologanina es la conversión de ácido logánico a ácido secologánico y posteriormente a secologanina. Experimentos realizados en suspensiones celulares de C. roseus en presencia de ácido logánico apoyan la hipótesis anterior, dado que no se detectó ni loganina ni secologanina pero sí estrictosidina, el producto de reacción entre secologanina y triptamina (Palacios Rojas, 2000). Además, se detectaron trazas de ácido logánico en suspensiones celulares.
Tanto loganina como secologanina son compuestos que pueden actuar en contra de depredadores (Rimpler, 1991). Si éste es realmente el caso, la distribución de loganina y secologanina en plantas de C. roseus sugiere que la loganina provee protección en el sistema radicular mientras la secologanina provee protección en las partes aéreas de la planta, especialmente en hojas jóvenes.
|
Estudios anteriores han demostrado que en plantas de C. roseus cada órgano acumula un espectro característico de alcaloides (Sotomayor et al., 1997). Aunque dxs, hmgr y g10h codifican enzimas involucradas en pasos tempranos de la vía biosintética de TIA, su expresión, inducción por MeJA y posible correlación con los niveles de iridoides pueden aportar al entendimiento de dicha vía metabólica en diferentes tejidos. Dentro de los resultados obtenidos en este estudio se encontró mayor expresión de dxs en ápex y primer par de hojas, comparado con otras partes de las plantas. El hecho de no detectar transcriptos de hmgr en el análisis de Northern sugiere que la vía de MEP puede estar más activa que la vía del acetato/ MVA en tejidos aéreos jóvenes de la planta.
Por otro lado, MeJA no tuvo ningún efecto en la expresión ni de dxs ni de hmgr, pero indujo fuertemente los niveles de transcriptos de g10h en los primeros tres pares de hojas. Análisis de los niveles de transcriptos de tdc y str1 en plantas de 8 semanas tratadas con MeJA mostraron patrones similares de inducción como los observados para g10h en las partes aéreas de la planta (Burtin y Palacios-Rojas, datos no publicados). Uniendo todos los hechos, los datos sugieren una regulación coordinada de g10h, tdc y str por MeJA en planta, como ha sido reportado en líneas celulares de C. roseus (Collu et al., 2001). Estudios han demostrado que MeJA incrementa los niveles de TIA en plántulas de C. roseus en desarrollo (Aerts et al. 1994) y de los datos presentados anteriormente se podría decir que el MeJA ejerce su efecto en la biosíntesis de TIA estimulando la trascripción de diferentes genes de una manera coordinada. Hibridaciones in situ e inmunolocalizaciones han mostrado la expresión de enzimas de la biosíntesis de TIA en hojas jóvenes con una disminución en hojas maduras (St-Pierre et al., 1999). Todo lo anterior sugiere que la biosíntesis de precursores iridoides ocurre en las partes aéreas de la planta, y no enlas raíces, como lo sugirieron Wink y Roberts (1998). Sin embargo, se necesitan más datos experimentales en relación con la actividad de G10H y los niveles de TIA en diferentes partes de la planta. Es necesario también determinar el efecto de MeJA en la actividad de G10H y los niveles de iridoides.
AGRADECIMIENTOS
Natalia Palacios Rojas fue apoyada económicamente por una beca doctoral del Instituto Colombiano de Ciencia y Tecnología Francisco José de Caldas
|
||
|
|
|||
|
41
|
|||
|
|
|||
|
|
|||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VI No.1 Julio 2004 36 - 42
|
|||
|
|
|||
|
(Colciencias). El centro de investigación John Innes en Norwich, Inglaterra, apoyó económicamente la realización del presente trabajo.
BIBLIOGRAFÍA
Aerts, J.; De Carolis, E.; De Luca, V.; Baumann, T. 1994. Methyl jasmonate vapor increases the developmentally controlled synthesis of alkaloids in Catharanthus and Cinchona seedlings. Plant J. 5:635-643.
Collu, G.; Unver, N.; Peltenburg, A.; Van der Hiejden, R.; Verpoorte, R.; Memelink, J. 2001. Geraniol 10-hydroxylase, a cytochrome P450 enzyme involved in terpenoid indole alkaloid biosynthesis. FEBS letters. 508:215-220.
Contin, A.; Van der Heijden, R.; Lefeber, A.; Verpoorte, R. 1998. The iridoid glucoside secologanin is derived from the novel triose phosphate/pyruvate pathway in a Catharanthus roseus cell culture. FEBS Letters. 434:413-416.
Eichinger, D.; Bacher, A.; Zenk, M.; Eisenreich, W. 1999. Analysis of metabolic pathways via quantitative prediction of isotope labelling patterns: a retrobiosyntetic 13C NMR study on the monoterpene loganin. Phytochemistry. 51:223-236.
Harborne, J. B. 1982. The plant and its biochemical adaption to the environment. In: Introduction to ecological biochemistry (Harborne, J. B, ed.), London: Academic Press, p. 278.
Kutchan, T. 1995. Alkaloid biosynthesis: the basis for metabolic engineering of medicinal plants. The Plant Cell. 7:1059-1070.
Lichtenthaler, H.; Rohmer, M.; Schwender, J. 1997. Two independent biochemical pathways for isopenthyl diphosphate and isoprenoid biosynthesis in higher plants. Physiol. Plant. 101:643-652.
Lichtenthaler, H.; Rohmer, M.; Schwender, J. 1997. Two independent biochemical pathways for isopenthyl diphosphate and isoprenoid biosynthesis in higher plants. Physiol. Plant. 101:643-652.
Maldonado, I. B.; Nessler, C. 1992. Nucleotide sequence of a cDNA encoding 3-hydroxy-3-methylglutaryl Coenzyme A reductase from Catharanthus roseus. Plant Physiology. 100:1613-1614.
|
Moreno, P.; Heijden, R.; Verpoorte, R. 1993. Effect of terpenoid precursor feeding and elicitation on formation of indole alkaloids in cell suspension cultures of Catharanthus roseus. Plant Cell Reports. 12:702-705.
Moreno, P.; Van der Heijden, R.; Verpoorte, R. 1995. Cell and tissue cultures of Catharanthus roseus: a literature survey, (II. Updating from 1988 to 1993). Plant Cell, Tissue and Organ Culture. 42:1-25.
Palacios Rojas, N. 2000. Metabolismo secundario en plantas: screening molecular de la biodiversidad en flora y estudios de rutas biosintéticas en Lonicera tatarica y Catharanthus roseus. Tesis doctoral, University of East Anglia- John Innes Center, Norwich, UK.
Rimpler, H. 1991. Sequestration of iridoids by insects. In Ecological chemistry and biochemistry of plant terpenoids, J. B. Harbone, F. A. Tomas-Barberan (eds.) Oxford: Oxford Science Publications, pp. 314-330.
Sotomayor, M.; Ros Barcelo, A. 1997. What can we learn from alpha-3',4'- anhydrovinblastine synthase? Recent. Res. Devel. Phytochem. 1:225-233.
St-Pierre, B.; Vásquez-Flota, F. A.; De Luca, V. 1999. Multicellular compartmentation of Catharanthus roseus alkaloid biosynthesis predicts intercellular translocation of a pathway intermediate. Plant Cell 11, 887-900.
Van der Heijden, R.; Lamping, P.; Out, P.; Wijnsma, R.; Verpoorte, R. 1987. High-performance liquid chromatographic determination of indole alkaloids in suspension culture of Tabernaemontana divaricata. Journal of Chromatography. 396:287-295.
Verpoorte, R.; Heijden, R.; Memelink, J. 1998. Plant biotechnology and the production of alkaloids: prospects of metabolic engineering. In The Alkaloids. Chemistry and Biology, G. Cordell (ed.). San Diego, California: Academic Press, pp. 453-499.
Walton, N.; Rhodes, M.; Michael, A.; Parr, A. 1999. Characterisation and control of plant secondary metabolism. In Chemicals from plants, Walton and D. Brown (eds.), London: Imperial College Press, pp. 27-90.
Wink, M.; Roberts, M. 1998. Compartmentation of alkaloid synthesis, transport and storage. In Alkaloids: Biochemistry, ecology, and medicinal applications, M. Roberts and M. Wink (eds.). New York: Plenum Press, pp. 239-261.
|
||
|
|
|||
|
42
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2004 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















