Establecimiento de un medio de cultivo sumergido para una cepa nativa de un hongo Poliporal
Establishment of a submerged culture medium for a native strain of a Poliporal mushroom
Palabras clave:
actividad antioxidante, crecimiento micelial, cultivo sumergido, fenoles, antioxidant activity, mycelial growth, phenol, submerged culture. (es)|
______________ESTABLECIMIENTO DE UN MEDIO DE CULTIVO SUMERGIDO PARA UNA CEPA NATIVA DE UN HONGO POLIPORAL
|
|
Establecimiento de un medio de cultivo sumergido para una cepa nativa de un hongo Poliporal
Establishment of a submerged culture medium for a native strain of a Poliporal mushroom
Carolina Peña Serna", Andrea Sierra Cadavid"", Alex Armando Sáez Vega"",
Benjamín Alberto Rojanom
|
|
|
|
RESUMEN
Se evaluó el efecto de dos velocidades de agitación (80 y 100 rpm), dos fuentes de carbono (glucosa y sacarosa) y tres pH iniciales (5.5, 6.0 y 6.5) sobre la producción de fenoles totales, la actividad antioxidante, el crecimiento micelial y el consumo de sustrato de una cepa nativa de un hongo perteneciente al orden Poliporal en cultivo sumergido.
El mayor crecimiento micelial se obtuvo al día 3 con un valor de 10 g/L a una velocidad de agitación de 80 rpm, sacarosa como fuente de carbono y pH inicial 5.5. La máxima producción de fenoles y actividad antioxidante se presentó este mismo día, alcanzando valores de 0.18 g GAE/L y 0.28 TEAC (mM/mL), respectivamente, para cualquiera de las dos velocidades de agitación evaluadas, con glucosa como fuente de carbono y con pH inicial 6.0 y/o 6.5 para fenoles y pH inicial 5.5 para actividad antioxidante.
Palabras claves: actividad antioxidante, crecimiento micelial, cultivo sumergido, fenoles.
|
|
ABSTRACT
The effect of two agitation speeds (80 and 100 rpm), two carbón sources (glucose and sucrose) and three initial pH (5.5, 6 and 6.5) was evaluated on total phenol production, antioxidant activity, mycelial growth and substrate consumption of a native Poliporal fungi strain in submerged culture.
The greatest mycelial growth (10 g/L) was obtained by the third day with an agitation speed of 80 rpm, sucrose as carbón source and initial 5.5 pH. Máximum phenol production and antioxidant activity were observed on the same day, reaching 0.18 g GAE/L and 0.28 TEAC (mM/mL) valúes, respectively, for both agitation speeds using glucose as carbón source and an initial 6.0 and/or 6.5 pH for phenol and initial pH 5.5 for antioxidant activity.
Keywords: antioxidant activity, mycelial growth, phenol, submerged culture.
|
|
Recibido: agosto 01 de 2005 Aceptado: diciembre 15 de 2005
|
|
|
|
Ingeniera de Procesos. Candidata MSc. Biotecnología. Correo electrónico: cpenaser@eafit.edu.co
Ingeniera de Procesos. Correo electrónico: asierrac@eafit.edu.co
Químico. MSc. Biotecnología. Departamento de Ing. de Procesos, Universidad Eafit. Correo electrónico: asaez@eafit.edu.co
Químico. MSc. Ciencia de los Alimentos. Laboratorio Ciencia de los Alimentos, Universidad Nacional de Colombia, sede Medellín. Correo electrónico: brojano@unalmed.edu.co
|
|
5
|
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 5-13----------------------------------------------------------------------------------------------
|
|
|
|
|
|
INTRODUCCIÓN
Los fenoles son considerados de interés debido a su actividad como antioxidantes; estos œltimos son una serie de compuestos con estructuras químicas variadas cuyo mecanismo de acción es su capacidad para reaccionar con los radicales libres de los lípidos, formando productos inactivos (Pokorny, 2001).
Cuando hay un exceso de radicales libres dentro del organismo se pueden causar efectos destructivos y/o letales debido a oxidación de membranas lipídicas, proteínas celulares, DNA y enzimas (Antolovich et ál., 2002), que son causantes de enfermedades degenerativas asociadas con el envejecimiento, como es el caso del cáncer, los problemas cardiovasculares, el decaimiento del sistema inmune, la disfunción cerebral y las cataratas (Ames et ál., 1993; Fraga et al., 1990). Además de generar problemas en el organismo, la oxidación es una de las principales causas del deterioro de pinturas, aceites lubricantes, fibras sintéticas, caucho y plásticos (Nishiyama et al., 2001). En los alimentos esta oxidación produce alteraciones en el color, el sabor, la textura y el valor nutricional (Jialal y Devaraj, 1996).
Se ha explorado la capacidad para producir fenoles a partir de algunos hongos como fuente alterna a las frutas y verduras. Algunos de los hongos hasta el momento estudiados son: Lentinus edodes, Volvahella volvacea (Cheung y Cheung, 2005; Cheung et ál., 2003), Paxillus panuoides (Yun et al., 2000), Agrocybe Aegerita (Lo y Cheung, 2005), Antrodia camphorata (Mau et ál., 2005), Ganoder-ma tsugae, Ganoderma formosanum, Ganoderma lucidum y Ganoderma gibbasum (Yen y Wu, 1999). Estos estudios han sido realizados a partir de cuerpo fructífero, pero dado que publicaciones anteriormente realizadas sobre cultivo sumergido de otros metabolitos han demostrado una disminución en los tiempos de crecimiento y producción (Lee et ál., 1999; Yang y Liau, 1998; Sone et ál., 1985 ) y también de un incremento en la productividad y calidad del producto (Fang y Zhong, 2002a) comparado con la obtenida a partir de cuerpo fructífero, se decidió evaluar la producción de compuestos fenólicos extracelulares y su capacidad antioxidante, además del crecimiento micelial y consumo de sustrato de una cepa nativa de un
|
hongo Poliporal en cultivo sumergido bajo condiciones controladas.
MATERIALES Y MÉTODOS
Microorganismo y medio de cultivo. Se utilizó la cepa nativa de un hongo perteneciente al orden Poliporal, recolectada en el Club El Rodeo de la ciudad de Medellín, que aún se encuentra en evaluación para su clasificación taxonómica. Esta cepa se mantuvo en caja Petri con Agar Extracto de Malta (MEA), se incubó a 30 °C por 8 días y finalmente fue almacenada a 4 °C por 4 semanas.
El medio de cultivo empleado es el descrito por Maziero y colaboradores (1999) con modificación en la fuente de carbono y pH inicial. La composición del medio (g/L) es: Peptona 1, Extracto de levadura 2, KjHPC^ 1, (NH4)2SO4 5, MgSO4 0.2, Sacarosa 39.
Condiciones de crecimiento. Erlenmeyers de 250 mL con 50 mL de medio de cultivo se esterilizaron a 120 °C por 15 min, el pH requerido se ajustó con HCl al 10% y posteriormente se sembró en cada erlenmeyer un cuadro de 1cm2 proveniente de la cepa; finalmente, los erlemeyers se agitaron por un período de 10 días en un agitador orbital New Brunswick Scientific segœn la velocidad de agitación requerida.
Evaluación del crecimiento micelial. La biomasa se cuantificó por filtración al vacío a través de un papel filtro previamente pesado. Una vez terminada la filtración, el papel filtro con la biomasa se secaron a 50°C hasta alcanzar peso constante. Los resultados se expresaron como gramos de biomasa seca por litro de medio de cultivo (g/L).
Evaluación del consumo de sustrato. Se empleó el método de ácido dinitrosalicílico (DNS) (Miller, 1959) y un espectrofotómetro Helios G S/N 113613 para cuantificar el azœcar residual presente en el medio de cultivo. Adicionalmente, fue necesario hacer una hidrólisis a la sacarosa con HCl al 10%, calentamiento, enfriamiento, NAOH 1N y finalmente se cuantifica con DNS (Miller, 1959).
Los resultados se expresaron en g/L (gramos equivalentes de glucosa por litro de medio de cultivo).
|
|
6
|
|
|
ESTABLECIMIENTO DE UN MEDIO DE CULTIVO SUMERGIDO PARA UNA CEPA NATIVA DE UN HONGO POLIPORAL
|
|||
|
|
|||
|
Evaluación de la producción de fenoles totales.
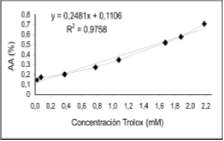
Los fenoles totales se cuantificaron por reducción con el reactivo de Folin - Ciocalteu (Parejo et ál., 2002). Se empleó una curva de calibración de ácido gálico (ver figura 3) para determinar el contenido fenólico del medio de cultivo. Los resultados se expresaron en gramos equivalentes de ácido gálico, GAE, por litro de medio de cultivo (g GAE/L). Para su medición se utilizó el espectrofotómetro JENWAY 6405 UV/VIS.
Evaluación de la actividad antioxidante. Se empleó el método de la reacción con el radical ABTSO+ (Arnao et ál., 1999) para la cuantificación de la actividad antioxidante (AA) de los compuestos extracelulares producidos por el hongo la cual se determinó con:
|
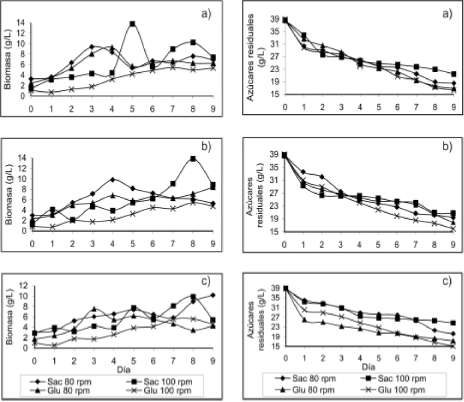
figura 1a y 1b presentan el máximo crecimiento de 10 g/L (excluyendo el día 5 Sac, 100 rpm, pH 5.5 y el día 8 Sac, 100 rpm, pH 6.0) en el día 3 con el tratamiento Sac, 80 rpm, pH 5.5 y al día 4 con los tratamientos Glu, 80 rpm, pH 5.5 y Sac, 80 rpm, pH 6.0. La Figura 1c muestra los más bajos crecimientos con un máximo de 7 g/L para el día 3 con el tratamiento Glu, 80 rpm, pH 6.5 y al día 5 con los tratamientos Sac, 80 y 100 rpm, pH 6.5. Finalmente, se pudo determinar que el hongo presentó mayor crecimiento cuando se empleó sacarosa como fuente de carbono, velocidad de agitación baja (80 rpm) y pH bajos (5.5 y 6.0).
Fang y Zhong (2002b) evaluaron la influencia del pH inicial sobre el crecimiento micelial de Ga-noderma lucidum, en un rango desde 3.5 hasta 7.0, obteniendo mayores crecimientos a pH inicial 6.5, 7.0 y 5.5, lo cual indicó que los pH iniciales evaluados en este trabajo fueron apropiados, puesto que G. lucidum también presentó mayores concentraciones de biomasa en ese mismo rango; aunque el comportamiento de ambos hongos es opuesto, dado que G. lucidum presentó mayor crecimiento a pH altos (6.5, 7.0), mientras el hongo Poliporal presentó mayor crecimiento a pH bajos (5.5 y 6.0).
Yang y Liau (1998) evaluaron velocidades de agitación desde 50 hasta 250 rpm para observar la variación en el crecimiento micelial de G. lucidum, reportando 100 rpm como la mejor velocidad de agitación. Ambos hongos presentaron un comportamiento similar puesto que a bajas velocidades de agitación hubo mayor crecimiento micelial.
Evaluación del consumo de sustrato. El consumo de sustrato de la cepa nativa del hongo Poliporal se evaluó para un período de 10 días teniendo en cuenta el día 0.
La figura 2a no presenta diferencia significativa para el consumo de sustrato segœn los tratamientos evaluados, al igual que la figura 2b, sin embargo, fue notorio el alto consumo que presentó el tratamiento glucosa, 100 rpm, pH 6.0, lo cual indicó un bajo rendimiento en la conversión del sustrato en biomasa, puesto que fueron glucosa y 100 rpm los factores que menor crecimiento presentaron. En la figura 2c se puede apreciar que los tratamientos con glucosa presentan menor con-
|
||
|
|
|||
|
AA(%H1-
|
í Abs muestra — Abs blanco muestra \
|
|
|
|
|
|||
|
I Abs control — Abs blanco control I
|
|
||
|
I
|
|||
|
Los blancos contienen 990 mL de buffer fosfato + 10 mL de agua para el control o 10 mL de muestra para la muestra.
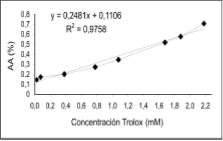
Se preparó una curva de calibración de Trolox (ver Figura 5) en un rango de 0.05 hasta 2.2 mM; para calcular la AA de las muestras se expresa como capacidad antioxidante de equivalentes Trolox (TEAC) en mM/mL (Lo y Cheung, 2005); las mediciones se realizaron en el espectrofotómetro JENWAY 6405 UV/VIS.
Para realizar las fermentaciones se desarrolló un diseæo de tipo factorial, modelo 22x3 (doce tratamientos y tres réplicas por cada uno). Adicionalmente, para el análisis estadístico de los resultados se empleó el software Statgraphics versión 2.0 y un nivel de confianza del 95%.
|
|||
|
RESULTADOS Y DISCUSIÓN
Evaluación del crecimiento micelial. Se evaluó el crecimiento micelial de la cepa nativa del hongo Poliporal durante un período de 10 días, teniendo en cuenta el día 0 y sometida a cambios en nutrientes, condiciones físicas y químicas. La
|
|||
|
|
|||
|
7
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 5-13________________________________________________________
|
|
|
|
|
 |
|
|
|
|
|
Figura 1. Cinética de crecimiento micelial para la cepa nativa del hongo Poliporal segœn el pH inicial. 5.5 (a), 6.0 (b) y 6.5 (c)
|
Figura 2. Cinética de consumo de sustrato para la cepa nativa del hongo Poliporal segœn el pH inicial. 5.5 (a), 6.0 (b) y 6.5 (c)
|
|
|
|
|
centración de azúcares residuales y a su vez presentaron menor crecimiento micelial, por lo tanto, esta fuente de carbono exhibió bajo rendimiento de sustrato en biomasa.
Se observó mayores concentraciones de sacarosa al final de la fermentación; adicionalmente, fue esta fuente de carbono la que presentó mayor crecimiento micelial, esto muestra mayor rendimiento en la conversión de sacarosa en biomasa, puesto que el hongo requirió menores cantidades de sacarosa para alcanzar un mayor crecimiento.
|
Evaluación de la producción de fenoles totales.
El contenido fenólico presente en el medio de cultivo empleado para el crecimiento del hongo Poliporal fue determinado como equivalente de ácido gálico (GAE), respecto a la curva de calibración que se muestra en la figura 3.
La figura 4a presenta las concentraciones fenólicas más bajas, lo que muestra claramente a la glucosa como la fuente de carbono que favorece la producción de fenoles a partir del hongo. Adicionalmente, las figuras 4a y 4b presentan mayor
|
|
|
|
|
8
|
|
|
|
|||
|
ESTABLECIMIENTO DE UN MEDIO DE CULTIVO SUMERGIDO PARA UNA CEPA NATIVA DE UN HONGO POLIPORAL
|
|||
|
|
|||
 |
Lo y Cheung (2005) reportaron un contenido fenólico de 0.0512 ± 0.00038 g GAE/g extracto, en la fracción extraída con acetato de etilo del cuerpo fructífero de Agrocybe aegerita.
Las cantidades fenólicas reportadas en este trabajo comprendidas en un rango de 0.08 a 0.18 g GAE/L (exceptuando el día 6 glucosa, pH 6.0, 100 rpm) son superiores a las reportadas en el cuerpo fructífero de Agrocybe aegerita.
Mau y colaboradores (2004) en su estudio con micelio rojo y blanco de A. camphorata reportaron concentraciones fenólicas de 0.00287 y 0.0029 g GAE/g de extracto respectivamente. Ambos micelios presentaron concentraciones fenólicas inferiores a las halladas para la cepa nativa del hongo Poliporal.
En el estudio realizado por Cheung y Cheung (2005) sobre el cuerpo fructífero de Lentinula edodes y Volvariella volvacea se reportaron concentraciones fenólicas de 0.0145 ± 0.0027 y 0.0854 ± 0.0027 g GAE/g de extracto respectivamente. V. volvacea presentó mayor contenido fenólico respecto al hongo Poliporal sólo en tres tratamientos, dos en el día 6 glucosa, pH 6.0 y 6.5, 100 rpm y en el día 9 sacarosa, pH 5.5, 80 rpm; sin embargo, si se tienen en cuenta las concentraciones fenólicas máximas alcanzadas por la cepa nativa del hongo Poliporal, Estas son superiores a las reportadas para V. volvacea.
Las cantidades de fenoles reportadas en este trabajo son superiores a las alcanzadas en otros estudios realizados en cuerpo fructífero de varios hongos, esto demuestra que la producción de fenoles a partir de cultivo sumergido de la cepa nativa del hongo Poliporal es una buena alternativa dadas las altas concentraciones encontradas en el medio de cultivo. Además, no se requieren largos tiempos para realizar las extracciones ni de solventes costosos puesto que estos compuestos son extracelulares.
Evaluación de la actividad antioxidante. A continuación se presentan los resultados obtenidos para la actividad antioxidante (AA) de los compuestos extracelulares. Los resultados se expresaron como
|
||
|
Figura 3. Curva de calibración de ácido gálico
|
|||
 |
|||
|
Figura 4. Producción de fenoles por la cepa nativa del hongo Poliporal, segœn los tratamientos evaluados: sacarosa (a) y glucosa (b)
|
|||
|
producción de estos compuestos a pH altos (6.0 y 6.5) y velocidades de agitación bajas (excepto al día 3, al día 6 pH 6.0 y al día 9 pH 5.5 figura 4a), aunque no es muy significativa la diferencia.
Finalmente, las concentraciones mayores de fenoles se hallaron al día 3 con los tratamientos glucosa, pH 6.5, 80 y/o 100 rpm con un valor de 0.18 g GAE/L, seguido de los tratamientos glucosa, pH 6.0, 80 y/o 100 rpm con un valor de 0.17 g GAE/L.
|
|||
|
|
|||
|
9
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 5-13
|
|||
|
|
|||
|
Capacidad Antioxidante Equivalente Trolox (TEAC), empleando la curva de calibración que se muestra en la figura 5.
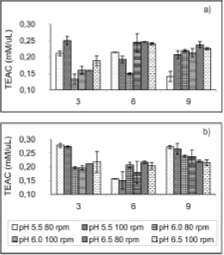
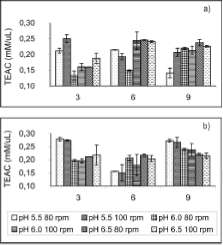
En la figura 6a se presentan las menores AA, lo que demuestra que glucosa fue la fuente de carbono que influyó más eficientemente en la AA producida por el hongo en cultivo sumergido. Las velocidades de agitación evaluadas no presentaron una diferencia significativa en su efecto sobre la AA, mientras que a pH inicial 5.5, seguido de pH 6.5, se presentaron las más altas AA.
|
En el caso de la fuente de carbono sacarosa (figura 6a) hay una relación directamente proporcional entre la concentración fenólica y la AA, mientras en el caso de glucosa (figura 6b) no sucedió este mismo efecto, dado que la mayor concentración fenólica se presentó a pH 6.5, mientras la mayor AA se presentó a pH 5.5, esto demostró que el tratamiento glucosa, pH 5.5, 80 y/ o 100 rpm contribuyó en la producción de algún otro compuesto extracelular que no fue cuantificado en este trabajo pero que produjo AA.
Se encontraron mayores AA al día 3 para los tratamientos glucosa, pH 5.5, 80 y 100 rpm con valores de 0.28 y 0.27 mM Trolox/mL de medio de cultivo respectivamente.
En el estudio realizado por Lo y Cheung (2005) se reportó una TEAC de 0.254 ± 0.021 mM/mg de extracto de cuerpo fructífero de A. aegeríta, para la fracción extraída con acetato de etilo. Se observó que la AA producida por el hongo Poliporal fue mayor, con un valor de 0.28 mM/mL.
Finalmente, se comprobó que los fenoles extracelulares producidos por la cepa nativa del hongo Poliporal tienen una buena AA, lo que muestra la potencialidad de este hongo y del tipo de producción, cultivo sumergido.
|
||
 |
|||
|
Figura 5. Curva de calibración de Trolox
|
|||
 |
|||
|
CONCLUSIONES
El crecimiento micelial en cultivo sumergido de la cepa nativa del hongo Poliporal tuvo una duración entre 10 y 12 días según la fuente de carbono empleada, la velocidad de agitación y el pH inicial del medio de cultivo. Adicionalmente, presentó la más corta fase de adaptación.
Se determinó que el crecimiento micelial de la cepa nativa del hongo Poliporal en cultivo sumergido, es afectado por los factores evaluados en este trabajo, siendo pH iniciales bajos, velocidad de agitación baja y sacarosa como fuente de carbono, los factores que mejor respuesta presentaron.
Se encontró un valor máximo de biomasa de 10 g/L al día 3 con el tratamiento sacarosa, pH 5.5,
|
|||
|
Figura 6. Evaluación de la actividad antioxidante producida por la cepa nativa del hongo Poliporal, segœn los tratamientos evaluados. Sacarosa (a) y glucosa (b)
|
|||
|
|
|||
|
10
|
|||
|
|
|||
|
|
|||
|
ESTABLECIMIENTO DE UN MEDIO DE CULTIVO SUMERGIDO PARA UNA CEPA NATIVA DE UN HONGO POLIPORAL
|
|||
|
|
|||
|
80 rpm y al día 4 con los tratamientos glucosa, 80 rpm, pH 5.5 y sacarosa, 80 rpm, pH 6.0.
Se determinó mayor rendimiento en la conversión de sacarosa en biomasa que de glucosa en biomasa.
La producción de compuestos fenólicos presentó un comportamiento opuesto al obtenido para crecimiento micelial. Se determinó la máxima producción al día 3 con un valor de 0.18 g GAE/L, para el tratamiento glucosa, pH 6.5, 80 y/o 100 rpm.
La actividad antioxidante de los compuestos extracelulares producidos por la cepa nativa del hongo Poliporal es afectada por la fuente de carbono y por el pH inicial del medio de cultivo, mientras que la agitación no generó un efecto significativo. Se determinó un valor máximo de 0.28 TEAC (mlWmL) para el día 3 cuando se empleó el tratamiento glucosa, pH 5.5, 80 y/o 100 rpm.
En los tratamientos donde se empleó sacarosa como fuente de carbono, la actividad antioxidante está directamente relacionada con la cantidad de compuestos fenólicos generados por el hongo.
Se determinó que el pH 5.5 y la glucosa como fuente de carbono estimularon la producción de algœn otro compuesto extracelular que no fue cuantificado en este trabajo pero que generó actividad antioxidante.
El cultivo sumergido de la cepa nativa del hongo Poliporal es una buena alternativa para la producción de compuestos antioxidantes, ya que la concentración de fenoles y la actividad antioxidante alcanzadas en este estudio fueron superiores a las reportadas para extractos del cuerpo fructífero de otros hongos.
|
Ala Ingeniera Química Ana María Zapata y al asistente del laboratorio de Biotecnología de la Universidad Eafit, seæor Sigifredo Cárdenas, por su valiosa colaboración.
|
||
|
REFERENCIAS
Ames, B. N.; Shigenaga, M. K.; Hagen, T. M. 1993. Oxidants, antioxidants and the degenerative diseases of aging. Proceedings of the National Academy of Sciences of the United States of América. 90: 7915 - 7922. Citado por: Cheung, L.M.; Cheung, P.C.K.; Ooi, V.E.C. 1993. Antioxidant activity and total phenolics of edible mushroom extracts. Food Chemistry. 81: 249 -255.
Antolovich, M.; Prenzler, R; Patsalides, E.; McDonald, S.; Robards, K. 2002. Methods for testing antioxidant activity. Analyst. 127: 183 - 198.
Arnao, M.; Cano, A.; Acosta, M. 1999. Methods to measure the antioxidant activity in plant material. A comparative discussion. Free Rad Res. 31: 89-96.
Breene, W.M. 1990. Nutricional and Medicinal valué of speciality mushrooms. Journal of Food Protection. 53: 883 - 894. Citado por: Cheung, L.M.; Cheung, R 2005. Mushroom extracts with antioxidant activity against lipid peroxidation. Food Chemistry. 89: 403 - 409.
Cheung, L.M.; Cheung, P.C.K. 2005. Mushroom extracts with antioxidant activity against lipid peroxidation. Food Chemistry, 89: 403 - 409.
Cheung, L.M.; Cheung, P.C.K.; Ooi, V.E.C. 2003. Antioxidant activity and total phenolics of edible mushroom extracts. Food Chemistry, 81: 249 -255.
Fang, Q.; Zhong, J. 2002a. Submerged fermentation of higher fungus Ganoderma lucidum for production of valuable bioactive metabolites — ganoderic acid and polysaccharide. Biochemical Engineering Journal, 10: 61 - 65.
Fang, Q.; Zhong, J. 2002b. Effect of initial pH on production of ganoderic acid and polysaccharide by submerged fermentation of Ganoderma lucidum. Process Bioquemistry, 37: 769-774.
Fraga, C.G.; Shigenaga, M.K.; Park, J.W.; Degan, P.; Ames, B. N. 1990. Oxidative damage to DNA
|
|||
|
AGRADECIMIENTOS
Los autores expresan su agradecimiento a la Universidad Eafit y a la Universidad Nacional de Colombia, Sede Medellín, por permitirnos emplear sus instalaciones para la realización de las experimentaciones.
|
|||
|
|
|||
|
11
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 5-13
|
|||
|
|
|||
|
during aging: 8-hydroxy-20-deoxyguanosine in rat organ DNA and uriñe. Proceedings of the National Academy of Sciences of the United States of América, 87: 4533-4537. Citado por: Cheung, L.M.; Cheung, P.C.K.; Ooi, V.E.C. 2003. Antioxidant activity and total phenolics of edible mushroom extracts. Food Chemistry, 81: 249 -255.
Hirose, K.; Muto, S.; Niimura, K.; Ohara, M.; Oguchi, Y.; Matsunaga, K.; Kadochi, J.; Sugita, N.; Furushu, T.; Yoshikumi, O; Takahashi, M. 1988. Antiviral Agent. J.P. Patente No. 63316734. Citado en: Berovic, M.; Habijanic, J.; Zore, I.; Wraber, B.; Hodzar, D.; Boh, B.; Pohleven, F. 2003. Submerged cultivation of Ganoderma lucidum biomass and immunostimulatory effects of fungal polysaccharides. Journal of Biothecnology, 103: 77- 86.
Jialal, I.; Devaraj, S. 1996. Low-density lipoprotein oxidation, antioxidants, and atherosclerosis: A clinical biochemistry perspective. Clinical Chemistry, 42: 498 - 506. Citado por: Cheung, L.M.; Cheung, P.C.K. 2005. Mushroom extracts with antioxidant activity against lipid peroxidation. Food Chemistry, 89: 403 - 409.
Kajiyama, T.; Ohkatsu, Y. 2002. Effect of meta substituents of phenolic antioxidants—proposal of secondary substituent effect. Polymer Degradation and Stability, 75: 535 - 542.
Lee, K.M.; Lee, S.Y.; Lee y Bistage, H.Y. 1999. Control of pH for improving exopolysaccharide production from mycelia of Ganoderma lucidum in an air-lift fermentor. Journal of Bioscience Bioengineering, 88: 646-650. Citado por: Fang, Q.; Zhong, J. Submerged fermentation of higher fungus Ganoderma lucidum for production of valuable bioactive metabolites-ganoderic acid and polysaccharide. Biochemical Engineering Journal, 10:2002,61 -65.
Lo, K.M.; Cheung, P. 2005. Antioxidants activity of extracts from fruiting bodies of Agrocybe aegerita var alba. Food Chemistry, 89: 533 - 539.
Madhavi, D.L.; Deshpande, S.S.; Salunkhe, D.K. 1995. Food Antioxidants. Marcel Dekker, Inc. New York, USA, p. 65-67.
Mau, J.L.; Huang, P.N.; Huang, S.J.; Chen, C.C. 2004. Antioxidant properties of methanolic extracts from two kinds o^ Antrodia camphorata mycelia. Food Chemistry, 86: 25 - 31.
Maziero, R.; Cavazzoni, V.; Ramos, V.L. 1999. Screening of Basidiomycetes for the Production
|
of Exopolysaccharide and biomass In Submerged Culture. Revista de microbiología, 30: 77-84.
Miller, G.L. 1959. Use of dinitrosalicilic acid reagent for determination of reducing sugar. Analytical Chemistry. 31 - 426.
Nishiyama, T.; Sugimoto, T.; Andoh, Y. 2001. Antioxidant activity of phenols in intramolecularly cooperating stabilizing systems. Polymer Degradation and Stability, 74: 189-193.
Parejo, I.; Viladomat, F.; Bastida, J.; Rosas-Romero, A.; Flerlage, N.; Burillo, J.; Codina, C. 2002. Comparison between the radical scavenging activity and antioxidant activity of six distilled and nondistilled Mediterranean herbs and aromatic plants. Journal of Agriculture and Food Chemistry, 50: 6882 - 6890. Citado por: Katsube, T.; Tabata, H.; Ohta, Y; Yamasaki, Y; Anuurad, E.; Shiwaku, K.; Yamane, Y. 2004. Screening for Antioxidant Activity in Edible Plant Products: Comparison of Low-Density Lipoprotein Oxidation Assay, DPPH Radical Scavenging Assay, and Folin-Ciocalteu Assay. Journal of Agricultura! and Food Chemistry, 52: 2391 -2396.
Pokorny, J.; Yanishlieva, N.; Gordon, M. 2001. Antioxidants in Food. Woodhead Publishing Ltd. Cambridge, Inglaterra, 1-3.
Soné, Y;0kuda, R.; Wada, N.; Kishida, E.; Misaki.A. 1985. Structures and antitumor activities of the polysaccharides isolated from fruiting body and the growing fermentation of mycelium of Ganoderma lucidum. Agricultura! Biológica! Chemistry, 49, p. 2641-2653. Citado por: Fang, Q. y Zhong, J. 2002. Submerged fermentation of higher fungus Ganoderma lucidum for production of valuable bioactive metabolites—ganoderic acid and polysaccharide. Biochemical Engineering Journal, 10: 61 -65.
Weisburger, J.H. 1999. Mechanisms of action of antioxidants as exemplified in vegetables, tomatoes, and tea. Food and Chemical Toxicology. 37: 943 - 948. Citado por: Cheung, L.M.; Cheung, P.C.K.; Ooi, V.E.C. 2003. Antioxidant activity and total phenolics of edible mushroom extracts. Food Chemistry, 81: 249 -255.
Yang, F.C.; Liau, C.B. 1998. Effects of cultivating conditions on the mycelial growth of Ganoderma lucidum in submerged flask cultures. Bioprocess Engineering, 19: 233 - 236.
|
||
|
|
|||
|
12
|
|||
|
|
|||
|
|
||
|
ESTABLECIMIENTO DE UN MEDIO DE CULTIVO SUMERGIDO PARA UNA CEPA NATIVA DE UN HONGO POLIPORAL
|
||
|
|
||
|
Yen, G.C.; Wu, J.Y. 1999. Antioxidant and radical with free radical scavenging activity. Journal of
scavenging properties of extracts from Ganoder- Microbiology and Biotechnology, 10: 233 - 237.
ma tsugae. Food Chemistry, 65: 375 - 379. Citado por: Lo, K.M.; Cheung, P. 2005.
Antioxidant activity of extracts from the fruiting
Yun, B. S.; Lee, I.K.; Kim, J.P.; Yoo, I.D. 2000. Two p- bodies of Agrocybe aegerita var. alba. Food
terphenyls from mushroom Paxillus panuoides Chemistry, 89: 533 - 539.
|
||
|
|
||
|
13
|
||
|
|
||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2006 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















