Estudios preliminares en la estandarización de un protocolo para la obtención de callos embriogénicos en dos clones de caucho (Hevea brasiliensis Müll. Arg.) de diferentes orígenes geográficos
Premilinary studies for optimiziing a protocol for obtaining embryogenic calluses in two rubber (Hevea brasiliensis Mull. Arg) clones from different geographical origins
Palabras clave:
Hevea brasiliensis, iniciación de callogénesis, callo friable, cultivo in vitro, caucho natural, callogénesis initiation, friable calli, in vitro culture, natural rubber (es)Se investigó la influencia de los reguladores de crecimiento para la obtención de callos friables en caucho (Hevea brasiliensis Müll. Arg.) sin llegar a obtenerse regeneración de plántulas. En todos los ensayos realizados en este estudio, se utilizaron dos clones de diferentes orígenes geográficos: el FX 3864 (suramericano) y el PB 254 (asiático). Para los diferentes tratamientos se utilizaron como explantes hojas jóvenes e integumento de semillas de ocho a diez semanas de edad de ambos clones, los cuales se cultivaron inicialmente en los medios MH (Carron, et ál., 1989), MH modificado (Montoro, et ál., 1993, 2000) y el MS modificado (Carron, et ál., 1992), sin obtener ninguna respuesta a los 25 y a los 50 días. Sin embargo, se realizaron otros ensayos con el integumento en el medio de cultivo MS (Murashige and Skoug,1962) modificado con la adición de 0.67 mg/L de BAP y 0.66 mg/L de 2-4 D, como medio para la iniciación de embriogénesis, observándose a los 25 días la formación de callos friables y de color blanco, en los dos clones seleccionados. Estos callos fueron subcultivados en medio MS (1962) suplementado con 0.35 mg/L de BAP y 0.2 mg/L de 2-4 D como medio de expresión de callogénesis, observando a los 50 días expresión embriogénica en ambos clones. Igualmente se obtuvo callo friable de color blanco a partir de hojas jóvenes en los dos clones en medio de cultivo MS suplementado con 1.0 mg/L de BAP, 1.0 mg/L de ANA pero sin IBA y kinetina a los 25 días. Callos subcultivados en el mismo medio suplementado con 0.5 mg/L de BAP y 0.5 mg/L de ANA, presentaron una mejor consistencia de callo friable después de 50 días de cultivo. Este trabajo es un informe parcial de un macroproyecto sobre la optimización de un protocolo para la multiplicación de caucho (Hevea brasiliensis) vía embriogénesis somática.
Equally friable white calluses were obtained from young leaves in the two clones in MS medium supplemented with 1.0 mg/L BAP, 1.0 mg/L ANA but without IBA and kinetin by day 25. Calluses sub-cultured in the same medium supplemented with 0.5 mg/L BAP and 0.5 mg/L ANA began to show increased friability after 50 days. culture. This work is a partial report of a macro-project for optimising a protocol for rubber (Hevea brasiliensis) multiplication by somatic embryogenesis.
|
|
||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
||
|
|
||
|
Estudios preliminares en la estandarización de un protocolo para la obtención de callos embriogénicos en dos clones de caucho (Hevea brasiliensis Müll. Arg.) de diferentes orígenes
geográficos
Preliminary studies for optimizing a protocol for obtaining
embryogenic calluses in two rubber (Hevea brasiliensis Müll.
Arg. ) clones from different geographical origins
Santiago Cadavid Ruiz', César Augusto Hernández Rendórí, Rodrigo Hoyos S." Marisol Medina S."~, Luis Fernando Restrepo""
RESUMEN
Se investigó la influencia de los reguladores de crecimiento para la obtención de callos friables en caucho (Hevea brasiliensis Müll. Arg.) sin llegar a obtenerse regeneración de plántulas. En todos los ensayos realizados en este estudio, se utilizaron dos clones de diferentes orígenes geográficos: el FX 3864 (suramericano) y el PB 254 (asiático). Para los diferentes tratamientos se utilizaron como explantes hojas jóvenes e integumento de semillas de ocho a diez semanas de edad de ambos clones, los cuales se cultivaron inicialmente en los medios MH (Carrón, et ál., 1989), MH modificado (Montoro, et ál., 1993, 2000) y el MS modificado (Carrón, et ál., 1992), sin obtener ninguna respuesta a los 25 y a los 50 días. Sin embargo, se realizaron otros ensayos con el integumento en el medio de cultivo MS (Murashige and Skoug,1962) modificado con la adición de 0.67 mg/L de BAP y 0.66 mg/L de 2-4 D, como medio para la iniciación de embriogénesis, observándose a los 25 días la formación de callos friables y de color blanco, en los dos clones seleccionados. Estos callos fueron subcultivados en medio MS (1962) suplementado con 0.35 mg/L de BAP y 0.2 mg/L de 2-4 D como medio de expresión de callogénesis, observando a los 50 días expresión embriogénica en ambos clones. Igualmente se obtuvo callo friable de color blanco a partir de hojas jóvenes en los dos clones en medio de cultivo MS suplementado con 1.0 mg/L de BAP, 1.0 mg/L de ANA pero sin IB A y kinetina a los 25 días. Callos subcultivados en el mismo medio suplementado con 0.5 mg/L de BAP y 0.5 mg/L de ANA, presentaron una mejor consistencia de callo friable después de 50 días de cultivo. Este trabajo es un informe parcial de un macroproyecto sobre la optimización de un protocolo para la multiplicación de caucho (Hevea brasiliensis) vía embriogénesis somática.
Palabras clave: Hevea brasiliensis, iniciación de callogénesis, callo friable, cultivo in vitro, caucho natural.
ABSTRACT
The influence of growth regulators on obtaining friable rubber (Hevea brasiliensis Müll. Arg.) calluses with no plant regeneration was investigated. Two clones having different geographical origin were used in all trails carried out in this study: FX 3864 (South-American) and PB 254 (Asian). Young leaves and eight- to ten-week-old seed integument from both clones were used as explants in several experiments; they were initially cultured in MH médium (Carrón, et ál., 1989), modified MH médium (Montoro, et ál., 1993, 2000) and modified MS médium (Carrón, et at,. 1992), no positive response being obtained by days 25 or 50. However, other triáis were carried out with the integument in modified MS médium (1962), 0.67 mg/L BAP and 0.66 mg/L 2-4 D being added as médium for initiating embryogenesis, the formation of white, friable calluses being observed by day 25 in the two selected clones. These calluses were sub-cultured in MS supplemented with 0.35 mg/L BAP and 0.2 mg/L 2-4 D as callogénesis expression médium, embryogenic expression being observed in both clones by day 50. Equally friable white calluses were obtained from young leaves in the two clones in MS médium supplemented with 1.0 mg/L BAP, 1.0 mg/L ANA but without IBA and kinetin by day 25. Calluses sub-cultured in the same médium supplemented with 0.5 mg/L BAP and 0.5 mg/L ANA began to show increased friability after 50 days' culture. This work is a partial report of a macro-project for optimising a protocol for rubber (Hevea brasiliensis) multiplication by somatic embryogenesis.
Key words: Hevea brasiliensis, callogénesis initiation, friable calli, in vitro culture, natural rubber. Recibido: agosto 10 de 2004. Aceptado: noviembre 20 de 2005
|
||
|
|
||
|
* Ingeniero agropecuario y biólogo MSc. Escuela de Ciencias Agrarias. Politécnico Colombiano Jaime Isaza Cadavid, Medellín, Colombia. Tel. (4) 466 37 34, (4) 454 09 99 ext. 102. Correo electrónico: cesaraugu@une.net.co
** MSc, PhD. Facultad de Ciencias Agropecuarias, Universidad Nacional, sede Medellín, Tel.: 430 91 02, Correo electrónico: rhoyos@unalmed.edu.co
*** MSc. y Especialista. Escuela de Producción Agropecuaria. Universidad de Antioquia. Medellín. Tel.: 425 91 48. Correo electrónico: solmedina@agronica.udea.edu.co, frbstatistical@yahoo.com.es
|
||
|
|
||
|
32
|
||
|
|
||
|
|
|||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGENICOS
|
|||
|
|
|||
|
INTRODUCCIÓN
El uso del cultivo de caucho (Hevea brasiliensis) como recuperador de suelos y como sumidero de CO2, crea un impacto ecológico de sostenibilidad, por cuanto mejora la calidad ambiental colaborando con el restablecimiento del equilibrio agua - aire -suelo - seres vivos. El uso de técnicas biotecnológi-cas y la globalización del mercado, han ayudado a la optimización de la producción del caucho en otros países principalmente en Asia y Europa, con el propósito de responder a las necesidades del mercado, haciØndolo rentable y competitivo. Sin embargo, no se han estandarizado las tØcnicas de siembra y de extracción del caucho, y además, no se han hecho las innovaciones tecnológicas pertinentes. En Colombia, aœn se emplea material vegetal introducido hace mÆs de 35 aæos. Estos aspectos son relevantes en la heveicultura, ya que Østa presenta alta demanda de tecnología, especialmente cuando se requiere establecer plantaciones con altos niveles de producción y obtener caucho de óptima calidad que haga de ella una actividad competitiva. El establecimiento de las plantaciones del Ærbol del caucho mediante propagación tradicional, presenta grandes limitaciones. Para solucionar este problema, se recurre entonces a la embriogØnesis somÆtica como una herramienta alternativa de obtención de árboles a mediano plazo.
A partir de los aæos sesenta, se emprendieron investigaciones para poner a punto la embriogØnesis somÆtica en caucho (Hevea brasiliensis Müll. Arg.) y en otros cultivares de interØs comercial. Como la mayoría de las especies leñosas el Hevea fue en un principio reportado como recalcitrante para el cultivo in vitro. DespuØs de varios aæos de investigaciones, se han regenerado vitroplantas de varios clones de interØs industrial (Carron, et Æl., 1998).
Estudios realizados por Michaux-Ferriére and Carron, 1989; Montoro, et Æl., 1992; Carron, et Æl., 1992; Carron, et Æl., 1993; Etienne, et Æl., 1993a; Montoro, et Æl., 1993; Veisseire, et Æl.,1994a; Montoro, et Æl., 1994; Carron, et Æl., 1995a y 1995b; Carron, et Æl., 1998, han aplicado con Øxito la tØcnica de embriogØnesis somÆtica en Hevea brasiliensis a partir del integumento de la semilla, mediante la adición al medio Murashige Skoog, 1962 de diferentes tipos de auxinas y citoquininas previamente balanceadas, hasta el punto de tener actualmente
|
plantas sembradas en campo con excelente producción y en un tiempo mucho más corto comparado con las plantas obtenidas mediante reproducción tradicional. Igualmente en estudios realizados por Leitao, et Æl., 1998, mediante embriogØnesis somÆtica se obtuvieron callos embriogénicos utilizando como explante hojas jóvenes de Hevea brasiliensis.
Con el presente trabajo se pretende evaluar el efecto de los reguladores de crecimiento BAP, K, ANA, IBA y 2-4D sobre tejidos jóvenes de hojas e integumento, como un estudio preliminar que permita estandarizar un protocolo para la obtención de callos embriogØnicos de dos clones de caucho de diferentes orígenes geográficos, como parte de otros trabajos de investigación en la misma línea.
MATERIALES Y MÉTODOS
Localización. El presente trabajo se realizó en el Laboratorio de Crecimiento y Desarrollo de las Plantas de la Universidad Nacional de Colombia, sede Medellín.
Selección del material vegetal. El material vegetal se obtuvo de dos clones de caucho con características diferentes: el FX 3864 originario de SuramØrica considerado tolerante a ciertas enfermedades como al hongo Microcyclus ulei (que produce el mal suramericano de las hojas) y al Colletotrichum sp (que ocasiona la antracnosis en diferentes partes de la planta); y el clon PB 254, originario del continente asiÆtico y considerado altamente productor de lÆtex, ubicados en la subestación Paraguaicito propiedad de CENICAFÉ, municipio de Armenia, departamento del Quindío, Colombia. Los clones fueron seleccionados de acuerdo con los resultados del estudio de comportamiento referente a la resistencia a enfermedades y a la producción de látex de ambos clones respectivamente, con base en los estudios realizados por López (1998).
Obtención de explantes. Los explantes que se evaluaron en este estudio, fueron hojas jóvenes y el integumento de la semilla.
Los explantes de hojas jóvenes, se obtuvieron de estacas de 50 a 80 cm de longitud y 5 a 10
|
||
|
|
|||
|
33
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
|||
|
|
|||
|
cm de diÆmetro. Las estacas se mantuvieron en condiciones de invernadero en la Universidad Nacional de Colombia, sede Medellín, en condiciones adecuadas para su desarrollo.
Los explantes del tejido de integumento, se obtuvieron a partir de frutos inmaduros (entre 8 a 10 semanas despuØs de la antesis) de los clones seleccionados, el cual tiene la característica de ser un tejido materno que posee el mismo genotipo de la planta madre, es estØril por naturaleza y no requiere de desinfección antes de cultivarlo in vitro (Carron y Enjalric, 1995b).
Desinfección de los explantes. Las hojas jóvenes se lavaron con abundante agua y jabón líquido comercial, y posteriormente se colocaron en alcohol al 70% por 30 segundos, luego se sumergieron en una solución de hipoclorito de sodio al 2% con 2 gotas de tween 80 en 100 mL de solución durante 10 min., para lavarlos finalmente 4 a 5 veces con agua destilada estØril.
Para la obtención del tejido de integumento la semilla se desinfectó externamente sumergiéndola en hipoclorito de sodio al 5% por 10 minutos flameÆndola posteriormente con alcohol. El integumento se extrajo en condiciones estØriles en la cÆmara de flujo laminar horizontal (Carron, et Æl., 1989).
Medios de cultivo para la inducción de callos embriogØnicos. Se evaluaron tres medios descritos en la literatura los cuales tienen como base el medio Murashige y Skoog (MS) (1962), estos fueron: el medio MH (Carron, et Æl., 1989), el medio MH modificado (Montoro, et Æl., 1993, 2000) y el medio MS modificado (Carron, et ál., 1992), empleados por los investigadores anteriormente mencionados para la inducción de embriones a partir del integumento en los clones PB 254 y FX 3864 (tabla 1). Después de 25 días, los explantes que formaron callo se transfirieron a los mismos medios reduciendo la concentración tanto de auxinas como de citoquininas en condiciones de oscuridad.
Adicionalmente, se realizaron dos ensayos diferentes a los reportados por la literatura, uno con el integumento interno y otro a partir de hojas jóvenes:
|
Efecto del 2-4D y BAP en la iniciación de callos friables en el tejido de integumento. Con el propósito de evaluar y comparar la efectividad del medio MS con los tres medios descritos anteriormente, éste se suplemento con diferentes concentraciones de Æcido 2-4 diclorofenoxiacØtico (2-4D) y 6- bencilaminopurina (BAP). Como explante se utilizó el integumento de la semilla de los clones FX 3864 y PB 254 para la iniciación y formación de callogénesis realizando lecturas a los 25 y 50 días en condiciones de oscuridad.
Efecto de la kinetina y el BAP en la iniciación de callos friables en el tejido de hoja joven. Se sembraron segmentos de hojas jóvenes de aproximadamente 1.0 cm2 de los clones FX 3864 y PB 254 en frascos con medio MS suplementado con BAP, kinetina (K), Æcido naftalenacØtico (ANA) y ácido indol butírico (IBA) con diferentes concentraciones, mÆs 80 g/L de sacarosa y a pH 5.8 en condiciones de oscuridad, con el fin de obtener callos friables realizando lecturas a los 25, 50 y 80 días, utilizando la metodología propuesta por Leitao, et Æl., 1998.
Diseæo experimental
Se empleó un diseño experimental completamente aleatorizado, efectos fijos, balanceado, simØtrico con un arreglo factorial 23 y 24, donde la variable respuesta fue el conteo de callos. Se empleó una transformación basada en la familia Box- Cox, con el propósito de convalidar algunos de los supuestos asociados con el anÆlisis de la varianza. Se utilizó la prueba de comparación por el método de Tukey al 5% de significancia con el propósito de comparar el efecto promedio de los distintos tratamientos sometidos a experimentación.
Para todos los tratamientos realizados en este estudio se hicieron 10 rØplicas.
RESULTADOS Y DISCUSIÓN
Evaluación de los medios MH (Carrón, et ál., 1989), MH modificado (Montoro, et Æl., 1993, 2000) y el MS modificado (Carron, et ál, 1992) para la iniciación y formación de callos embriogØnicos. El callo se inicia por la proliferación de células en el punto de corte del explante o
|
||
|
|
|||
|
34
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGENICOS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 1. Composición de los medios de cultivo MH (Carrón, et ál., 1989), MH modificado (Montoro, et ál., 1993, 2000)
y el MS modificado (Carrón, et ál., 1992).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
35
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
|||
|
|
|||
|
en la superficie interna del integumento (cerca de la nucela) y tambiØn a partir de cØlulas perivasculares (Michaux- FerriØre y Carron, 1989).
En los tres medios anteriormente mencionados a los 25 días de cultivo y en condiciones de oscuridad, se obtuvieron callos compactos, y de color blanco; posteriormente estos callos se subcultivaron en medio fresco con las concentraciones de 2-4D, AIA y BAP reducidas a la mitad. Después de 50 días de cultivo no se presentó ningún cambio, es decir, no manifestaron expresión embriogØnica. En estudios realizados por Montoro, et Æl., (1993), encontraron un comportamiento similar del integumento cuando se sembró en el medio Carron (1989). Solamente dos de cinco clones evaluados fueron capaces de formar espontÆneamente una cantidad moderada de callos friables, los otros clones formaron callos compactos.
Segœn Ettiene et Æl., (1993b), el anÆlisis que se puede hacer de la influencia de los reguladores de crecimiento en el cultivo in vitro generalmente se ve alterado debido a que es muy poco lo que se conoce sobre el grado de absorción, migración y metabolismo de estos elementos vía embriogénesis somÆtica. Algunos investigadores, tales como Hess y Carman (1991); Li y Neumann (1985) y Rajasekaran, et Æl., (1987), citados por Ettiene (1993b), reportan que los tejidos embriogØnicos son muy ricos en Ácido Abscísico (ABA), mientras que el contendido de Ácido 3- Indol Acético (AIA) varía considerablemente de una especie a otra. La adquisición de la capacidad embriogénica de los callos puede estar relacionada con el establecimiento de un balance específico entre diferentes hormonas de tipo endógeno. La manifestación de callos duros, pequeæos y de color blanco entre los 15 a los 50 días, y su permanencia en este estado, posiblemente estÆ relacionada con el rompimiento de este balance hormonal.
Estudios realizados por Carron, et Æl., (1998) a partir de integumento, mostraron que en el medio para la iniciación de callogénesis, la adición de sustancias tales como calcio, sacarosa y fitohormonas, permiten estimular la formación de lóbulos friables en los callos. AdemÆs, comenta el mismo autor, se deben realizar entre 4 a 6 subcultivos en el mismo medio de iniciación, para estimular la formación de
|
callos friables e inhibir al mismo tiempo la manifestación temprana de la embriogénesis somática. Igualmente, establecieron que la calidad de tejido friable no es un carÆcter œnico y suficiente para definir una completa embriogØnesis, tambiØn es preciso que el callo adquiera una fuerte capacidad de proliferación. En esta investigación solamente se realizó un subcultivo a los 26 días en los tres medios evaluados, lo cual puede considerarse como una de las causas para que los callos obtenidos no mostraran proliferación ni estructura friable (figura 1). Adicionalmente, la respuesta dada por los clones difiere de las obtenidas por los medios reportados en la literatura, posiblemente esto se deba a que en estos estudios utilizaron los clones PR 170 y PB 250 obteniendo embriogØnesis somÆtica reprodu-cible, mientras que en este trabajo se evaluaron los clones FX 3864 y PB 254 siendo genotipos diferentes.
|
||
 |
|||
|
Figura 1. Callo de estructura y apariencia compacta obtenido con los tres medios evaluados.
|
|||
|
Para este ensayo se considera que los genotipos de los dos clones seleccionados tienen incidencia en los resultados. El integumento de la semilla de los clones PB 254 y FX 3864 no mostró capacidad para la generación de callo tipo embriogénico, ni para la formación de líneas de callos friables proliferantes. En trabajos realizados por Carron, et Æl (1998), utilizando 12 genotipos diferentes, encontraron que la mitad de los genotipos no mostraron capacidad para la formación de callo a partir de integumento, en cambio, con los otros seis se lograron embriones somÆticos y de manera reproducible.
|
|||
|
|
|||
|
36
|
|||
|
|
|||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGENICOS
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
El uso de agentes inhibidores de la acción del etileno como el AgNO3, ha sido reportado como un inductor de la embriogØnesis somÆtica (Carron, 1995a). El efecto inhibitorio es causado por la ocupación de los sitios de acción del etileno en la célula por el ion plata (Ag+). La diferente respuesta de los medios de cultivo reportados en la literatura con los obtenidos en este trabajo para la producción de callo embriogénico, posiblemente esté relacionada con el uso de diferentes clones en ambos estudios, y que ademÆs es probable que los materiales utilizados en este estudio no necesiten de un agente protector contra la acción del etileno.
Efecto del 2-4D y BAP en la iniciación de callos friables en el tejido de integumento. El efecto de las hormonas para la producción de callos se evaluó en el medio MS para los clones PB 254 y FX 3864, a partir del integumento de la semilla, tal y como se muestra en las tablas 2 y 3, donde cada tratamiento se denota entre parØntesis. El efecto de las concentraciones hormonales sobre la iniciación de la callogénesis se presentó a los 25 días tanto para el clon PB 254 como para el FX 3864. El tipo de callo observado para ambos clones, tuvo una apariencia de color blanco y aspecto friable. De la misma manera el nœmero de callos obtenidos parar ambos clones con los mismos tratamientos fue muy similar (tablas 2 y 3).
La respuesta del clon PB 254 con relación a la variable nœmero de callos de acuerdo con el ANAVA
|
(tabla 4), mostró diferencias altamente significativas (P< 0.01) entre las dosificaciones de 2-4 D de la siguiente manera: existió diferencia entre la concentración de 0.66 mg/L con respecto a la de 0.88 mg/L y al tratamiento testigo, al igual que entre la concentración de 0.44 mg/L con respecto a la de 0.88 mg/L y al testigo, (P<0.05), pero no se encontraron diferencias entre la concentración de 0.66 mg/L y la de 0.44 mg/L, ni entre la de 0.88 mg/L y el tratamiento testigo (P>0.05) (tabla 5). Se deduce que la mejor dosificación para la producción de callo del factor 2-4 D al compararla con las demÆs dosificaciones del mismo factor, fue 0.66 mg/L y la mÆs baja la de 0 mg/L (testigo).
Para las dosis evaluadas de BAP se encontraron diferencias significativas entre 0.67 mg/L y el tratamiento testigo, entre 0.67 mg/L y 0.88 mg/L, y entre las dosis de 0.44 mg/L y el testigo y 0.44 mg/ L y 0.88 mg/L (P<0.05); entre las demÆs no hubo diferencia (P>0.05). Por tanto, la mejor dosificación individual para el factor BAP para la producción de callo fue la de 0.67 mg/L (tabla 6). Este mismo anÆlisis se presentó en el clon FX 3864.
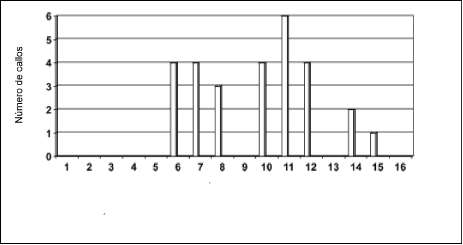
Con base en este análisis estadístico se puede establecer que el tratamiento nœmero 11 (0.66 mg/L de 2-4 D y 0.67 mg/L de BAP) realizado para ambos clones (tablas 2 y 3), fue el que presentó mayor nœmero de callos 6 para el clon de origen asiÆtico, que corresponde al 60% de los callos obtenidos, y 5 (el 50%) en el clon de origen suramericano.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 2. Nœmero de callos obtenidos con diferentes concentraciones de BAP y 2-4D a partir del tegumento interno del
clon PB 254 a los 25 días
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cada tratamiento se muestra entre parØntesis.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
37
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 3. Nœmero de callos obtenidos con diferentes concentraciones de BAP y 2-4D a partir de tegumento
interno del clon FX 3864 a los 25 días
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cada tratamiento se muestra entre parØntesis.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 4. Análisis de varianza para la producción de callos a los 25 días en el clon PB 254
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 5. Prueba de comparación de Tukey (a= 0.05) para la producción de callos a los 25 días en el factor 2-4 D.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Letras distintas muestran diferencia estadística.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
38
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGENICOS
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 6. Prueba de comparación de Tukey (a= 0.05) para la producción de callos a los 25 días en el factor BAP.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
* Letras distintas muestran diferencia estadística.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
También se observó con base en los análisis estadísticos, que aunque el tratamiento número 11 (0.67 mg/l de BAP y 0.66 mg/L de 2-4D) para el clon PB 254, fue en el que mayor nœmero de callos se produjeron (60%), este tratamiento no presentó diferencias significativas con los tratamientos 6 (0.45 mg/L de BAP y 0.44 mg/L de 2-4D), 7 (0.67 mg/L de BAP y 0.44 mg/L de 2-4D) y 10 (0.45 mg/L de BAP y 0.66 mg/L de 2-4D) (figura 2); en el clon FX 3864 igualmente se presentó que los mismos tratamientos fueron los mejores para la iniciación de la callogØnesis, siendo el tratamiento 11 igualmente, el que mayor número de callos presentó con un to-
|
tal de cinco (el 50%) de 10 explantes sembrados por tratamiento.
Segœn Montoro, et ál., (1993), el color cafØ de los callos estÆ directamente relacionado con la adición de kinetina al medio de cultivo, lo cual nos lleva a considerar que posiblemente el color blanco de los callos obtenidos en este estudio a los 25 días, pueda estar relacionado con la presencia de BAP en el medio de cultivo.
Con el propósito de evaluar el desarrollo embriogØnico de los callos obtenidos, los dos clones
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
 Tratamientos
Figura 2. Nœmero de callos obtenidos con diferentes concentraciones de 2-4D y BAP a los 25 días en el clon PB 254.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
39
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
|||
|
|
|||
|
se subcultivaron en medio fresco con una concentración hormonal reducida a la mitad tanto de 2-4D como de BAP. Estos callos después de 50 días continuaron con la misma textura friable y mantuvieron la misma coloración, sin embargo, unos pocos presentaron tendencia a callos embriogØnicos tal y como los describió Carrón, etál., 1995a. Solamente un callo procedente de tejido de integumento del clon PB 254 presentó estructura más desarrollada (figura 3).
De los trabajos consultados para este estudio, muy pocos tienen como base para la iniciación de la callogØnesis el medio MS suplementado con diferentes concentraciones de 2-4D y BAP; sin embargo, Wang, et ál., (1980), y Chen, et Æl., (1981, 1982), utilizando anteras como explantes iniciales, las sembraron en las sales de MS y de Wang, et ál., (1980) suplementadas con 2-4D y BAP, resultando callos embriogØnicos, los cuales fueron inducidos a producir embriones y Østos a su vez, fueron sometidos a un proceso de conversión para producir plÆntulas.
El- Hadrami, and I.D1 Auzac (1992), compararon diferentes concentraciones de 2-4 D y BAP, y observaron que el suministro de estos reguladores de crecimiento mejora el potencial embriogØnico comparado con el medio control, en el cual no estaban presentes ambas hormonas, lo cual posiblemente nos lleva a considerar que tanto el BAP como el 2-4D no sean endógenos en los clones evaluados.
De acuerdo con Carron, et ál., (1995a) los tipos de reguladores de crecimiento y sus concentraciones son parÆmetros esenciales para el desarrollo del callo. Ettiene, et Æl., (1991) y Carron,
|
et ál., (1995b), demostraron que aunque la adición de kinetina y BAP en el medio de cultivo puede oscurecer el color de los callos en el medio de inducción de callogénesis, ambos reguladores promueven la inducción de la embriogénesis somática y la posterior conversión de de los embriones a plÆntulas.
Michaux- Ferriere y Carron (1989), igualmente encontraron el mismo tipo, tamaæo textura y color en los callos entre los 15 a los 40 días, a los reportados en el presente estudio. DespuØs de los 90 días observaron muy pocos proembriones lo cual se debe a que las cØlulas embriogØnicas se originan ocasionalmente y a largo plazo despuØs de la desdiferenciación celular.
Montoro, et Æl., (1992), establece que las auxinas juegan un papel muy importante en el desarrollo de embriones somÆticos, pero igualmente manifiesta que las citoquininas interactœan con las auxinas en la regulación de la ontogénesis de los embriones.
Los resultados obtenidos en el presente trabajo en cuanto al tipo de callo obtenido al usar una relación hormonal de auxina y citoquinina (2-4 D y BAP respectivamente), coinciden con los estudios realizados por Carron (1989), Montoro (1993 y 2000), y Carron, et ál., (1992) con otros clones.
Estudios de tipo histológico realizados por Michaux- Ferriere y Carron (1989), mostraron que entre los días 15 a 40, los callos son ricos en células polifenólicas lo cual impide su potencial de multiplicación ocasionando la dureza, cambio de color y baja tasa de crecimiento del callo; a partir
|
||
|
|
|||
 Figura 3. Embriones somáticos obtenidos a partir de integumento del clon PB 254 a los 50 días
|
|||
|
|
|||
|
40
|
|||
|
|
|||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGÉNICOS
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
del día 40 los callos generalmente se vuelven necróticos debido a los diferentes subcultivos que se hacen y al desbalance entre auxinas y citoquininas en el medio de cultivo. Esto hace suponer que el tipo de callo encontrado en este trabajo, corresponda a callos friables embriogØnicos dada la coincidencia en la descripción que hacen estos autores. Sin embargo, en este estudio los callos obtenidos a partir de integumento presentaron un tejido mÆs compacto. Se considera que la callogØnesis depende del tipo de clon, del tipo de explante y de las condiciones experimentales seleccionadas, las cuales podrían ser las causas principales de la morfología de los callos obtenidos en los medios evaluados en este estudio para los dos genotipos seleccionados.
Carron, et Æl., (1992), encontraron que durante la fase de iniciación de callos embriogénicos después del día 15, se producen altas cantidades de gases principalmente de CO2, lo cual tiene un efecto negativo sobre el desarrollo y mantenimiento de la callogØnesis.
Los mismos autores mencionan que el tipo de agar utilizado para la iniciación de la callogØnesis tambiØn es un parÆmetro importante, e incide en aspectos como la estructura, el color
|
y el potencial embriogØnico del callo. Encontraron que Gelrite contiene una composición apropiada de sustancias sin efectos inhibitorios para el desarrollo del callo, el cual igualmente fue utilizado en este estudio.
Efecto de la kinetina y el BAP en la iniciación de callos friables en el tejido de hoja joven. Son
muy pocos los trabajos en caucho (Hevea brasiliensis) en los cuales se ha reportado la obtención de callos embriogénicos a partir de hoja joven como explante inicial.
Para la obtención de callo a partir de hojas jóvenes de los clones PB 254 y FX 3864, se utilizó el medio MS (1962) suplementado con diferentes concentraciones de auxinas y citoquininas, tal y como se observa en las tablas 7 y 8.
El análisis estadístico tanto para el clon PB 254 como para el FX 3864 mostró diferencias significativas (P<0.05) entre las dosificaciones de BAP siendo la mejor concentración 1.0 mg/L, seguida del testigo. Las concentraciones de 2.0 y 3.0 mg/L se mostraron como las mÆs bajas para la variable producción de callos. Sin embargo, se presentó diferencia estadística entre 1.0 mg/L de BAP con respecto a 2.0 mg/L y a 3.0 mg/L de la misma hor-
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 7. Nœmero de callos obtenidos con diferentes concentraciones de BAP, K, ANA e IBA a partir de hojas
jóvenes del clon PB 254 a los 25 días
kinetina mg/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
BAP mg/L
|
|
ANA mg/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
IBA mg/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cada tratamiento se muestra entre parØntesis.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
41
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 8. Nœmero de callos obtenidos con diferentes concentraciones de BAP, K, ANA e IBA a partir de hojas jóvenes del clon FX 3864 a los 25 días (se realizaron 10 repeticiones por tratamiento)
kinetina mg/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
BAP mg/L
|
|
ANA mg/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
IBA mg/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cada tratamiento se muestra entre parØntesis.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
mona a favor de 1.0 mg/L, es decir, que altas dosis de BAP inhiben la formación de callos (P<0.05) (tablas 9 y 10).
Concentraciones de 1.0 mg/L de ANA ayudaron a la formación de callos mostrando diferencias altamente significativas con concentraciones de 2.0 mg/L y 3.0 mg/L de esta hormona en las cuales no se presenta la inducción de callos friables (tablas 7 y 8).
Para el efecto de la kinetina se encontraron diferencias significativas, mostrando en la prueba
|
de contraste de Tukey que la ausencia de kinetina favoreció el desarrollo de los callos seguida de 1.0 mg/L y de 3.0 mg/L; la concentración de 2.0 mg/L se considera que no favorece la inducción de callos (tabla 11).
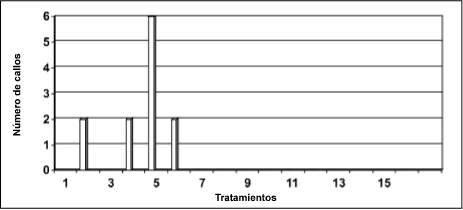
Con base en este análisis estadístico se puede establecer que el tratamiento 5 (BAP 1 mg/L, y ANA 1 mg/L), tanto para el clon PB 254 como para FX 3864 después de 25 días de cultivo, fue el que presentó mayor número de callos, 6 y 7, que corresponde al 60% y 70% respectivamente. Se encontró que la apariencia de los callos se mejoró
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 9. Análisis de varianza para la producción de callos a los 25 días en el clon PB 254
a partir de hojas jóvenes
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
42
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGENICOS
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 10. Prueba de comparación de Tukey (a= 0.05) para la producción de callos a los 25 días en
el factor BAP a partir de hojas jóvenes
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
* Letras distintas muestran diferencia estadística.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Tabla 11. Prueba de comparación de Tukey (a= 0.05) para la producción de callos a los 25 días en el factor kinetina a partir de hojas jóvenes
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
* Letras distintas muestran diferencia estadística.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
cuando Østos fueron transferidos a medio fresco con las concentraciones de BAP y ANA reducidas a la mitad (0.5 mg/L y 0.5 mg/L respectivamente) (figura 4).
Contrario a lo reportado por Leitao, et Æl., (1998), la adición de kinetina y el incremento de BAP en el medio de cultivo, redujo la obtención de callos para los clones evaluados en este trabajo. Adicionalmente, con el 2-4D y el AlA no se logró la
|
producción de callos. Aunque no se logró obtener un callo embriogénico típico, ellos presentaron características aparentes tal y como lo describió Carron (1995a), con explantes de integumento (figura 5).
CONCLUSIONES
El efecto negativo de los medios de cultivo reportados en la literatura para la producción de callo
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
43
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
|||
|
|
|||
 |
|||
|
|
|||
|
Figura 4. Número de callos obtenidos con diferentes concentraciones de BAP, kinetina, ANA e IBA a los 25 días en el clon PB 254
|
|||
|
|
|||
 |
|||
|
|
|||
|
Figura 5. Callos friables obtenidos a partir de hojas jóvenes del clon PB 254 a los 50 días
|
|||
|
|
|||
|
embriogØnico, pudo deberse a la respuesta varietal de los genotipos evaluados.
Los clones FX 3864 y PB 254 utilizados en el presente estudio, respondieron de forma diferente a la producción de callos en los medios MS suple-mentado con 2-4D y BAP utilizando como explante el integumento, y en el medio MS con K, BAP, ANA e IBA a partir de hojas jóvenes como explante, siendo el callo de tipo embriogØnico en el primer medio evaluado y friable en el segundo.
|
A partir de hojas jóvenes se obtuvieron callos friables, lo cual no había sido reportado en ningún trabajo consultado.
AGRADECIMIENTOS
Los autores expresan sus agradecimientos al Convenio PolitØcnico Colombiano Jaime Isaza Cadavid y la Universidad de Antioquia, a la Universidad Nacional de Colombia sede Medellín, al ingeniero forestal Luis Fernando Medina, y a CENICAFÉ,
|
||
|
|
|||
|
44
|
|||
|
|
|||
|
|
|||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGENICOS
|
|||
|
|
|||
|
Subestación Paraguaicito, por su colaboración para la realización de este trabajo.
BIBLIOGRAFÍA
Auboiron, E.; Carrón, M.P.; Michaux-Ferriére, N. 1990. Influence of atmospheric gases, particularly ethylene on somatic embryogenesis of Hevea brasiliensis. Plant Cell Tissue and Organ Culture. 21: 31-37.
Carrón, M.P., Enjarlic, F. 1982. Studies on vegetative micropropagation of Hevea brasiliensis by somatic embryogenesis and in vitro microcutting. Plant Tissue Culture (Fujuwara A., ed.). Proceedings of the 5th intemational Congress on Plant Tissue Cell Culture. Tokio, p.p. 751- 752 in Fujiwara (ed.): (En: George, E.F., et. al. 1987. Plant Culture Media, vol. 1 Formulations and Uses, British Library Cataloguing, Great Britain).
Carrón, M.P; Enjalric, F.; Lardet L; Deschamps, A. 1989. Rubber(Hevea brasiliensisMüll. Arg.) Bio-technology in Agriculture and Forestry. Vol. 5, Trees II. 222-245.
Carrón, M.P; Auzac, J.; Etienne, H.; EI Hadrami, I.; Housti, F.; Michaux- Ferriere, N.; Montoro, P. 1992. Biochemical and histological features of somatic embryogenesis in Hevea brasiliensis. Indian Journal of Natural Rubber Research, 5 (1& 2): 7-17.
Carrón, M.P.; Montoro, P; Etienne, H.; Michaux-Ferriére, N. 1993. Callus friability and somatic embryogenesis in Hevea brasiliensis. Plant Cell Tissue and Organ Culture, 33: 331-338.
Carrón, M.P.; Etienne, H.; Michaux- Ferriere, N.; Montoro, P. 1995a. Somatic embryogenesis in rubber tree (Hevea brasiliensis Müll. Arg.). Bio-technology in Agriculture and Forestry. 30: 353-369.
Carrón, M.P.; Etienne, H.; Michaux- Ferriere, N.; Montoro, P. 1995b. Somatic embryogenesis in rubber (Hevea brasiliensis Müll. Arg.). Somatic Embryogenesis in Woody Plants. 2: 117-136.
Carrón, M.P.; Lardet, L; Dea, BG. 1998. Micropopagation de l'Hevea par embryogenése somatique. Plantations Recherche Developpe-ment. 187-194.
Chen, C; Chen, F; Chien, C; Wang, C. Chang, S.; Hsu, H.; Ou, H; Ho, Y; Lu, T. 1978. Obtaining pollen plants of Hevea brasiliensis Muell. p.11-22. Proceedings of Symposium on plant tissue culture. Sdence Press. Pekin.
|
Chen, Z., Qian, C; Qin, M.; Xu, X.; Xiao, Y. 1982. Recent advance in anther culture of Hevea brasiliensis. Theor. Appl. Genet. 62: 103-108.
Chen, Z., Li, W.; Zhang, L; Xu, X.; Zhang, S.1987. Production of haploid plantlets in cultures of unpollinated ovules of Hevea brasiliensis. A huja, M.R. (ed.). Somatic Cell Genetics of Woody Plantes: Proceedings of the IUFRO Workings Party S 2. 04-07. Federal Republik of Germany, 1013 August 1987. Bostón (USA) 39-44.
De Fossard, R.; Nitsch, C.; Cresswell, R.; Lee, E. 1974. Tissue and organ culture of eucalyptus. N. Z. J. of Forestry Science, 4 267-278.
Dublin, P.; Enjalric, F.; Lardet, L.; Carrón, M.; Trolinder, N.; Pannetier, C. 1991. Estáte Crops. Hevea brasiliensis. Micropropagation. Netherlands. Kluwer Academic Publishers, 337-361.
El- Hadrami, I.; Carrón, MP.; D'Auzac, J. 1991. Influence of exogenous hormones on somatic embryogenesis in Hevea brasiliensis. Annals of Botany. 67: 511-515.
El- Hadrami I.; D' Auzac, J. 1992. Effects of growth regulators of polyamine content and peroxidase activity in Hevea brasiliensis callus. Annals of Botany, 69: 323-325.
EI- Hadrami I.; Housti, F.; Micaux- Ferriere, N.; D' Auzac, J. 1993. Effect of gelling agents and liquids médium on embryogenic potential, polyamines and enzimatics factors in browning in Hevea brasiliensis call i. Journal of Plant Physiology, 141: 230-233.
Enjalric, R; Carrón, M.P. 1982. Physiologie végétale microbouturage in vitro de jeunes plants d' Hevea brasiliensis (Kunth, Müll. Arg.) C.R. Acad. Se. París, t. 295: 259-264.
Ettiene, H.; Berger, A.; Carrón, M.P1991. Water status of callus from Hevea brasiliensis during induction of somatic embryogenesis. Physiol. Plant. Copenhagen, 82: 213-218.
Ettiene, H.; Montoro, P; Michaux- Ferriere, N.; Carrón, M.P. 1993a. Effects of dessication, médium osmolarity and abscisic acid on the maturation of Hevea brasiliensis somatic embryos. J. of Exp. Bot. 44: (267) 1613-1619.
Ettiene, H.; Sotta, B.; Montoro, P; Migianic, E.; Carrón, M.P. 1993b. Relations between exogenous growth regulators and endogenous Índole- 3-acetic acid and abscisic acid in the expression of somatic embryogenesis in Hevea brasiliensis (Müll. Arg.). Plant Science, 88: 91-96.
Etienne, H.; Larbaud, M.; Carrón, M.P; Michaux -
|
||
|
|
|||
|
45
|
|||
|
|
|||
|
|
|||
|
Rev. Colomb. Biotecnol. Vol. VIII N° 1 Julio 2006 32-47
|
|||
|
|
|||
|
Ferriére, N. 1997. Use of calcium to optimize long-term proliferation of friable embriogenic calluses and plant regeneration in Hevea brasiliensis. J of Exp Botany. 129-137.
George, E.F., Puttock, D.J., George, H.J. 1987. Plant Culture Media, Vol 1 Formulations and Uses. British Library Cataloguing. The Eastern Press, Great Britain. 567 p.
Gupta, P.K.; Mascarenhas, A.F.; Jagannathan, V. 1981. Tissue culture of forest trees clonar propagation of mature trees of Eucalyptus citríodora. Horsk by Tissue Culture. Plant Science. Lett. 20 195-200.
Hernández, C.A. 2001. Análisis de la variación genØtica de clones de caucho (Hevea brasiliensis) asiáticos, suramericanos y centroamericanos, utilizando marcadores RAPDs. Tesis de maestría en biotecnología. Facultad de Ciencias y Ciencia Agropecuarias, Universidad Nacional de Colombia, sede Medellín, 85 págs.
Housti, F.; Coupe, M; D'Auzac, J.; 1992. Browning mechanisms and factors of influence in vitro Hevea calli cultures. Indian Journal of Natural Rubber Research. 5: 1- 2, 86-89.
Jourdan C; Enjalric, R; Lardet, L; Michaux-Ferriére, N.; Berger.A. carrón, M. 1992. Caractéristiques hydriques et histologiques de vitroplants d' Hevea brasiliensis (Müll. Arg.) en cours de micropropagation. C.R. Acad. Sci. Paris, t. 315, serie III, 395-401.
Lardet, L; Enjalric, R; Carrón, M. 1990. Culture d'apex d' Hevea brasiliensis (Müll. Arg.) influence du stade morphogénetique et de l'áge des explantes. C.R. Acad. Sci. Paris. t. 310, serie III, 195-202 p.
Lardet, L.; Bes, M.; Enjalric, F.; Carron. 1994. Mineral imbalance in Hevea brasiliensis Microcuttings: relation with in vitro multiplicaron and aclimatization. Journal of Plant Nutrition. France. 17 (12), 2135-2150.
Leitao, A.B.; Almeida, R.A.; Barros Freire, A. 1998. Micropropagation of rubber trees (Hevea brasiliensis Muell. Arg.). Genet. Mol. Biol. 21: 3, 1-9.
Linares, R.; Nieto, V.M. 1997. Diagnóstico de la investigación sobre caucho natural en Colombia. Documento base para la formulación del plan de investigación del caucho dentro del proyecto sobre apoyo económico al fomento del cultivo del caucho a nivel nacional. Convenio Especial de Cooperación Ministerio de Agricultura y Desarrollo Rural —CONIF—. Documento preparado por la Corporación Nacional de In-
|
vestigación y Fomento Forestal CONIF. Bogotá, marzo, 39 pÆgs.
López, J.A. 1998. Comportamiento de clones de caucho (Hevea brasiliensis) en la zona cafetera colombiana. Avances TØcnicos CENICAFÉ 247, 8 págs.
Mascarenhas, A.R; Gupta, P.K.; Kulkami, V.M.; Mehta, U.; Lyer, R.S.; Khuspe, S.S.; Jagannathan, V. 1981. Propagation of trees by tissue culture. AN Rao (ed.) Proc. COSTED. Symp. Tiss. Cult. Econ. Imp. lants, Singapore. 175-179.
Medina, L.F. 2002. Entrevista personal.
Michaux- Ferriére, N.; Carrón, MP. 1989. Histology of early somatic embryogenesis in hevea brasiliensis. the importance of the timing of subculturing. Plant Cell Tissue and Organ Culture. 19: 243-256.
Michaux- Ferriére, N.; Grout, H.; Carrón, M.P. 1992. Origin and ontogénesis of somatic embryos of Hevea brasiliensis. American Journal of Botany. 79 (2) 174-180.
Montoro, P; Etienne, H.; Carrón, M.P, Nougarede, A. 1992. Effect of cytokininis on the induction of embryogenesis and the quality of somatic embryos in Hevea brasiliensis Müll. Arg. C.R. Acad. Sci. Paris, t. 315, serie III, 567-574.
Montoro, P; Etienne, H.; Michaux-Ferriére, N.; Carrón, M.P. 1993. Callus friability and somatic embryogenesis in Hevea brasiliensis. Plant Cell Tissue and Organ Culture. Netherlands, 33: 331-338.
Montoro, R; Etienne, H.; Carrón, M.P. 1994. Effect of calcium on callus friability on somatic embryogenesis in (Hevea brasiliensis) relation with callus mineral nutritions, nitrogen metabolism and water parameters. Journal of Experimental Botany. 43 (283): 255-261.
Montoro, P.; Tienseree, N.; Rattana, W.; Kongsawadworakul, P; Micaux- Ferriére, N. 2000. Effect of exogenous calcium on agrobacterium tumefaciens- mediated gene transfer in Hevea brasiliensis (rubber tree) friable calli. Plant Cell Reports, 19: 851-855.
Muangkaewngam, A.; Te-chato, S. 1992. In vitro storage of shoot tip and node of rubber (Hevea brasiliensis) at low temperature. Agriculture Journal. 20: (5) 238-244.
Murashige T; Skoog, F. 1962. A revised médium for rapid growth and bio assay with tobáceo tissue culture. Physiologia Plantarum. 15: 473-497.
Pérez, J.; Gómez, R.; Calle, R.; Atehortúa, L. 1996. I Curso internacional de semilla sintØtica o artificial. Medellín, págs. 15-26.
|
||
|
|
|||
|
46
|
|||
|
|
|||
|
|
|||
|
ESTUDIOS PRELIMINARES EN LA ESTANDARIZACIÓN DE UN PROTOCOLO PARA LA OBTENCIÓN DE CALLOS EMBRIOGENICOS
|
|||
|
|
|||
|
Perrin, Y; Lardet, L; Enjalric, R; Carrón, M.P. 1994.
Rejuvenation of mature clones of (Hevea
brasiliensis) by in vitro micrografting. Canadian
Journal of Plant Science. 74: (3) 623-630. Rincón, O. 1996. Manual prÆctico para el cultivo del
caucho, CORDICAFÉ. Santa Fe de Bogotá,
págs. 13-45. Roca, W.; Mroginski, L.A. 1991. Cultivo de tejidos en
la agricultura. Publicación CIAT. Cali, Colombia,
págs. 595-604. Suharyanto, A., et ál. 1993. Preservation of rubber
budwood using aseptic technique. Menara
Perqueburnan. 61: (2) 39-43. Teisson, C. et ál. 1997. [en línea], disponible en:
www.cirad.fr Tisserat, B.; Esan, E.; Murashige, T. 1978. Somatic
embryogenesis in angiosperms. Hort. Rev. 1: 1- 78. Toruan, N.L. et ál., 1976. Tissue culture of Hevea
brasiliensis. Int. Rubber Res. Dev. Board
Symphosium, Bogor, Indonesia. (Abs. 11).
|
Veisseire, P; Cailloux, R; Coudret.A. 1994a. Effectof conditioned media on the somatic embryogenesis of (Hevea brasiliensis). Plant Physiology and Biochemestry. 32: (4) 571-576.
Veisseire, P; Linossier, L; Coudret.A. 1994b. Effect of abscisic acid and cytokinins on the development of somatic embryos in Hevea brasiliensis. Plant Cell Tissue and Organ Culture. 39: 219-223.
Vicient, C.M.; Martínez, F.X. 1998. The potential uses of somatic embriogénesis in agroforestry are not limited to synthetic seed technology. Revista Brasileira de Fisiologia Vegetal, 10 (1): 1-12.
Wang Z.; Zeng, X.; Chen, C.; Wu, H.; Li, Q.; Fan, G.; Lu, W. 1980. Induction of rubber plantlets from anthers of Hevea brasiliensis in vitro. Chínese J. Trop. Crops. 1 : 16-26.
Zimmerman, J.L. 1993. Somatic embryogenesis: a model for early development in higher plants. The Plant Cell, 5: 1411-1423.
|
||
|
|
|||
|
47
|
|||
|
|
|||
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2006 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















