Caracterización fisiológica de la comunidad microbiana endófita de la caña de azúcar
Physiological characterization of sugarcane's endophytic microbial community
Palabras clave:
comunidad endófita, caña de azúcar, actividad nitrogenasa, ácido indolacético, endophytic community, sugarcane, nitrogenase activity, indolacetic acid (es)|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 66-75____________________________
Caracterización fisiológica de la comunidad microbiana endófita de la caña de azúcar
Physiological characterization of sugarcane's endophytic microbial community
Anar Janet Rodríguez Cheang*, Iván David Trujillo Cerón*, Yaremis Felipe Bringas*, Marcia María Rojas Badía*, Julia Manzano Castañeda *
Mayra Heydrich Pérez*
RESUMEN
El uso desmedido de fertilizantes químicos nitrogenados y pesticidas ha traído graves consecuencias ambientales, por lo que se ha prestado gran atención al estudio de la microbiota nativa de los cultivos y sus beneficios a la planta, incluyendo la caña de azúcar. Este trabajo se realizó con el objetivo de caracterizar la microbiota nativa de la caña de azúcar. Se utilizaron 5 cepas bacterianas y 50 aislados provenientes del interior de este cultivo. Se determinó la actividad nitrogenasa y la influencia de la fuente de carbono, nitrógeno y el pH en la misma, mediante cromatografía gaseosa. Se detectó la producción de ácido indolacético por Dot-Immunobinding y el método de Salkowski. Del total de cepas y aislados, 19 mostraron actividad nitrogenasa, con valores entre 100 y 5000 //g/mL, y 6, Gluconacetobacter diazotrophicus PAl-5, Gluconacetobacter diazotrophicus 1-05, Gluconacetobacter diazotrophicus 4-02, aislado 17, aislado 30 y aislado 305; además, tienen la capacidad de producir AIA (valores entre 1,7 y 2,5JMg/mL). Se demostró que las fuentes nutricionales y el pH del medio de cultivo influyen sobre la actividad nitrogenasa de las cepas representativas de la comunidad endófita.
Palabras clave: comunidad endófita, caña de azúcar, actividad nitrogenasa, ácido indolacético.
ABSTRACT
Excessive application of chemical nitrogen fertilisers and pesticides has badly affected the environment. This has led to great interest being shown in studying a crop's native microbial community and its benefit for plants. This paper was thus aimed at characterising sugarcane's endophytic microbial community. 5 sugar cane strains and 50 isolates were used. Gas chromatography was used for measuring nitrogenase activity and the influence of carbon and nitrogen sources and pH on cultures. Indol acetic (IAA) production was detected by Dot-Immunobinding and Salkowski's method. These results show that 19 strains and isolates had nitrogenase activity, values ranging from 100 to SOOO/zg/mL; 6 of them produced IAA (values ranging from 1,7 to 2,5 //g/mL): Gluconacetobacter diazotrophicus PAl-5, Gluconacetobacter diazotrophicus 1-05, Gluconacetobacter diazotrophicus 4-02,17,30 and 305. It was demonstrated that culture medium nutrient sources and pH affected the nitrogenase activity of the strains representing the endophytic community.
Key words: endophytic community, sugarcane, nitrogenase activity, indolacetic acid. |
|
|
INTRODUCCIÓN Uno de los mayores retos que enfrenta la humanidad es proteger el medio ambiente y al mismo tiempo |
satisfacer las necesidades alimentarias de la población mundial, por lo que se impone el tránsito hacia una agricultura ecológica sostenible. En este contexto, resulta de suma importancia el estudio y |
|
* Departamento de Microbiología, Facultad de Biología, Universidad de La Habana. Calle 25 entre J e I, Plaza, Ciudad de La Habana, Cuba. Correo electrónico: anar@fbio.uh.cu, anarjanet@gmail.com, mayra@fbio.uh.cu Recibido: diciembre 01 de 2004 Aceptado: junio 30 de 2005
|
|
|
|
|
|
66
|
|
|
__________CARACTERIZACIÓN FISIOLÓGICA DE LA COMUNIDAD MICROBIANA ENDÓFITA DE LA CAÑA DE AZÚCAR
|
|
|
|
|
|
explotación de los efectos beneficiosos que puede ejercer la microbiota endófita sobre las plantas de interés agrícola, como la caña de azúcar, importante fuente de calorías y materia prima de numerosos subproductos (Boddey, 1995).
Las bacterias endófitas tienen la ventaja sobre las bacterias rizosféricas, de la gran cantidad de nutrientes de que disponen, así como la protección que les brinda la planta de las condiciones adversas del medio (Rozyki et al., 1999; Reinhold y Hurek, 1998). Además, por hallarse en contacto íntimo con la planta, podrían brindar beneficios más directos a su hospedero en comparación con las bacterias rizosféricas. Por ejemplo, podrían excretar el amonio obtenido por nitrofijación, así como sustancias promotoras del crecimiento vegetal (Muthukumarasamy et al., 2000).
Se ha sugerido que el interior vegetal es un ambiente propicio para que se lleve a cabo la fijación biológica de nitrógeno (FBN), ya que este ambiente es bajo en oxígeno y relativamente alto en fuentes de carbono (James, 2000; James y Olivares, 1998; Sprent y James, 1995), por lo que las bacterias diazótrofas endófitas podrían fijar el nitrógeno y liberarlo directamente en el interior de las plantas (Döbereiner, 1997), contribuyendo con una parte de sus requerimientos nitrogenados (Boddey et al., 1995).
El estudio de las características fisiológicas de la microbiota endófita de la caña de azúcar constituye la piedra angular de las nuevas tecnologías de su cultivo, que posibiliten el uso de prácticas de producción sustentables, dirigidas hacia la explotación racional de los recursos naturales y la reducción del uso de sustancias químicas.
En este trabajo se persiguen los siguientes objetivos:
1. Caracterizar morfológicamen-te aislados de la comunidad endófita de caña de azúcar e identificar los que más contribuyan al desarrollo de este cultivo.
2. Determinar la capacidad de los miembros de la comunidad endófita de fijar el nitrógeno atmosférico y producir ácido indolacético (AIA).
|
3. Determinar cómo influyen las fuentes nutri-cionales en la actividad nitrogenasa de cepas endófitas representativas de la comunidad.
MATERIALES Y MÉTODOS
Material biológico empleado. En los experimentos realizados se utilizaron 5 cepas, 4 patrones y una de referencia, y 50 aislados no identificados, provenientes del interior de diferentes variedades de caña de azúcar (tabla 1).
Caracterización morfológico-tintorial de los aislados. A los 50 aislados no identificados provenientes de variedades comerciales de caña de azúcar se les practicó la tinción de Gram (Skerman, 1967) y observación de los caracteres micromorfológicos.
Determinación de la capacidad de realizar la fijación de nitrógeno atmosférico. Las cepas y aislados endófitos de caña de azúcar se sembraron en medio LGI semisólido (Sacarosa-K2HPO4-KH2PO4-MgSO4-CaCl2-Na2MoO4-FeCl3) (Reis et al., 1994) sin ninguna fuente de nitrógeno, y se incubaron a 30 °C durante 10 días. A los que crecieron en este medio se les midió actividad de reducción del acetileno (ARA) por cromatografía gaseosa, según metodología descrita por Hardy et al. (1968).
Determinación de la producción de ácido indolacético (AIA). Las cepas y aislados se cultivaron en
 |
|
|
|
|
67
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 66-75____________________________
|
|
|
|
|
|
medio SYP líquido (sacarosa-extracto de levadura-K2HPO4-KH2PO4) (Caballero-Mellado y Martínez-Romero, 1994) a 30 °C, 150 rpm, durante 3 días, y se centrifugó a 3000 rpm durante 5 minutos. Se detectó el AIA en los sobrenadantes mediante el método de inmunoabsorción por manchas (Rojas et al., 1999), el cual consiste en enfrentar los cultivos bacterianos a antisueros anti-AIA, obtenidos en conejos, y marcados con oro coloidal. La reacción antígeno-anticuerpo se visualizó a través de la formación de un halo rosado alrededor del punto de aplicación de la muestra. En los casos en que se detectó producción de AIA por inmunoabsorción por manchas se les realizó la cuantificación de AIA por el método colorimétrico de Salkowski modificado (Glickmann y Dessaux, 1995).
Influencia de diferentes fuentes de carbono, nitrógeno y pH sobre la actividad nitrogenasa. Del grupo de cepas y aislados, se seleccionaron las cepas patrones y de referencia para la realización de los ensayos fisiológicos para determinar la influencia de factores nutricionales y el pH en la actividad nitrogenasa.
Las cepas se cultivaron en medio LGI líquido durante 48 horas, a 30 °C y a 150 rpm, y los pre-inóculos se ajustaron al 0,5 de la Escala de Mac Farland con solución de ClNa al 0,8%. Se preparó medio LGI semisólido con las siguientes fuentes de carbono en una concentración final del 1%: xilosa, sacarosa, inositol, glucosa, fructosa, guarapo; con sacarosa al 1% y las siguientes fuentes de nitrógeno en una concentración final de 5 mM: sulfato de amonio, nitrato de potasio, asparagina, triptófano, treonina, arginina y sin nitrógeno, así como con sacarosa al 1% con los pH 3, 4, 5, 6, 7, 8. Se sembraron 10,mL de cada preinóculo en 5 mL de los medios descritos y se incubaron por 72 horas a 30 °C. Se inyectó acetileno para una atmósfera del 10% y se incubaron por 72 horas más. La cantidad de eti-leno producida se midió por cromatografía gaseosa (Hardy et al., 1968). Las determinaciones se realizaron por triplicado.
Los resultados de los estudios fisiológicos descritos se analizaron utilizando el paquete estadístico Tonystat (Sigarroa, 1987). Se emplearon pruebas paramétricas y no paramétricas: Análisis de varianza, prueba de Kruskal-Wallis, prueba de Comparación de medias de Duncan y prueba de Comparaciones múltiples no paramétricas.
|
RESULTADOS Y DISCUSIÓN
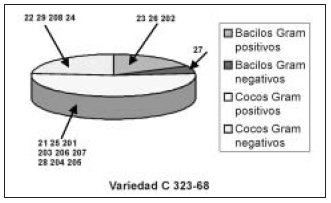
Caracterización morfológico-tintorial de los aislados. En las 3 variedades se observan bacilos Gram negativos y bacilos Gram positivos, así como cocos Gram positivos. En la variedad C 323-68 se encontraron además cocos Gram negativos. La distribución de grupos morfológicos en las 3 variedades se refleja en la figura 1. A pesar de que en la literatura no se ha informado la realización de estudios integrales de la comunidad bacteriana endófita en caña de azúcar, estos resultados muestran similitud con
|
 |
|
 |
|
 |
|
|
Figura 1. Distribución de grupos microbianos en las 3 variedades comerciales de caña de azúcar estudiadas.
|
|
|
|
|
|
68
|
|
|
______CARACTERIZACIÓN FISIOLÓGICA DE LA COMUNIDAD MICROBIANA ENDÓFITA DE LA CAÑA DE AZÚCAR
|
|
|
|
|
|
los obtenidos por Omoregie et al. (2004), los cuales mostraron la presencia de todos los grupos morfológico-tintoriales de bacterias dentro de tejidos sanos de plantas saludables.
En la variedad de caña de azúcar Cuba 1051-73 y Cuba 86-12 se observó predominio de bacilos, fundamentalmente Gram negativos, en la comunidad endófita; mientras en la variedad Cuba 323-68 se encontraron cocos Gram positivos en mayor proporción respecto al resto de los grupos microbianos. Esto pudiera deberse a la composición de la savia apoplástica y estar relacionado directamente con el tipo y concentración de fuentes nutricionales presentes en la planta (Ortega et al., 1999). Martínez-Romero y Caballero-Mellado (1996) plantearon que las amplias variaciones morfológicas y fisiológicas de los distintos grupos de organismos están influenciadas por la constitución genética de sus hospederos.
Existen evidencias de una relación evolutiva entre las bacterias y las plantas hospederas, las cuales establecen una interacción menos específica que la simbiosis de leguminosas y otras bacterias (Klas-senetal.,2003).
En maíz y teocintle se ha demostrado que la variabilidad genética de la planta hospedera desempeña un papel importante en el establecimiento de la asociación con la bacteria, sugiriendo una compatibilidad planta-bacteria. Al parecer las raíces pueden seleccionar a subpoblaciones específicas de la microbiota del suelo; esta selección se relaciona con la edad y el genotipo de la planta (Lemanceau et al., 1995).
Se ha encontrado que las poblaciones rizos-féricas de caña de azúcar difieren de las endófitas, lo cual constituye una evidencia más de que la planta selecciona las bacterias asociadas (López, 1996).
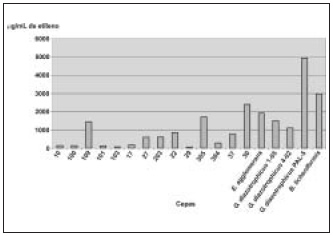
Determinación de la capacidad de realizar la fijación de nitrógeno atmosférico. Del total de cepas y aislados, 19 crecieron en medio LGI sin nitrógeno, y en estos se detectó actividad nitrogenasa por ARA (figura 2); es decir que una parte de la comunidad microbiana endófita de caña de azúcar tiene la capacidad de suministrarle nitrógeno a la planta en una forma asimilable, contribuyendo así al desarrollo de la planta, aspecto que ya había sido informado por otros autores (Boddey et al., 1995).
|
Entre los microorganismos que tuvieron actividad enzimática se encuentran cocos y bacilos, Gram negativos y Gram positivos, lo que corrobora que la fijación biológica del nitrógeno es un fenómeno bastante común en el micromundo y coincide con reportes en que se han descrito más de 100 géneros bacterianos con capacidad de realizar la fijación biológica del nitrógeno (Muthukumarasamy et al., 1999).
Las cepas que tuvieron mayor actividad enzimática fueron G. diazotrophicus cepa PAl-5, B. licheniformis cepa 5, 30, E. agglomerans cepa 2, 305, G. diazotrophicus cepa 1-05, 109 y G. diazotrophicus cepa 4-02; lo que coincide con los resultados de otros autores que informan que especies de los géneros Gluconacetobacter, Herbaspirillum, Azospirillum, Enterobacter, Klebsiella, Azoarcus, Burkholde-ria y Bacillus (Dobereiner, 1993; Boddey et al., 1991; Reinhold-Hurek et al., 1993; Gillis et al., 1995; Ma-vingui et al., 1992) son diazotrofos endófitos que se destacan por su aporte a las plantas gramíneas. En el caso de Gluconacetobacter diazotrophicus se informa que es el máximo responsable de las altas tasas de fijación biológica del nitrógeno detectada en las raíces y tallos de la caña de azúcar (Cavalcante y Döbereiner, 1988; Gillis et al., 1989; Ureta et al., 1995), lo que facilita el desarrollo del cultivo aún en ausencia de otro compuesto nitrogenado en el suelo. Los valores de actividad nitrogenasa de G. diazotrophicus y E. agglomerans son similares a los obtenidos por Boddey et al. (1991) y Li y Mac Rae (1992), respectivamente, para estas 2 especies diazotrofas, mediante detección cromatográfica de etileno formado a partir de acetileno.
|
 |
|
|
Figura 2. Determinación de la actividad nitrogenasa de aislados y cepas de la comunidad endófita de caña de azúcar mediante cromatografía gaseosa.
|
|
|
|
|
|
69
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 66-75____________________________
|
|
|
|
|
|
El hallazgo de microorganismos endófitos de caña de azúcar con capacidad de fijar el nitrógeno atmosférico incrementa el interés por el estudio de este fenómeno que pudiera verse afectado por diversos factores del medio ambiente.
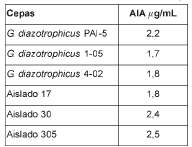
Determinación de la producción de ácido indolacético. Seis de las 55 bacterias en estudio (aislado17, aislado 305, aislado 30, G. diazotrophicus PAl-5, G. diazotrophicus 1-05, G. diazotrophicus 4-02) resultaron positivas para la producción de AIA.
Entre las cepas en que se pudo apreciar el halo que evidencia la reacción con los anticuerpos anti-AIA se incluyen las de G. diazotrophicus, especie en la cual ya se había demostrado su capacidad de producir AIA (Fuentes-Ramírez et al., 1993; Bastian cols., 1998) y citoquininas (Jiménez-Salgado et al., 1994).
Estos resultados se corroboraron mediante el método de Salkowski (tabla 2) y se demostró la producción de AIA. Este método resultó eficaz y sencillo para la detección y cuantificación de AIA. La adición de triptófano en el medio de cultivo favorece la producción de AIA, lo cual se sustenta en el hecho de que el triptófano es un intermediario de la vía biosintética del AIA (Glickmann y Dessaux, 1995).
Los valores de AIA obtenidos por este método son similares a los informados por Fuentes-Ramírez et al. (1993), los cuales estimaron por HPLC que las cepas de Gluconacetobacter diazotrophicus producen entre 0,14 y 2,42/j.glmL de AIA.
Los niveles de AIA presentes en los sobrenadantes de los cultivos resultaron bajos, comparados con los producidos por otras bacterias, entre las que se encuentran cepas de los géneros Azospirillum, Rhizobium (Bashan et al., 1996; Rojas y Pérez,
|
1998), Pseudomonas y Burkholderia (Hernández, 2002). Sin embargo, está demostrado que bajas concentraciones de fitohormona son capaces de estimular el desarrollo vegetal (Yahalometal., 1991, citado por Hernández, 2002). Estos autores también plantearon que concentraciones de AIA de 10-8 M estimulan el crecimiento radical, mientras que concentraciones mayores de 10-6M inhiben y reducen la zona de alargamiento.
Resulta interesante que los microorganismos en los que se detectó producción de AIA por ambos métodos, también poseen actividad nitrogenasa. Estos resultados apoyan la hipótesis propuesta por Bashan y Levanony (1990), en la que sostienen que existen varios mecanismos involucrados en la asociación planta-microorganismo, que actúan simultáneamente, y cuya suma, bajo condiciones ambientales favorables, deviene en los cambios observados en el crecimiento de las plantas. La capacidad de algunos integrantes de la microbiota nativa de la caña de azúcar de producir fitohormonas y realizar la fijación biológica del nitrógeno, constituye un criterio de selección importante de especies que en su relación con la planta contribuyen a su desarrollo y productividad.
Influencia de diferentes fuentes de carbono, nitrógeno y pH sobre la actividad nitrogenasa.
Existen evidencias de que el proceso de fijación biológica del nitrógeno depende del aporte de sustrato energético por parte de la leguminosa hospedera (Muthukumarasamy et al., 1999; Álvarezy Martínez-Drets, 1995). Como resultado de este estudio, se corroboró que la fuente carbonada presente en el medio de cultivo influye en la capacidad nitrofijadora de las cepas, inferida a través de la reducción del acetileno. En la figura 3 se observa el comportamiento de la actividad nitrogenasa de las 5 cepas seleccionadas con las 6 fuentes de carbono probadas.
En G. diazotrophicus PAl-5 no existen diferencias significativas entre los tratamientos con inositol y xilosa; con estos azúcares se lograron los más bajos valores de actividad nitrogenasa. Con glucosa, sacarosa y guarapo, se obtuvieron valores intermedios, mientras con fructosa se obtuvo la mayor actividad enzimática.
En G. diazotrophicus 1-05 se observaron diferencias significativas entre todos los tratamientos. Los valores más bajos de la enzima se obtuvieron
|
|
Tabla 2. Cuantificación de ácido indolacético
en sobrenadantes de cultivos bacterianos mediante
el método de Salkowski. Media de 3 réplicas
|
|
 |
|
|
|
|
|
70
|
|
|
CARACTERIZACIÓN FISIOLÓGICA DE LA COMUNIDAD MICROBIANA ENDÓFITA DE LA CAÑA DE AZÚCAR
|
||
|
|
||
 |
ser utilizados por G. diazotrophicus e impiden su actividad nitrogenasa y crecimiento en medios que los contengan (Álvarez y Martínez-Drets, 1995).
Para todas las cepas, la fructosa es el azúcar que más favorece la actividad nitrogenasa. También la sacarosa, el guarapo y la glucosa constituyen fuentes carbonadas que favorecen esta actividad enzimática, pero existen diferencias entre cepas. Esto pudiera explicarse por el rendimiento de ATP obtenido por molécula de carbohidrato utilizada (Limmer y Drake, 1998), por lo que un mayor rendimiento favorece tanto el crecimiento como la actividad nitrogenasa de los diazotrofos estudiados.
|
|
|
Figura 3. Actividad nitrogenasa de cepas de Gluconacetobacter diazotrophicus PAl-5,4-02 y 1 -05, Enterobacteragglomerans cepa 2 y
|
||
|
Bacillus licheniformis cepa 5 cultivadas en medio LGI con diferentes fuentes de carbono. Letras no comunes indican diferencias significativas en la prueba de Comparación de medias de Duncan para p < 0,05.
|
Además, la fructosa y la sacarosa son los azúcares que se encuentran en mayor proporción en el jugo de la caña de azúcar, hábitat natural de estos endófitos (Fuentes-Ramírez et al., 1999),
por lo que ellos poseen las enzimas necesarias para
su degradación.
Por otra parte, la degradación de esos azúcares pudiera estar relacionada con algún mecanismo de protección contra el oxígeno, lo que ha sido observado para la glucosa y el gluconato, los cuales parecen intervenir contrarrestando la acción del oxígeno como inhibidor del sistema nitrogenasa (Álvarez y Martínez-Drets, 1995).
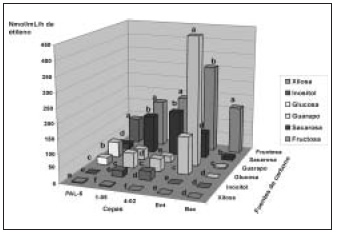
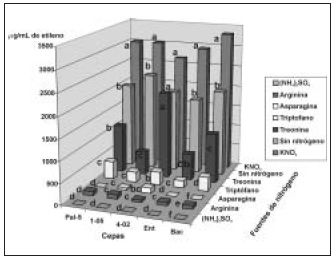
Con respecto a la influencia de las fuentes de nitrógeno, a pesar de realizarse el ensayo con cepas, incluso de diferentes géneros bacterianos, se observa un comportamiento similar frente a las fuentes nitrogenadas (figura 4).
Mediante el análisis estadístico de los resultados del experimento realizado con las 6 fuentes de nitrógeno y sin nitrógeno, se determinó que existen diferencias significativas entre los tratamientos en G. diazotrophicus cepas PAl-5, 1-05 y 4-02, E. agglomerans cepa 2 y B. licheniformis cepa 5.
En G. diazotrophicus cepa PAl-5 se obtuvieron valores muy bajos con (NH4)2SO4,argininayasparagi-na, sin existir diferencias entre ellas. Con triptófano y treonina se obtuvieron valores intermedios, mientras con KNO3 y sin nitrógeno se obtuvieron los mayores niveles de actividad enzimática; con esta última fue significativamente mayor. Un comportamiento similar se observó en G. diazotrophicus cepa 1-05, pero en
|
|
|
con xilosa y los valores más altos con fructosa y sacarosa.
En G. diazotrophicus cepa 4-02 también existen diferencias significativas entre los valores obtenidos usando las 6 fuentes de carbono. Al igual que en PAl-5 y 1-05, la xilosa fue el azúcar menos favorable para la actividad nitrogenasa. Con inositol, glucosa y guarapo los valores fueron relativamente bajos. La fructosa y la sacarosa permitieron las más altas determinaciones de la actividad enzimática.
La actividad nitrogenasa de E. agglomerans cepa 2 con xilosa e inositol fue nula. Además se observan diferencias significativas entre el resto de los tratamientos; los valores más altos se encontraron con guarapo, fructosa y glucosa, en este orden.
B. licheniformis cepa 5 carece de actividad nitrogenasa cuando se siembra en xilosa, inositol y glucosa. Con guarapo y sacarosa se presentan valores bajos; sin embargo, con fructosa la actividad nitrogenasa es mayor.
El hecho de que las fuentes de carbono xilosa e inositol inhiban la actividad nitrogenasa de las cepas seleccionadas pudiera deberse a la carencia de enzimas para el transporte y/o degradación de estos azúcares o al bajo rendimiento energético resultante de su metabolismo, teniendo en cuenta la gran demanda energética de la nitrofijación. Algo similar ha sido demostrado para los ácidos dicarboxílicos como succinato, fumarato y malato, los cuales no pueden
|
||
|
|
||
|
71
|
||
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 66-75_______________________________
|
|
|
|
|
|
ADPribosil alaarginina 101 deladinitrogenasare-ductasa. En otros organismos ocurre este mismo fenómeno, con modificación en la arginina 100. Este proceso puede ser revertido por la acción de otra enzima, la cual remueve el grupo ADP ribosil de la arginina y se restablece la actividad del sistema (Kim et al., 2004).
Con treonina, triptófano, arginina y asparagi-na como fuentes de nitrógeno, se evidencia inhibición parcial de la actividad enzimática, quizás consecuencia de mecanismos similares de desactivación de la fijación biológica del nitrógeno, posiblemente no tan eficientes.
|
|
 |
|
Figura 4. Actividad nitrogenasa de cepas de Gluconacetobacter diazotrophicus PAI-5, 4-02 y 1-05, Entereobacter agglomerans y Bacillus lichenformis cultivadas en medio LGI con diferentes fuentes de nitrógeno. Letras no comunes indican diferencias significativas en la prueba de Comparaciones múltiples no paramétricas para p < 0.05. esta cepa no existen diferencias entre los tratamientos con arginina, asparagina, triptófano y treonina. |
Se obtuvieron los mayores valores de actividad nitrogenasa en medio LGI cib KNO3 y sin nitrógeno; resulta contradictorio que la presencia de KNO3 estimule la actividad nitrogenasa .
|
|
esta cepa no existen diferencias entre los tratamientos con arginina, asparagina, triptófano y treonina. En G. diazotrophicus cepa 4-02 no existen diferencias entre KNO3, treonina y sin nitrógeno, fuentes nitrogenadas con las que se obtuvieron valores muy altos de actividad nitrogenasa. Con el resto de las fuentes se obtuvieron valores bajos de la actividad enzimática, sin diferencias entre asparagina y triptófano.
En E. agglomerans cepa 2 no hay diferencias entre (NH4)2SO4y asparagina, y entre arginina, triptófano y treonina, con los que se obtuvieron valores bajos e intermedios de actividad nitrogenasa, respectivamente. Con KNO3y sin nitrógeno se obtuvieron los mayores niveles de actividad enzimática, con diferencias entre ellos.
En B. licheniformis cepa 5 no se detectó actividad nitrogenasa con (NH4)2SO4 y asparagina. Con KNO3 y sin nitrógeno se obtuvieron los valores más altos de actividad enzimática; fue significativamente mayor con KNO3.
De forma general, con el medio suplementado con (NH4)2SO4se observó inhibición total de la actividad nitrogenasa, lo que puede deberse a la modificación covalente de la nitrogenasa reductasa; así, en Rhodospirillum rubrum se ha observado que, en presencia de iones NH4+, la enzima dinitrogenasa reductasa ADP-ribosil transferasa adiciona un grupo
|
Con respecto a esto, existen reportes que señalan que los nitratos no afectan la fijación biológica de G. diazotrophicus (Li y MacRae, 1992; Cordovilla y Lluch, 1999), lo que pudiera deberse a la carencia de la enzima nitrato reductasa (Álvarez y Martínez Drets, 1995), fenómeno que también impide su crecimiento en medio LGI líquido con KNO3como única fuente de nitrógeno. En el caso de E. agglomerans cepa 2 y B. licheniformis cepa 5, se considera que este fenómeno pudiera deberse a que el suministro de bajos niveles de esta fuente de nitrógeno acelera el crecimiento y permite obtener mayor cantidad de biomasa capaz de realizar la fijación biológica del nitrógeno.
Estos resultados concuerdan con los obtenidos por Muthukumarasamy et al. (1999), quienes observaron que G. diazotrophicus y Herbaspirillum spp. son capaces de fijar nitrógeno en presencia de extracto de levadura y NO3- en bajas concentraciones, por debajo de 10 mM.
En G. diazotrophicus se ha informado que la sensibilidad de la nitrogenasa al oxígeno y nitrógeno combinado depende de la concentración de sacarosa en el medio de cultivo. Una concentración del 10% de sacarosa disminuye la asimilación del nitrógeno combinado y algunos aminoácidos, favoreciendo la expresión de la nitrogenasa aun en su presencia. Este mecanismo resulta de gran interés considerando el hábitat de G. diazotrophicus, normalmente rico en sacarosa, por lo que su nitrogenasa podría estar activa aun cuando la bacteria disponga de compuestos nitrogenados (Reis y Döbereiner, 1998).
|
|
|
|
|
72
|
|
|
CARACTERIZACIÓN FISIOLÓGICA DE LA COMUNIDAD MICROBIANA ENDÓFITA DE LA CAÑA DE AZÚCAR
|
|
|
|
|
|
Existen evidencias de que los organismos dia-zotrofos son capaces de realizar la fijación biológica del nitrógeno en un rango de pH más o menos amplio y que la actividad del sistema nitrogenasa tiene una función importante en la regulación del pH, ya que al exportar amonio evitan la acidificación letal del espacio peribacteroideo, contrarrestando la acción de la bomba de protones con actividad ATPasa (H+-ATPasa) en la membrana peribacteroidea (Corzo et al., 1999).
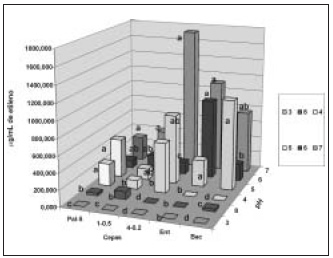
Según los resultados de este trabajo, en las cepas G. diazotrophicus PAl-5 y 4-02, E. agglomerans cepa 2 y B. licheniformis cepa 5 existen diferencias significativas en la actividad nitrogenasa, cuando se siembran en medio LGI a diferentes pH; mientras en la cepa G. diazotrophicus 1-05 no se observaron diferencias significativas entre los tratamientos (figura 5).
Como puede observarse, la cepa G. diazotrophicus PAl-5 exhibe valores mayores de actividad nitrogenasa a pH 5, 7 y 4, entre los cuales no hay diferencias significativas, valores intermedios a pH 6, y valores muy bajos a pH 8; se encuentra que a pH 3 no hay evidencia de actividad enzimática.
En la cepa G. diazotrophicus 4-02 los valores más altos de actividad nitrogenasa se obtienen a pH 7 y pH 5, sin diferencias entre estos. A pH 4 y 6 se obtuvieron valores intermedios, mientras que a pH
|
extremos 3 y 8 no hay evidencia de esta actividad enzimática.
La actividad nitrogenasa de E. agglomerans cepa 2 se detectó a pH 6, 7 y 5, sin diferencias entre los mismos; pero fue nula a pH 3, 4 y 8.
La cepa de B. licheniformis presentó los valores más altos de actividad nitrogenasa a pH 5 y 7, sin diferencias entre ellos; valores intermedios a pH 6 y 8, y carece de actividad nitrogenasa a pH 3 y 4.
La actividad nitrogenasa de las cepas endófitas en estudio se favorece cuando estas se cultivan a pH ácido a neutro, entre 5 y 7, y se inhibe a pH 3 y 8. Estos resultados son similares a los informados para las bacterias endófitas G. diazotrophicus y Herbaspi-rillum spp. aisladas de caña de azúcar por Muthuku-marasamy et al. (1999).
Estudios realizados en Rhizobium leguminosa-rum bajo diferentes condiciones de pH y de ppO28 indican que cuando el pH del entorno bacteriano es ligeramente ácido, rápidamente el medio que rodea a los bacteroides se torna neutro, debido a la acción de la nitrogenasa (Corzo et al., 1999). Por ello, no es descartable que los protones exógenos faciliten la homeostasisdel pH bacteroideo, estimulando la actividad nitrogenasa.
Sin embargo, si el bombeo de protones en la membrana bacteroidea es superior a la máxima capacidad de su utilización por parte del bacteroi-de, se produce la acidificación y se inhibe la actividad nitrogenasa. Por el contrario, si el aporte de hi-drogeniones es inferior a las necesidades del bacteroide, su pH interno aumenta. Este fenómeno también disminuye la actividad nitrogenasa (Corzo etal., 1999).
Sin embargo, las cepas de G. diazotrophicus son más tolerantes que E. agglomerans cepa 2 y B. licheniformis cepa 5, y mantienen actividad nitrogenasa a pH 4, lo que coincide con los resultados de otros autores que refieren que G. diazotrophicus lleva a cabo la fijación biológica del nitrógeno en condiciones microaerofílicas a pH ácido (Stephan etal., 1991).
En este trabajo se demostró que las fuentes de carbono y nitrógeno influyen en la actividad nitrogenasa de las 5 cepas endófitas seleccionadas para el
|
 |
|
|
Figura 5. Actividad nitrogenasa de cepas de Gluconacetobacter diazotrophicus PAl-5, 4-02 y 1-05, Enterobacter agglomerans y Bacillus licheniformis cultivadas en medio LGI a diferentes pH. Letras no comunes indican diferencias significativas en la prueba de Comparaciones múltiples no paramétricas para p < 0,05.
|
|
|
|
|
|
73
|
|
|
REVISTA COLOMBIANA DE BIOTECNOLOGÍA VOL. VII No. 1 Julio 2005 66-75_____________________________
|
|
|
|
|
|
estudio, por lo que es necesario tener en cuenta estos factores al elaborar los medios de cultivo. Además, el estudio de los factores que influyen sobre la actividad nitrogenasa de las cepas endófitas de la caña de azúcar permite comprender mejor la interacción planta-microorganismo y obtener provecho de la misma mediante su aplicación en la agricultura. Del mismo modo, la determinación de la capacidad de fijar nitrógeno atmosférico y producir sustancias promotoras del crecimiento vegetal constituyen criterios fundamentales en la selección de cepas que contribuyen al crecimiento y desarrollo de la planta.
CONCLUSIONES
La composición de la comunidad microbiana endófi-ta de caña de azúcar varía en dependencia de la variedad del cultivo.
De los 55 aislados y cepas provenientes del interior de variedades de caña de azúcar, 19 realizan la fijación biológica del nitrógeno y 6 producen AIA.
Las fuentes carbonadas guarapo, sacarosa y fructosa, presentes en el medio de cultivo, estimulan la actividad nitrogenasa de los diazotrofos representativos de la comunidad; la actividad nitrogenasa fue mayor en ausencia de nitrógeno, así como con la adición de KNO3.
El crecimiento y actividad nitrogenasa de los diazotrofos estudiados se favorece a pH entre 5 y 7, y se inhibe a pH extremos.
BIBLIOGRAFÍA
Álvarez, B.; Martínez-Drets, G. 1995. Metabolic characteriza-tion of Acetobacter diazotrophicus. Can. J. Microbiol. 41:918-924.
Bashan, Y.; Holguín, G.; Ferrera, C. 1996. Interacciones entre plantas y microorganismos benéficos. Terra. 14: 159-192.
Bashan,Y.; Levanony, H. 1990. Current status of Azospirillum inoculation technology: Azospirillum as a challenge for agriculture. Can. J. Microbiol. 36: 591-608.
Bastian, F.; Cohen, A.; Piccoli, P.; Luna, V.; Baraldi, R.; Bottini, R. 1998. Production of indole-3-aceticacid and gibbere-llins A1 y A3 by Acetobacter diazotrophicus and Her-baspirillum seropedicae in chemically-defined culture media. Plant Growth Reg. 24: 7-11.
Boddey, R. 1995. Biological Nitrogen Fixation in Sugarcane: A key for energetically viable bio fuel production. Critical Rew. In Plant Sci. 14: 263-279.
|
Boddey, R. M.; Oliveira, O. C.; Urquiaga, S.; Reis, V.; Olivares, F.; Baldani, V. L. D.; Döbereiner, J. 1995. Biological nitrogen fixation associated with sugarcane and rice: con-tribution and prospects for improvement. Plant and Soil. 174: 195-209.
Boddey, R. M.; Urquiaga, S.; Reis, V.; Döbereiner, J. 1991. Biological nitrogen fixation associated with sugar cane. Plant Soil. 137: 111-117.
Caballero-Mellado, J.; Martínez-Romero, E. 1994. Limited ge-netic diversity in the endophytic sugarcane bacterium Acetobacter diazotrophicus. Appl. Environ. Microbiol. 60: 1532-1537.
Cavalcante, V. A.; Döbereiner, J. 1988. A new acid tolerant ni-trogen-fixing bacterium associated with sugar cane. Plant and Soil. 108:23-31.
Cordovilla, M.; Ligero, F.; Lluch, C. 1999. Effects of NaCl on growth and nitrogen fixation and assimilation of inocula-ted and KNO3 fertilized Vicia faba L. and Pisum sativum L. plants. Plant Science. 140: 127-136.
Corzo, J.; Santamaría, M.; Gutiérrez-Navarro, A. M. 1999. Acoplamiento energético entre el bacteroide y la leguminosa hospedadora: un modelo integrado. http://nostoc.usal.es/sefin/Corzo.html
Döbereiner, J. 1993. Recent canges in concepts of plant bacteria interactions: endophytic N2 fixing bacteria. Ciencia y Cultura: 1-16.
Döbereiner, J. 1997. Biological nitrogen fixation in the tropics: social and economic contributions. Soil Biol and Bioch. 29: 771-774.
Fuentes-Ramírez, L. E., Caballero-Mellado, J.; Sepúlveda, J.; Martínez, E. 1999. Colonization of sugarcane by Acetobacter diazotrophicus is inhibited by high N-fertilization. Microbiol. Ecol. 29: 117-128.
Fuentes-Ramírez, L. E.; Jiménez-Salgado, T.; Abar-ca-Ocampo, I. R.; Caballero-Mellado, J. 1993. Acetobacter diazotrophicus, and indolacetic acid producing bacterium isolated from sugarcane cultivars of Mexico. Plant Soil. 154: 145-150.
Gillis, M.; Kersters, K.; Hoste, B.; Janssens D.; Kroppenstedt, R. M.; Sephan, M.P.; Texeira, K. R.; Dobereiner, J.; De Ley, J. 1989. Acetobacter diazotrophicus spp. nov., a nitrogen fixing acetic acid bacterium associated with sugarcane. Int. J. Syst. Bacteriol. 39: 361-364.
Gillis, M.; Van Tran, V.; Bardin, R.; Goor, M.; Hebra, P.; Wi-llems, A.; Segers, P.; Kersters, K.; Heuin, T.; Fernández, M. P. 1995. Polyphasic taxonom in the genus Burk-holderia leading to an emended description of the genus and proposition of Burkholderia vietnamiensis sp. nov. for N2 fixing isolates from rice in Vietnam. Int. J. Syst. Bacteriol. 45: 274-289.
Glickmann, E.; Dessaux, Y. 1995. A critical examination of the specificity of the Salkowski Reagent for indolic com-pounds produced by phytopathogenic bacteria. Appl. Environ. Microbiol. 61: 793-796.
Hardy R.W.; Holsten, R. D.; Jackson E. K.; Burns, R. C. 1968. The acetylene-ethylene assay for N2 fixation: laboratory and field evaluation. Plant Physiol. 43: 1185-1207.
|
|
74 |
|
|
________CARACTERIZACIÓN FISIOLÓGICA DE LA COMUNIDAD MICROBIANA ENDÓFITA DE LA CAÑA DE AZÚCAR
|
|
|
|
|
|
Hernández, A. 2002. Obtención de un biopreparado a partir de rizobacterias asociadas al cultivo del maíz (Zea Mays L.). Tesis de doctorado. Universidad de La Habana.
Heydrich, M.; Rojas, M.; Prieto, A.; Manzano, J. 1998. Isola-tion and characterization of Acetobacter diazotrophicus from differentvarieties of sugarcane in Cuba. 16th North american Conference of Symbiotic Nitrogen Fixation. Cancún, México (VII). 20 p.
James, E. K. 2000. Nitrogen fixation in endophytic and asso-ciative symbiosis. Field Crops Research. 65: 197-209.
James, E. K.; Olivares, F. L. 1998. Infection and colonization of sugar cane and other gramineous plants by endophytic diazotrophs. Crit. Rev. Plant Sci. 17: 77-119.
James, E. K.; Olivares, F. L. 1998. Infection and colonization of sugar cane and other graminaceous plants by endophytic diazotrophs. Crit. Rev.. Plant Sci. 17: 77-119.
Jiménez-Salgado, T.; Aparicio Fabré, R.; Caballero-Mellado, J. 1994. Detección de citocininas en Acetobacter diazotrophicus aislado de caña de azúcar. XVII Reunión Latinoamericana de Rhizobiología. La Habana, Cuba.
Kim, K.;Zhang,Y.; Roberts, G. P.2004. Characterization ofal-tered regulation variants of dinitrogenase reducta-se-activating glycohydrolase from Rhodospirillum ru-brum. FEBS Letters. 559: 84-88.
Klassen, G.; Pedrosa, F.; de Souza, E.M.; Yates, M. G.; Rigo, U. 2003. Nitrogenase activity of Herbaspirillum seropedi-cae grown under low iron levels requires the products of nifXorfl genes. FEMS Microbiol. Letters. 224,2:255-259.
Lemanceau, P.; Corberand, T.; Gardan, L.; Latour, X., Lague-rre, G.; Boeuffras, J.; Alabouvette, C. 1995. Effectof two plant species, flax (Linum usitassium L.) and tomato (Lycopersicon esculentum Mill.) on the diversity of soil-borne populations of fluorescent pseudomonads. Appl. Environ. Microbiol. 61: 1004-1012.
Li, R.; MacRae, I. C. 1992. Isolation and identification of N2-fi-xing enterobacteria associated with sugarcane in tropical Australia. J. Gen. Appl. Microbiol. 38: 523-531.
Limmer, C.; Drake, H. L. 1998. Effects of carbon, nitrogen and electron acceptor availability on anaerobic N2-fixation in a beech forest soil. Soil Biol. and Bioch. 30: 153-158.
López, R. L. 1996. Diversidad de los diazotrofos Klebsiella sp. y Azospirillum sp. asociados a la caña de azúcar. Tesis de maestría, Benemérita Universidad Autónoma de Puebla.
Martínez-Romero, E.; Caballero-Mellado, J. 1996. Rhizobium phylogenies and bacterial genetic diversity. Crit. Rev. Plant Sci. 15: 113-140.
Mavingui, P.; Laguerre, G.; Berge, O.; Heulin, T. 1992. Gene-tic and phenotypic diversity of Bacillus polymyxa in soil and in the wheat rhizosphere. Appl. Environ. Microbiol. 50: 1894-1903.
Muthukumarasamy, R.; Rebathi, G.; Vadivelu, M. 2000. Anta-gonistic potential of N2-fixing Acetobacter diazotrophicus against Colletotrichum falcatum Went., a causal of red-rot of sugarcane. Curr. Sci. 78: 1063-1065.
Muthukumarasamy, R.; Revathi, G.; Lakshminarasimhan, C. 1999. Influence of N fertilization on the isolation of Acetobacter diazotrophicus and Herbaspirillum sp. from
|
Indian sugarcane varieties. Biol. Fertil. Soils. 29: 157-164.
Omoregie, E. O.; Crumbliss, L. L.; Bebout, B. M.; Zehr, J. P. 2004. Comparison of diazotroph community structure in Lyngbya sp. and Microcoleus chthonoplastes domina-ted microbial mats from Guerrero Negro, Baja, México. FEMS Microbiol. Ecology. 47: 305-318.
Ortega, E.; Rodés, R.; Heydrich, M.; McCully, M.; Canny, M. 1999. Fijación de nitrógeno en la caña de azúcar, actualidad y perspectivas. En: Biodiversidad y biotecnología de la caña de azúcar. A. D. Arencibia y M. T. Cornide (eds.). Elfos Scientiae, 162 p.
Reinhold-Hurek, B.; Hurek, T. 1998. Life in grasses: diazotrop-hic endophytes. Trends Microbiol. 6: 139-144.
Reinhold-Hurek, B.; Hurek, T.; Gillis, M.; Horte, B.; Vancan-ney, M.; Kersteos, K.; De Ley, Y. 1993. Azoarcus gen. nov., nitrogen-fixing proteobacteria associated with roots of kollar grass. Trends Microbiol. 3: 39-48.
Reis, V. M.; Döbereiner, J. 1998. Effectof high sugarconcen-tration on nitrogenase activity of Acetobacter diazotrophicus. Arch. Microbiol. 171: 13-18.
Reis, V. M.; Olivares, F. L.; Döbereiner, J. 1994. Improved methodology for isolation of Acetobacter diazotrophicus and confirmation of its endophytic habitat. World J. of Microbiol. and Biotech. 10: 401-405.
Rojas, M., Heydrich, M.; López, M. 1999. Identificación de Acetobacter diazotrophicus por métodos serológicos. Cultivos Tropicales. 20(3): 11-15.
Rojas, M.; Prieto, J.; Heydrich, M. 2001. Interrelaciones en la comunidad endófita de la caña de azúcar. VII taller de la Cátedra de Medio Ambiente, Cuba.
Rojas, M. M.; Pérez, L.C. 1998. Mejoramiento de las condiciones de cultivo para la producción de ácido indol acético por R. Meliloti. Biología. 12: 65-70.
Rózycki, H.; Dahm, H.; Strzelczyk, E., Li, C. Y. 1999. Diazo-trophic bacteria in root-free soil and in the root zone of pine (Pinus sylvestris L.) and oak (Quercus robur L.). Applied Soil Ecology. 12: 239-250.
Sigarroa, A. 1987. Manual de prácticas de biometría y diseño experimental. Editorial Pueblo y Educación.
Skerman, V. B. D. 1967. Aguide to the identification of genera of bacteria. 2thed. Baltimore:TheWilliamsyWilkinsCo.
Sprent, J. I.; James, E. K. 1995. N2-fixation by endophytic bacteria: questions of entry and operation. En: Azospirillum VIandrelatedmicroorganism. I. Fendrik, M. del Gallo, J. Vanderleyden, M. de Zamaroczy (eds.). Berlín: Sprin-ger-Verlag, pp. 15-30.
Stephan, M. P.; Oliveira, M.; Teixeira, K. R. S.; Martínez-Drets, G.; Döbereiner, J. 1991. Phisiology and dinitrogen fixation of Acetobacter diazotrophicus. FEEMS Microbiol. Lett. 7: 67-72.
Ureta, A.; Álvarez, B.; Ramón, A.; Vera, M. A.; Martínez-Drets, G. 1995. Identification of Acetobacter diazotrophicus, Herbaspirillum seropedicae and Herbaspirillum rubrisu-balbicans using biochemical and genetical criteria. Plant and Soil. 172:271-277.
|
|
75
|
|
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2005 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).


















