Embriogénesis somática en el cultivar de plátano ‘FHIA – 25’ (AAB) a partir de ápices meristemáticos
Somatic embryogenesis in plantain cultivar 'FHIA - 25' (AAB) from meristem tips
DOI:
https://doi.org/10.15446/rev.colomb.biote.v17n2.45711Palabras clave:
embrión somático, plátano, suspensiones celulares embriogénicas (es)El cultivar de plátano ‘FHIA – 25’ (AAB), posee excelente rendimiento y alta resistencia a “Sigatoka negra”, pero con la limitante del bajo contenido de azúcar en su fruto, lo cual hace que sea necesario disponer de un método de regeneración de plantas a nivel celular como la embriogénesis somática, que se complemente a técnicas biotecnológicas de transformación genética para mejorar la calidad del fruto. El presente trabajo se realizó con el objetivo de establecer una metodología de regeneración vía embriogénesis somática a partir del explante inicial ápices de brotes axilares establecidos directamente en medio de cultivo líquido. Se obtuvieron suspensiones celulares embriogénicas homogéneas a partir del explante antes mencionado. Se lograron las mayores tasas de multiplicación a la densidad celular de 3,0%. La incubación de los embriones somáticos durante 30 días en el medio de cultivo de maduración permitió incrementar la germinación de los mismos. Durante la fase de aclimatización las plantas provenientes de los embriones somáticos, así como las plantas regeneradas por organogénesis, mostraron un alto porcentaje de supervivencia (98 y 97 %, respectivamente), sin la presencia de variación somaclonal.
Plantain cultivar 'FHIA – 25' (AAB) shows high yielding qualities and high resistance to Black Sigatoka disease, but its sugar content in the fruit is low, so a regeneration method at cell level is necessary, such as somatic embryogenesis supported by biotechnological tools to improve fruit quality. This work was performed with the aim of establishing a plant regeneration method via somatic embryogenesis using initial explants of shoot apices from axillary buds in liquid culture medium. Homogenous embryogenic cell suspensions were obtained from mentioned explants. The highest cellular multiplication rates were achieved at 3,0% density. The incubation of somatic embryos during 30 days in the maturation culture medium permitted to increase germination. During the acclimatization stage, plants regenerated from somatic embryos, as well as plants from organogenesis, showed a high survival percentage (98 and 97 respectively), without somaclonal variation.
Key words: somatic embryo, Musa, cell suspensions.
DOI: https://doi.org/10.15446/rev.colomb.biote.v17n2.45711
ARTÍCULO DE INVESTIGACIÓN
Embriogénesis somática en el cultivar de plátano 'FHIA - 25' (AAB) a partir de ápices meristemáticos
Somatic embryogenesis in plantain cultivar 'FHIA - 25' (AAB) from meristem tips
Dayana Rodríguez González*, Jorge López Torres**, Aymé Rayas***, Nery Montano Pérez****, Arletys Santos Pino***, Milagros Basail Pérez***, Damicela Reynaldo Alvarez****, Yoel Beovides García***, Víctor Medero Vega**
* Lic. en Biología. Laboratorio de Biotecnología Vegetal. Instituto de Investigaciones de Viandas Tropicales (INIVIT), Cuba. E-mail: tculture.biotec@inivit.cu
** Investigador Titular. Laboratorio de Biotecnología Vegetal. INIVIT. Cuba
*** Investigador Auxiliar. Laboratorio de Biotecnología Vegetal. INIVIT. Cuba
**** Técnico de Investigaciones. Laboratorio de Biotecnología. INIVIT. Cuba
Recibido: diciembre 10 de 2014 Aprobado: septiembre 21 de 2015
Resumen
El cultivar de plátano 'FHIA – 25' (AAB), posee excelente rendimiento y alta resistencia a "Sigatoka negra", pero con la limitante del bajo contenido de azúcar en su fruto, lo cual hace que sea necesario disponer de un método de regeneración de plantas a nivel celular como la embriogénesis somática, que se complemente a técnicas biotecnológicas de transformación genética para mejorar la calidad del fruto. El presente trabajo se realizó con el objetivo de establecer una metodología de regeneración vía embriogénesis somática a partir del explante inicial ápices de brotes axilares establecidos directamente en medio de cultivo líquido. Se obtuvieron suspensiones celulares embriogénicas homogéneas a partir del explante antes mencionado. Se lograron las mayores tasas de multiplicación a la densidad celular de 3,0%. La incubación de los embriones somáticos durante 30 días en el medio de cultivo de maduración permitió incrementar la germinación de los mismos. Durante la fase de aclimatización las plantas provenientes de los embriones somáticos, así como las plantas regeneradas por organogénesis, mostraron un alto porcentaje de supervivencia (98 y 97 %, respectivamente), sin la presencia de variación somaclonal.
Palabras clave: embrión somático, Musa, suspensiones celulares.
Abstract
Plantain cultivar 'FHIA – 25' (AAB) shows high yielding qualities and high resistance to Black Sigatoka disease, but its sugar content in the fruit is low, so a regeneration method at cell level is necessary, such as somatic embryogenesis supported by biotechnological tools to improve fruit quality. This work was performed with the aim of establishing a plant regeneration method via somatic embryogenesis using initial explants of shoot apices from axillary buds in liquid culture medium. Homogenous embryogenic cell suspensions were obtained from mentioned explants. The highest cellular multiplication rates were achieved at 3,0% density. The incubation of somatic embryos during 30 days in the maturation culture medium permitted to increase germination. During the acclimatization stage, plants regenerated from somatic embryos, as well as plants from organogenesis, showed a high survival percentage (98 and 97 respectively), without somaclonal variation.
Key words: somatic embryo, Musa, cell suspensions.
Introducción
Los bananos (Musa spp.) constituyen una fuente importante de alimento para gran parte de la población mundial, y se cultivan en el mundo más de cinco millones de hectáreas con una producción anual de 106 714 204.76 toneladas (FAO, 2015).
En Cuba, se producen anualmente unas 150 000 toneladas (FAO, 2015) y su cultivo contribuye a lograr la estabilidad de productos alimentarios en el mercado, debido a su capacidad de producir durante todos los meses del año, sus arraigados hábitos de consumo, así como su diversidad de usos (Rodríguez, 2000).
Sin embargo, a partir de noviembre de 1990, se detectó en los cultivos de Musa la aparición de la enfermedad conocida como "Sigatoka negra", causada por el hongo Mycosphaerella fijiensis Morelet, que afectó severamente las áreas dedicadas a la siembra de plátanos y bananos susceptibles a esta enfermedad, las cuales fueron reemplazadas progresivamente por otros cultivares (Sánchez et al., 2002). Una opción para este problema ha sido la introducción de híbridos de bananos y plátanos más resistentes o tolerantes a esta enfermedad, procedentes de la Federación Hondureña de Investigaciones Agrícolas (FHIA). Dentro de ellos, el cultivar de plátano 'FHIA – 25' (AAB) posee excelente rendimiento y es altamente resistente a "Sigatoka negra", pero su fruto muestra la limitante del bajo contenido de azúcar, inherente a las limitantes que posee la mejora clásica debido a que los principales cultivares comerciales son estériles, no producen semillas y la mayoría son partenocárpicos (Stover y Simmonds, 1987). Ante este panorama es prioritario disponer de un método de regeneración de plantas a nivel celular, como la embriogénesis somática, que se complemente a técnicas biotecnológicas de transformación genética para mejorar la calidad del fruto (Kamle et al., 2011).
La embriogénesis somática (ES) es una vía de morfogénesis en la que ocurre la formación de un embrión a partir de una célula somática o grupos de ellas. El embrión no es producto de la fusión de gametos (Merkle et al., 1995) y la misma se fundamenta en la teoría que todas las células vegetales tienen la capacidad para formar plantas completas (Steward et al., 1958).
La embriogénesis somática constituye una herramienta auxiliar a las técnicas biotecnológicas para la mejora genética de los bananos (Perea, 2001; Escalant y Jain, 2004), además de permitir obtener producciones superiores en un menor período de tiempo y a un costo más bajo, lo cual hace que este método sea potencialmente más eficiente que la regeneración vía organogénesis (Ibaraki y Kurata, 2001).
Tomando en consideración los antecedentes descritos, se desarrolló la investigación con el objetivo de establecer una metodología de regeneración de plantas vía embriogénesis somática a partir del explante inicial de ápices de brotes axilares.
Materiales y métodos
La investigación se realizó en el Instituto de Investigaciones de Viandas Tropicales (INIVIT), ubicado en Santo Domingo, Villa Clara, Cuba. El mismo se llevó a cabo durante el período comprendido entre enero de 2012 y febrero de 2013.
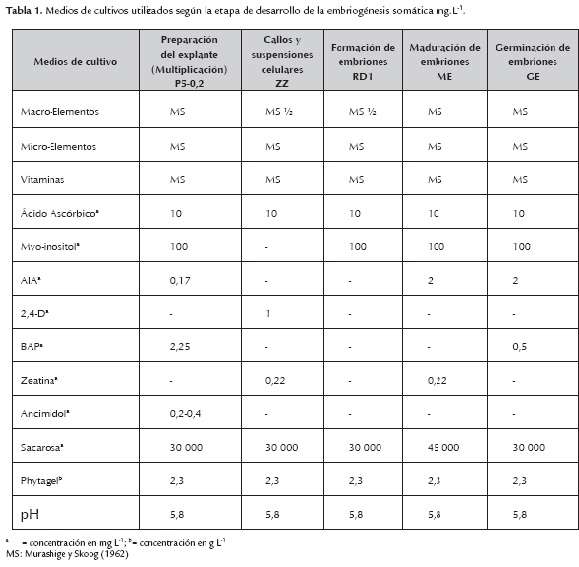
Se utilizó el cultivar 'FHIA – 25' procedente del Banco de Germoplasma del INIVIT, por su interés en el Programa de Mejoramiento Genético del Plátano en Cuba. Los explantes para establecer los cultivos asépticos in vitro, fueron ápices obtenidos de plantas en floración, previamente seleccionadas con buen estado fitosanitario. Se seleccionaron hijuelos tipo "espada", con una altura entre 25 y 30 cm, los cuales fueron llevados a condiciones semicontroladas en un umbráculo cubierto por una malla plástica (Zarán), que logra una reducción de la intensidad luminosa del 70% durante esta etapa. El riego se realizó por microaspersión mediante sistema Microjet con una frecuencia de seis riegos al día y una duración de dos minutos cada uno. Se garantizó una humedad relativa del 85–90%. Transcurridos 45 días, se realizó la desinfección de los explantes y su establecimiento in vitro en el medio de cultivo propuesto por López (1999). Los materiales fueron incubados durante 15 días en una cámara de cultivo con temperatura de 27±2,0°C e iluminación artificial, con régimen de 16 horas de luz a una densidad de flujo de fotones fotosintéticos (FFF) de 62-68 µmol m-2s-1 y ocho horas de oscuridad. Transcurrido este período, a partir de cada ápice meristemático, se obtuvieron grupos de brotes que se separaron para subcultivarlos en cuatro ocasiones con intervalos de 21 días, en el medio de cultivo de establecimiento P5-0,2, propuesto por López (2006) y condiciones similares de temperatura e iluminación, para disponer de la cantidad de material vegetal necesario para realizar el establecimiento de las suspensiones celulares embriogénicas (SCE).
Establecimiento de suspensiones celulares embriogénicas a partir de ápices de brotes axilares
Para el establecimiento de las SCE los ápices de brotes axilares fueron colocados en cinco matraces Erlenmeyer de 100 mL (con ocho explantes cada uno) que contenían 20 mL de medio de cultivo líquido ZZ propuesto por Dheda et al. (1991) y modificado por (Schoofs, 1997) (tabla 1). Cada Erlenmeyer utilizado constituyó una réplica, referido en adelante como suspensión celular 1, 2 y 3.
Los matraces Erlenmeyer se colocaron en un agitador orbital (zaranda), a 90 rpm y bajo el régimen de 16 horas de luz, de 62-68 µmol m2 s-1 de flujo de fotones fotosintéticos y 8 h de oscuridad.
Durante los dos primeros meses los cambios de medios de cultivo se realizaron cada 7 días de cultivo y consistieron en la renovación del 100% del medio de cultivo ZZ, al tercer mes estos cambios se realizaron cada tres días renovando el 50% del medio. Al cuarto mes fueron tomados los glóbulos meristemáticos formados y se subcultivaron cada 7 días renovando el 90% del medio de cultivo viejo.
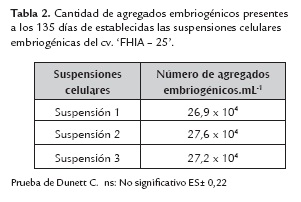
Transcurridos 135 días, se evaluó el número de agregados embriogénicos formados por mL de cultivo. Los conteos se efectuaron en cámara de Neubauer de 0,1 mm de profundidad. Para esto se tomaron cinco muestras de suspensiones celulares de 1,0 mL de volumen por cada Erlenmeyer. Los datos obtenidos se analizaron mediante la prueba de Dunett C. Se consideró significativo si p≤0,05.
Una vez establecidos, los cultivos celulares fueron tamizados a través de filtros de malla metálica, con un diámetro de poro de 500 µm. Estos filtrados constituyeron las suspensiones celulares utilizadas en una secuencia de cuatro experimentos realizados: 1) Efecto de la densidad celular en la multiplicación de las suspensiones celulares embriogénicas; 2) Formación de los embriones somáticos; 3) Influencia del tiempo de cultivo para la maduración de los embriones somáticos y su germinación y, 4) Conversión a plantas de los embriones somáticos. Estos experimentos se describen a continuación.
Efecto de la densidad celular en la multiplicación de las suspensiones celulares embriogénicas
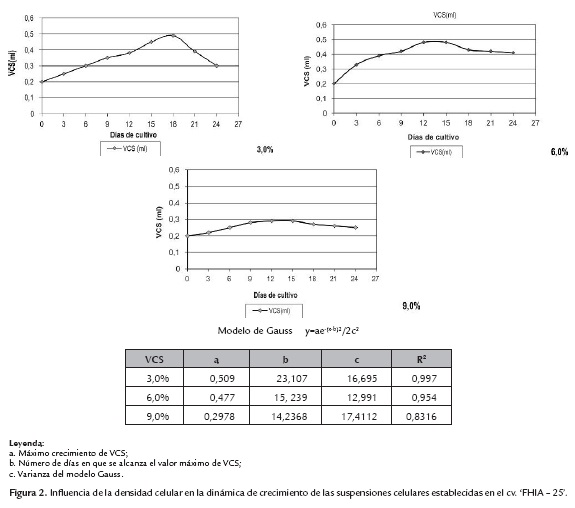
Una vez establecidas las suspensiones celulares, se evaluó el efecto de tres tratamientos que correspondieron a densidades de inóculo inicial (3,0; 6,0 y 9,0%) con el objetivo de evaluar la influencia de la densidad con relación a la dinámica de crecimiento de las suspensiones celulares y determinar el valor mínimo de inóculo que permitiera su correcta multiplicación. Se midió cada tres días el incremento o multiplicación celular de cada tratamiento, según la metodología de evaluación propuesta por Schoofs (1997) para medir el VCS (Volumen de célula sedimentada). Para ello se emplearon cinco matraces Erlenmeyer de 25 mL de capacidad por cada densidad evaluada (3,0; 6,0 y 9,0%). El medio y las condiciones de cultivo fueron similares a los descritos para el establecimiento de las suspensiones celulares (tabla 1), pero sin renovar el medio de cultivo durante los 24 días que duró el experimento. Los cultivos celulares fueron observados al microscopio óptico, para determinar la vitalidad celular mediante fluorescencia (Widholm, 1972).
Para el análisis del crecimiento de las SCE se utilizó el modelo de regresión no lineal de Gauss mediante el programa de ajuste de curvas, CURVE EXPERT 1,3.
Formación de los embriones somáticos
Con el objetivo de lograr la formación de los embriones somáticos, las SCE obtenidas se ajustaron al 12% de densidad celular según la metodología propuesta por López (2006) y se cultivaron en el medio de formación de embriones RD1 (Dhed'a et al., 1991).
Se emplearon cinco placas Petri por cada suspensión celular estudiada. A cada placa Petri se le colocaron sobre el medio de cultivo cuatro mallas de poliestireno con un tamaño de 1,0 cm2 y poros de 100 µm. Luego se añadieron 200 µL al 12% de VCS mediante una micropipeta con la punta cortada.
El número de embriones somáticos formados se evaluó a los 45 días de cultivo. Para esto se tomó y pesó 0,1 g de materia fresca (gMF) de embriones somáticos formados, los cuales se adicionaron a un vaso de precipitados, que contenía una mezcla de 2,3 g.L-1 de Phytagel y agua. Posteriormente se vertió la mezcla en una placa Petri, se dejó gelificar y se dividió en cuadrantes para facilitar su conteo, el cual se realizó bajo un microscopio estereoscópico.
Para la comparación de los tratamientos, se aplicó el análisis de varianza y la comparación de medias mediante la prueba de Tukey, con un nivel de significación de p≤0,05.
Influencia del tiempo de cultivo para la maduración de los embriones somáticos y su germinación
Con el objetivo de lograr la maduración de los embriones somáticos obtenidos en la etapa anterior, se realizó un experimento en el cual se evaluó el efecto de tres tiempos de cultivo (15; 30 y 45 días) sobre el medio de maduración de embriones (ME) propuesto por López (2006). Los embriones se colocaron a la densidad de inóculo inicial de 0,5 gMF en cinco placas de Petri por cada variante de tiempo de cultivo estudiado.
Para determinar el estado de maduración de los embriones somáticos, se evaluó su germinación a partir de una muestra de 50 embriones somáticos a los 15, 30 y 45 días de cultivo de cada uno de los tratamientos estudiados. Para ello, se colocaron los embriones somáticos durante 30 días en diferentes placas Petri, que contenían el medio de cultivo de germinación (GE) propuesto por Gómez et al. (2000).
Como control del experimento se utilizaron 50 embriones somáticos tomados del medio RD1, a los 45 días de cultivo y sin pasar por el medio de maduración. Las condiciones de cultivo fueron de 27±2,0 °C de temperatura e iluminación artificial, para un régimen de 16 h de luz a una densidad de flujo de fotones fotosintéticos (FFF) de 62-68 µmol m-2s-1 y 8 h de oscuridad.
Para la comparación de los tratamientos, se aplicó un análisis de varianza y una prueba de comparación de medias de Tukey, con un nivel de significación de p≤0,01.
Conversión a plantas de los embriones somáticos
Con el objetivo de lograr la conversión de los embriones somáticos en plantas, se evaluó la supervivencia y crecimiento posterior en condiciones ambientales ex vitro de las plantas originadas de embriones somáticos, en comparación con plántulas provenientes de la propagación por organogénesis (multiplicadas durante la etapa de formación de los embriones) utilizados como control en la propagación in vitro.
Esta fase se desarrolló según la metodología propuesta por Pérez et al. (1999), en condiciones semicontroladas de humedad relativa del 85-95%, en una casa de cultivo cubierta por una malla plástica (zarán), con una densidad de FFF de 600 µmol m-2s-1.
Se utilizaron bandejas de polieturano de 70 orificios, con un volumen de 100 cm3 de cachaza. Se transfirieron 350 plantas por cada procedencia (embriogénesis somática y organogénesis), con una altura de 4-5 cm y de dos a tres hojas, que fueron plantadas a una profundidad de 1,0 cm.
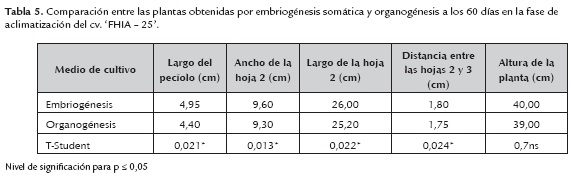
A los cinco días de plantadas se evaluó el porcentaje de supervivencia y transcurridos 60 días, antes de transferirlas a campo, se evaluó sobre 60 plantas de cada procedencia, las variables fenotípicas: altura de la planta (cm), de la hoja número dos: largo y ancho, el largo del pecíolo (cm), distancia entre las hojas dos y tres (cm), así como las variaciones fenotípicas observadas en toda la población según la metodología propuesta por Sandoval et al. (1997).
El análisis estadístico de los datos se realizó mediante una prueba de hipótesis para muestras independientes (T-Student), con un nivel de significación para p ≤0,05.
Resultados
Establecimiento de suspensiones celulares embriogénicas a partir de ápices de brotes axilares
Se logró el establecimiento de tres SCE de las cinco iniciadas a partir de los ápices de brotes axilares. Al evaluar el número de agregados embriogénicos en las SCE (tabla 2), no se encontraron diferencias estadísticas significativas.
Durante el primer mes se observó fenolización en la zona de corte de los explantes y posteriormente el engrosamiento de los mismos. Transcurridos dos meses de cultivo se observaron estructuras globulares amarillas en la superficie de los explantes, las cuales se separaron de estos y comenzaron a liberar los agregados embriogénicos, además de la presencia de células alargadas y vacuoladas.
Se verificaron cambios en la composición de las SCE, en las que fue posible apreciar células embriogénicas pequeñas y esféricas, con un contenido citoplasmático denso, gránulos de almidón y una alta razón núcleo/citoplasma. A medida que se realizaron los subcultivos posteriores, la cantidad de células aisladas y parenquimatosas disminuyeron a valores casi nulos. Estos agregados embriogénicos llegaron a ocupar entre 90 y 94% de la suspensión celular y su tamaño varió entre 80 y 300 µm transcurridos 135 días de cultivo (figura 1).
Los resultados alcanzados en este experimento permitieron el establecimiento de SCE a partir de los ápices de brotes axilares colocados directamente en el medio de cultivo líquido.
Efecto de la densidad celular en la multiplicación de las suspensiones celulares embriogénicas
Las curvas de crecimiento celular establecidas de las suspensiones celulares, se caracterizaron al inicio por una fase de reposo o latencia, debido a que en esta etapa las células se adaptan a las nuevas condiciones de cultivo, para posteriormente iniciar e incrementar la velocidad de la división celular durante la fase exponencial.
La densidad celular de 3,0% favoreció el incremento celular con relación a las curvas de crecimiento del 6,0 y 9,0 % (figura 2). En los datos obtenidos mediante el modelo de Gauss se observó que el mayor incremento de biomasa celular se produjo a los 23,1 días de cultivo (0,51 mL) al 3,0% de VCS.
Esta misma densidad celular (3%) mostró una fase de crecimiento exponencial, bien definida y continua, sin deterioro de la calidad celular (predominio de células meristemáticas y vitalidad celular de 90 – 95%).
Lo anterior demuestra que durante esta fase las células muestran intensa actividad metabólica y alcanzan su máxima tasa de división, lo cual indica que los subcultivos de las suspensiones celulares deben realizarse a la densidad celular del 3,0% de VCS y a los 15 días de cultivo, para que las mismas se mantengan en multiplicación continua sin pasar a la fase lineal.
En la densidad celular de 6,0% de VCS, según los datos obtenidos mediante el modelo de Gauss se observó que el mayor incremento de biomasa celular se produjo a los 15,2 días de cultivo (0,48 mL de VCS). A partir de esta fecha no se produjo incremento del volumen de células y comenzó a disminuir su calidad y vitalidad (figura 2).
Las células establecidas a una densidad del 9,0% durante 21 días de cultivo no llegaron a duplicar su volumen inicial y la calidad de la suspensión celular y su vitalidad disminuyeron bruscamente. Se comenzaron a observar células alargadas y con escasos gránulos de almidón.
El momento adecuado para realizar el subcultivo de las suspensiones celulares, no puede coincidir con la máxima expresión de la densidad celular del cultivo en suspensión, ni con el momento en que se agotan las principales fuentes de energía, sino con la última fase de crecimiento exponencial.
Basado en los resultados alcanzados en este experimento, se pudo concluir que las suspensiones celulares iniciadas al 3,0% de densidad celular tuvieron una mejor respuesta bajo las condiciones de manejo y cultivo previamente explicadas.
Formación de los embriones somáticos
Transcurridos 45 días de haber sido plaqueadas las suspensiones celulares embriogénicas en el medio de cultivo RD1 se realizó el conteo de los embriones formados. Las SCE 1 y 2 formaron un total de 1580 y 1610 embriones somáticos respectivamente por cada 200 µL plaqueados (tabla 3).
Embriones somáticos formados con letras distintas difieren estadísticamente para p≤0,05 según la prueba de Tukey.
Los resultados alcanzados durante esta etapa permitieron establecer como condición de cultivo para el cv. 'FHIA – 25', iniciar el proceso de histodiferenciación a partir de suspensiones celulares embriogénicas a la densidad celular de 12,0 %.
Influencia del tiempo de cultivo para la maduración de los embriones somáticos y su germinación
Al evaluar el tiempo de incubación en el medio ME, se observó que cuando los embriones somáticos se incubaron durante 30 días se favoreció su maduración, con un 48,30% de embriones germinados, con diferencias significativas del resto de los tratamientos estudiados (tabla 4).
Porcentajes con letras distintas difieren estadísticamente para p≤0,01 según la prueba de Tukey.
Los embriones somáticos maduros (figura 3) mostraron una invaginación de forma circular con el centro opaco y la presencia de una zona meristemática densa, correspondiente a un estado cordiforme, en su desarrollo posterior el embrión evolucionó asimétricamente hasta convertirse en un embrión cotiledonar.
Cuando los embriones somáticos no fueron cultivados previamente en el medio ME, sólo germinó el 15 % de los mismos. A partir de estos resultados se definió para la fase de maduración una densidad de inóculo inicial de 0,5 gMF de embriones somáticos y 30 días de incubación.
Conversión a plantas de los embriones somáticos
Al evaluar las características de las plantas provenientes de los embriones somáticos, en comparación con las plantas regeneradas por organogénesis, se observó en ambos casos un alto porcentaje de supervivencia en la fase de aclimatización. En el caso de las plantas procedentes de embriones somáticos fue de 98 % y en el control de organogénesis de 97,4%.
Transcurridos 60 días en esta fase y previo a su trasplante a condiciones de campo, las plantas obtenidas en ambos sistemas de regeneración no mostraron anormalidades fenotípicas. Con relación a las variables medidas excepto en la altura de la planta, hubo diferencias estadísticas significativas en las demás variables evaluadas a favor de las plantas regeneradas por embriogénesis somática (tabla 5).
Los resultados obtenidos en la investigación permitieron la elaboración de una metodología para el desarrollo de la embriogénesis somática a partir de ápices de brotes axilares en el cultivar de plátano 'FHIA – 25' (figura 4).
Discusión
Establecimiento de suspensiones celulares embriogénicas a partir de ápices de brotes de yemas axilares
El establecimiento de tres SCE de las cinco iniciadas a partir del explante de ápices de brotes axilares está en correspondencia con lo publicado por Schoofs et al. (1999), cuando señalaron que no todo complejo embriogénico dará una buena suspensión celular. Estos autores utilizaron las multiyemas como fuente de explante para el establecimiento de SCE y obtuvieron que la tasa exitosa fuera de uno de dos o uno de cinco, es decir, que la investigación desarrollada está en correspondencia con los resultados alcanzados por otros autores.
La formación de estructuras globulares amarillas y su posterior desarrollo también había sido señalada con anterioridad por otros autores como Dhed'a et al. (1991), quienes establecieron SCE a partir de "scalps", derivados de brotes adventicios (multiyemas), en el cultivar Bluggoe (ABB).
Las SCE establecidas se caracterizaron por la presencia de una alta proporción de agregados de células embriogénicas proliferantes, el cambio de color de amarillo brillante a pálido y la rápida sedimentación de células cuando la suspensión es retirada del vibrador orbital, lo cual indicó una alta densidad del contenido celular, como parámetros indicativos para identificar una SCE de buena calidad (Strosse et al., 2003)
Chong et al., (2005) establecieron suspensiones celulares directamente de los explantes de inflorescencias masculinas inmaduras, lo cual permitió obtener SCE homogéneas en 20 semanas con una respuesta superior al 70% de los explantes inoculados.
Efecto de la densidad celular en la multiplicación de las suspensiones celulares embriogénicas
Schoofs et al., (1999) establecieron en la etapa de multiplicación celular curvas de crecimiento logarítmico en SCE, derivadas del explante de multiyemas en el cv. 'Williams' (AAA). Estos autores obtuvieron que las densidades celulares de 3,0 y 5,0 % fueron superiores al 10% y a su vez estas suspensiones celulares revelaron bajo estas condiciones, una fase logarítmica casi ausente.
También Barranco (2001) a partir de suspensiones establecidas de embriones somáticos obtenidos del cultivo de flores masculinas en el cv. 'FHIA – 18' (AAAB), alcanzó la mejor multiplicación a la densidad celular de 3,0% de VCS con una curva de crecimiento exponencial.
Resultados similares fueron obtenidos por López (2006), con relación a la mejor respuesta de la densidad celular del 3% de VCS al estudiar la curva de crecimiento en suspensiones celulares del cv. 'Navolean' (grupo AAB), con un incremento de biomasa celular (0,474 mL) a los 23 días de cultivo.
Cuando se estudiaron las curvas de crecimiento al 6% y 9% de VCS se observó que independientemente de que disminuye en el tiempo la cantidad de biomasa celular, también disminuye la calidad de la suspensión celular, al ser necesario incrementar el número de subcultivos a realizar, corroborado por Georget et al. (2000), al referir que la SCE pierde calidad con el número de subcultivos, e incrementa la probabilidad de contaminación, disminuyendo la tasa de crecimiento y capacidad de regeneración, debido entre otros factores a la disminución de nutrientes y reguladores del crecimiento en el medio de cultivo, fundamentalmente el 2,4-D, así como a la proliferación de las células densas de rápido crecimiento ricas en almidón.
Formación de los embriones somáticos
Dhed'a et al., (1991) en el cv. 'Bluggoe' (ABB) obtuvieron formación de embriones somáticos en el medio de cultivo RD1 líquido, a partir de suspensiones celulares. Schoofs (1997), obtuvo de 102 a 104 embriones somáticos por mL de VCS en medio de cultivo RD1 semisólido, a partir de suspensiones celulares de plátanos.
Arnold et al., (2002), al respecto señalaron además, que es importante tener en cuenta que para facilitar la formación y la sincronización de los embriones somáticos es necesario tamizar los agregados celulares y lavar éstos antes de su inoculación, para eliminar residuos del medio de cultivo anterior.
Resultados similares a los obtenidos en la presente investigación fueron reportados por Barranco (2000) en el cultivar Gran Enano (AAA), con el ajuste al 15% de densidad celular de las SCE, logró el proceso de histodiferenciación en medio de cultivo líquido y formó 2561,5 ± 95,3 embriones somáticos.
Chong et al. (2005) al estudiar varias densidades celulares, obtuvieron diferentes cantidades de embriones somáticos, lo cual pudo estar influenciado por los diferentes potenciales embriogénicos de las líneas celulares de Gran Enanao (AAA), todo lo cual corrobora los resultados obtenidos en la investigación realizada.
Influencia del tiempo de cultivo para la maduración de los embriones somáticos y su germinación
Emb cotiled característico de especies monocotiledóneas según fue señalado por Natesh y Rau (1984).
Los embriones somáticos en etapa globular no están preparados para germinar y por tanto necesitan ser colocados en un medio específico para favorecer su maduración (Suárez-Castellá et al., 2012), siendo necesario la etapa de maduración del embrión donde ocurre la expansión de la célula y la acumulación de sustancias de reserva (Corredoira et al., 2003).
Daniels et al., (2002) en el cv. 'FHIA – 21' (Musa AAAB) observaron que la densidad celular y el tiempo de permanencia en el medio de cultivo de maduración influyen en el número de embriones somáticos germinados, lo cual pudo ser corroborado en la presente investigación.
Barranco (2001) en el cv. 'FHIA – 18' (AAAB) al establecer embriones somáticos a densidades de entre 0,4 y 0,8 gMF en Erlenmeyer de 250 ml que contenía 25 mL de medio de cultivo, incubados en condiciones de oscuridad y temperatura de 27 ± 0.2°C en un agitador orbital. Estos tuvieron una rápida maduración, la cual ocurrió entre 15 y 22 días de cultivo. López (2006) al estudiar la interacción de la densidad de inóculo inicial de embriones somáticos y el tiempo de incubación en el medio de maduración, en el cv. 'Navolean', observó que la mejor combinación fue la densidad de 0,5 gMF de embriones durante 30 días de cultivo, logrando un porcentaje de germinación de 46,8%. Además este mismo autor demostró que cuando los embriones somáticos no fueron cultivados previamente en el medio de cultivo de maduración, sólo germinó el 18,6% de los mismos.
Barranco (2001) logró 40,6% de germinación en el cultivar híbrido 'FHIA – 18' en medio de cultivo semisólido; y Cabrera et al., (2002) en el cv. 'Navolean' (ABB) un 49,3% de germinación en el medio propuesto por Gómez et al., 2000.
Los resultados obtenidos por dichos autores corroboran los alcanzados en la presente investigación, evidenciando la importancia de la etapa de maduración de los embriones somáticos para incrementar su porcentaje de germinación.
Conversión a plantas de los embriones somáticos
La eficiencia del proceso embriogénico de cualquier especie vegetal, está dada por la germinación y conversión de los embriones somáticos en plantas, etapas que constituyen requisitos indispensables (López, 2006).
De una total de 350 plantas evaluadas procedentes de los embriones somáticos, se logró una supervivencia del 98%, en comparación con las plantas regeneradas por organogénesis, que alcanzaron 97,4%. Resultados similares fueron obtenidos por López (2006) al estudiar la conversión a plantas de embriones somáticos del cultivar Navolean sin la presencia de variación somaclonal en la fase de aclimatización, lo cual corroboró lo planteado por Sandoval et al., (1997) al afirmar que en esta fase solamente se puede detectar alrededor de un 60% de variantes somaclonales, cual no implica que no se hayan producido, sino que no fue posible su observación visual, por tanto se hace necesario continuar las evaluaciones de estas plantas en campo hasta completar su ciclo de desarrollo. Sin embargo, López (2006) al evaluar la conversión a plantas de los embriones somáticos del cultivar Navolen, observó que un 0,5% mostraban variación somaclonal con características de hojas variegadas, descrita por Reuveni e Israeli (1990) como "axilares mosaic-like".
Côte et al., (2000), durante la fase de aclimatización de plantas regeneradas de embriones somáticos en el cv. 'Gran Enano' (AAA) observaron que en el 0,5 -1,3% de la población tuvieron hojas variegadas, y señalaron además que cuando estas plantas fueron llevadas a campo desapareció esta anormalidad morfológica, quizás debido a cambios epigenéticos ocurridos.
Conclusiones
Se logró la regeneración de plantas del cv. 'FHIA – 25' vía embriogénesis somática, a partir de los embriones somáticos formados al 12% de densidad celular y posteriormente madurados durante 30 días.
La metodología desarrollada propició la conversión de los embriones somáticos a plantas con una supervivencia del 98% de éstas en la fase de aclimatización.
Referencias
Arnold, S., Sabala, I., Bozhkov, P., Dyachok, J. y Filonova, L. (2002). Developmental pathways of somatic embryogenesis. Plant Cell, Tissue and Organ Culture,69, 233-249.
Barranco, L.A. (2000). Desarrollo de la embriogénesis somática en medios líquidos (Musa AAA cv. 'Gran Enano'). (Doctoral dissertation, Tesis de maestría, Instituto de Biotecnología de las plantas. Santa Clara, Cuba). p. 57.
Barranco, L.A. (2001). Embriogénesis somática en banano (Musa AAAB, cv. 'FHIA-18') empleando medios de cultivo líquidos. Santa Clara, Cuba, Instituto de Biotecnología de las Plantas, p.107.
Cabrera, M., López, J., Gómez, R., Montano, N., Reyes, M., Reynaldo, D., Ventura, J., Santos, A., García, M., Basail, M. y Espinosa, E. (2002). Multiplicación, histodiferenciación y regeneración de Suspensiones Celulares Embriogénicas en plátano 'Navolean' (AAB). Biotecnología Vegetal, 2, 115-117.
Corredoira, E., Ballester, A., y Vieitez, A.M. (2003). Proliferation, maturation and germination of Castanea sativa Mill. somatic embryos originated from leaf explants. Annals of Botany,92(1), 129-136.
Côte, F., Folliot, M., Domergue, R. y Dubois, C. (2000). Field performance of embryogenic cell suspension-derived banana plants (Musa AAA, cv. Grand Naine). Euphytica,112, 245-251.
Chong, B., Gómez, R., Reyes, M., Bermúdez Carballoso, I., Gallardo, J., Freire, M., Posada, L., Herrera, I. y Swennen, R. (2005). Nueva metodología para el establecimiento de suspensiones celulares de 'Grande naine' (AAA). InfoMusa,14(1),13-17.
Daniels, D., Kosky, R.G. y Vega, M.R. (2002). Plant regeneration system via somatic embryogenesis in the hybrid cultivar FHIA-21 (Musa sp. AAAB group). In Vitro Cellular & Developmental Biology-Plant, 38(4), 330-333.
Dhed'a, D., Dumortier, F., Panis, B., Vuylsteke, D. y De Langhe, E. (1991). Plant regeneration in cell suspension cultures of the cooking banana cv. "Bluggoe" (Musa spp. ABB group). Fruits,46, 125-135.
Escalant, J.V; y Jain, S.M. (2004). Banana improvement with cellular and molecular biology, and induced mutations: Future and perspectives. En: Banana Improvement: Cellular, Molecular Biology and Induced Mutations. S.M. Jain y R. Swennen (eds), USA: Science Publishers, Inc., Enfield, NH, pp. 359-367.
FAO. (2015). Organización de las Naciones Unidas para la Alimentación y la Agricultura Dirección de Estadística. http://faostat3.fao.org/download/Q/QC/E. Citado el 22 de julio de 2015.
Georget, F., Côte, F., Domergue, R. y Ferrière, N. (2000). Morphohistological study of the different constituents of a banana (Musa AAA, cv. 'Grande naine') embryogenic cell suspension. Plant Cell Reports, 19(8), 748-754.
Gómez, R., Gilliard, T., Barranco, L.A. y Reyes, M. (2000). Embriogénesis somática en medios líquidos. Maduración y aumento de la germinación en el cultivar híbrido 'FHIA18' (AAAB). Infomusa,9(1), 12-16.
Ibaraki y Kurata, K. (2001). Automation of somatic embryo production. Plant Cell, Tissue and Organ Culture, 65, 179-199.
Kamle, M., Bajpai, A., Chandra, R., Kalim, S. y Kumar, R. (2011). Somatic embryogenesis for crop improvement. GERF Bulletin of Biosciences,2(1), 54-59.
López, J. (1999). Genetic improvement of Musa spp. by in vitro mutational plant breeding. Infomusa. 8: 2 - PROMUSA XV.
López, J. (2006). Nueva metodología para el desarrollo de la embriogénesis somática en el cultivar de plátano vianda 'Navolean' (Musa spp., grupo AAB). Ciego de Ávila, Cuba: Centro de Bioplantas. Universidad de Ciego de Ávila, p. 100.
Merkle, S., Parrott, W. y Flinn, B. (1995). Morphogenic aspects of somatic embryogenesis. En: T.A. Thorpe (ed.), In vitro Embryogenesis in plants. Kluwer Academic Publishers. Dordrecht, Netherlands. pp. 155-203.
Natesh, S., Rau, M.A. (1984). The embryo. En: Embryology of Angiosperms. B.M. Johri (ed.), Springer-Verlag, Berlin, Heidelberg, New York, pp. 377-344.
Perea, M. (2001). La biotecnología como soporte en el mejoramiento de las Musáceas. En: Un enfoque hacia el mejoramiento de plantas. Biotecnología Agrícola, M. Perea (ed.), Bogotá, Colombia, pp. 139-149.
Pérez, J.N., Agramante, D., Jiménez, F. y Ramírez, D. (1999). Desarrollo y perfeccionamiento de la propagación masiva en las fases III y IV, enraizamiento y adaptación en caña de azúcar, papa, plátanos y bananos y adaptación de semillas artificiales en caña de azúcar. Santa Clara, Cuba: IBP, p. 82.
Reuveni, O. e Israeli, Y. (1990). Measures to reduce somaclonal variation in vitro propagated bananas. Acta Horticulturae,257, 307-313.
Rodríguez, S. (2000). Evaluación y recomendación de clones de boniato, yuca plátanos y bananos resistentes o tolerantes a los factores adversos de la producción (FAP) y su manejo integrado. Villa Clara, Cuba: INIVIT, p. 96.
Sánchez, R., Pino, J.A., Vallin, C., Pérez, M.E., Iznaga, Y. y Malpartida, F. (2002). Effects of the natural fungicide F20 on black Sigatoka disease (Mycosphaerella fijiensis Morelet) on plantain (AAB) and banana (AAA). Infomusa,11(1),14-16.
Sandoval, J.A., Pérez, L. y Côte, F. (1997). Estudio morfológico y de la estabilidad genética de plantas variantes de banano (Musa AAA cv. 'Gran Enano'). CORBANA,22(48), 41-60.
Schoofs, H. (1997). The origin of embryogenic cells in Musa. Leuven, Belgium: UKL. p. 257.
Schoofs, H., Panis, B., Strosse, H., Mayo, A., López, J., Roux, N., Dolezel, J. y Swennen, R. (1999). Cuellos de botella en la generación y mantenimiento de las suspensiones celulares morfogénicas de banano y la regeneración de las plantas vía embriogénesis somática a partir de ellas. Infomusa,9(2), 3-6.
Steward, F.C., Mapes, M.O. y Smith, J. (1958). Growth and organized development of cultured cells. American Journal of Botany,45, 693-704.
Stover, R. y Simmonds, N. (1987). Bananas. Harlow 3rd ed. Longman Scientific & Technical. Essex, England.
Strosse, H., Domergue, R., Panis, B., Escalanty, J.V., Côte, F. (2003). Banana and plantain embryogenic cell suspensions. Technical Guidelines 8. INIBAP, Montpellier, France. p 36.
Suárez-Castellá, M., Kosky, R. G., Chong-Pérez, B., Reyes, M., García-Águila, L., Sarría, Z., Orellana, P., Rodríguez, A., Triana, R., Pérez, Z., González, M., León, M., Perez, B. (2012). Estrategia de innovación tecnológica para el empleo de embriogénesis somática en medios de cultivo semisólido en Musa spp. y su impacto económico. Biotecnología Vegetal,12(1), 41 - 48.
Widholm, J. (1972). The use of fluorescein diacetate and phenosafranine for determining viability of culture plant cells. Stain Technology, 47, 189-194.
Referencias
Arnold, S., Sabala, I., Bozhkov, P., Dyachok, J. y Filonova, L. (2002). Developmental pathways of somatic embryogenesis. Plant Cell, Tissue and Organ Culture, 69, 233–249.
Barranco, L.A. (2000). Desarrollo de la embriogénesis somática en medios líquidos (Musa AAA cv. ‘Gran Enano’). (Doctoral dissertation, Tesis de maestría, Instituto de Biotecnología de las plantas. Santa Clara, Cuba). p. 57.
Barranco, L.A. (2001). Embriogénesis somática en banano (Musa AAAB, cv. ‘FHIA-18’) empleando medios de cultivo líquidos. Santa Clara, Cuba, Instituto de Biotecnología de las Plantas, p.107.
Cabrera, M., López, J., Gómez, R., Montano, N., Reyes, M., Reynaldo, D., Ventura, J., Santos, A., García, M., Basail, M. y Espinosa, E. (2002). Multiplicación, histodiferenciación y regeneración de Suspensiones Celulares Embriogénicas en plátano ‘Navolean’ (AAB). Biotecnología Vegetal, 2, 115-117.
Corredoira, E., Ballester, A., y Vieitez, A.M. (2003). Proliferation, maturation and germination of Castanea sativa Mill. somatic embryos originated from leaf explants. Annals of Botany, 92(1), 129-136.
Côte, F., Folliot, M., Domergue, R.y Dubois, C. (2000). Field performance of embryogenic cell suspension-derived banana plants (Musa AAA, cv. Grand Naine). Euphytica, 112, 245-251.
Chong, B., Gómez, R., Reyes, M., Bermúdez Carballoso, I., Gallardo, J., Freire, M., Posada, L., Herrera, I. y Swennen, R. (2005). Nueva metodología para el establecimiento de suspensiones celulares de ‘Grande naine’ (AAA). InfoMusa, 14(1),13-17.
Daniels, D., Kosky, R.G. y Vega, M.R. (2002). Plant regeneration system via somatic embryogenesis in the hybrid cultivar FHIA-21 (Musa sp. AAAB group). In Vitro Cellular & Developmental Biology-Plant, 38(4), 330-333.
Dhed’a, D., Dumortier, F., Panis, B., Vuylsteke, D. y De Langhe, E. (1991). Plant regeneration in cell suspension cultures of the cooking banana cv. “Bluggoe” (Musa spp. ABB group). Fruits, 46, 125-135.
Escalant, J.V; y Jain, S.M. (2004). Banana improvement with cellular and molecular biology, and induced mutations: Future and perspectives. En: Banana Improvement: Cellular, Molecular Biology and Induced Mutations. S.M. Jain y R. Swennen (eds), USA: Science Publishers, Inc., Enfield, NH, pp. 359-367.
FAO. (2015). Organización de las Naciones Unidas para la Alimentación y la Agricultura Dirección de Estadística. http://faostat3.fao.org/download/Q/QC/E. Citado el 22 de julio de 2015.
Georget, F., Côte, F., Domergue, R. y Ferrière, N. (2000). Morphohistological study of the different constituents of a banana (Musa AAA, cv. ‘Grande naine’) embryogenic cell suspension. Plant Cell Reports, 19(8), 748-754.
Gómez, R., Gilliard, T., Barranco, L.A. y Reyes, M. (2000). Embriogénesis somática en medios líquidos. Maduración y aumento de la germinación en el cultivar híbrido ‘FHIA18’ (AAAB). Infomusa, 9(1), 12-16.
Ibaraki y Kurata, K. (2001). Automation of somatic embryo production. Plant Cell, Tissue and Organ Culture, 65, 179–199.
Kamle, M., Bajpai, A., Chandra, R., Kalim, S. y Kumar, R. (2011). Somatic embryogenesis for crop improvement. GERF Bulletin of Biosciences, 2(1), 54-59.
López, J. (1999). Genetic improvement of Musa spp. by in vitro mutational plant breeding. Infomusa. 8: 2 - PROMUSA XV.
López, J. (2006). Nueva metodología para el desarrollo de la embriogénesis somática en el cultivar de plátano vianda ‘Navolean’ (Musa spp., grupo AAB). Ciego de Ávila, Cuba: Centro de Bioplantas. Universidad de Ciego de Ávila, p. 100
Merkle, S., Parrott, W. y Flinn, B. (1995). Morphogenic aspects of somatic embryogenesis. En: T.A. Thorpe (ed.), In vitro Embryogenesis in plants. Kluwer Academic Publishers. Dordrecht, Netherlands. pp. 155-203.
Natesh, S., Rau, M.A. (1984). The embryo. En: Embryology of Angiosperms. B.M. Johri (ed.), Springer-Verlag, Berlin, Heidelberg, New York, pp. 377-344.
Perea, M. (2001). La biotecnología como soporte en el mejoramiento de las Musáceas. En: Un enfoque hacia el mejoramiento de plantas. Biotecnología Agrícola, M. Perea (ed.), Bogotá, Colombia, pp. 139-149.
Pérez, J.N., Agramante, D., Jiménez, F. y Ramírez, D. (1999). Desarrollo y perfeccionamiento de la propagación masiva en las fases III y IV, enraizamiento y adaptación en caña de azúcar, papa, plátanos y bananos y adaptación de semillas artificiales en caña de azúcar. Santa Clara, Cuba: IBP, 82p.
Reuveni, O. e Israeli, Y. (1990). Measures to reduce somaclonal variation in vitro propagated bananas. Acta Horticulturae, 257, 307-313.
Rodríguez, S. (2000). Evaluación y recomendación de clones de boniato, yuca plátanos y bananos resistentes o tolerantes a los factores adversos de la producción (FAP) y su manejo integrado. Villa Clara, Cuba: INIVIT, p. 96
Sánchez, R., Pino, J.A., Vallin, C., Pérez, M.E., Iznaga, Y. y Malpartida, F. (2002). Effects of the natural fungicide F20 on black Sigatoka disease (Mycosphaerella fijiensis Morelet) on plantain (AAB) and banana (AAA). Infomusa, 11(1),14-16.
Sandoval, J.A., Pérez, L. y Côte, F. (1997). Estudio morfológico y de la estabilidad genética de plantas variantes de banano (Musa AAA cv. ‘Gran Enano’). CORBANA, 22(48), 41-60.
Schoofs, H. (1997). The origin of embryogenic cells in Musa. Leuven, Belgium: UKL. p. 257.
Schoofs, H., Panis, B., Strosse, H., Mayo, A., López, J., Roux, N., Dolezel, J. y Swennen, R. (1999). Cuellos de botella en la generación y mantenimiento de las suspensiones celulares morfogénicas de banano y la regeneración de las plantas vía embriogénesis somática a partir de ellas. Infomusa, 9(2), 3-6.
Steward, F.C., Mapes, M.O. y Smith, J. (1958). Growth and organized development of cultured cells. American Journal of Botany, 45, 693-704.
Stover, R. y Simmonds, N. (1987). Bananas. Harlow 3rd ed. Longman Scientific & Technical. Essex, England
Strosse, H., Domergue, R., Panis, B., Escalanty, J.V., Côte, F. (2003). Banana and plantain embryogenic cell suspensions. Technical Guidelines 8. INIBAP, Montpellier, France. p 36.
Suárez-Castellá, M., Kosky, R. G., Chong-Pérez, B., Reyes, M., García-Águila, L., Sarría, Z., Orellana, P., Rodríguez, A., Triana, R., Pérez, Z., González, M., León, M., Perez, B. (2012). Estrategia de innovación tecnológica para el empleo de embriogénesis somática en medios de cultivo semisólido en Musa spp. y su impacto económico. Biotecnología Vegetal, 12(1), 41 – 48.
Widholm, J. (1972). The use of fluorescein diacetate and phenosafranine for determining viability of culture plant cells. Stain Technology, 47, 189-194.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Licencia
Derechos de autor 2015 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).