Actividad antifúngica del quitosano y aceites esenciales sobre Rhizopus stolonifer (Ehrenb.:Fr.) Vuill., agente causal de la pudrición blanda del tomate
Palabras clave:
quitosano, aceites esenciales, Rhizopus stolonifer, podredumbre blanda, Chitosan, essential oils, soft rot (es)Título en ingles: Antifungal activity of chitosan and essential oils on Rhizopus stolonifer (Ehrenb.:Fr.) Vuill causal agent of soft rot of tomato
Resumen
Rhizopus stolonifer es el agente causal de la pudrición blanda, enfermedad poscosecha que ocasiona pérdidas económicas importantes. Se han empleado fungicidas sintéticos como el dicloran para controlar a este microorganismo, sin embargo, se ha demostrado que los fungicidas representan un riesgo para el ambiente y la salud humana. Actualmente se buscan alternativas naturales para el control de las pudriciones poscosecha. Se evaluó in vitro e in situ el efecto antifúngico del quitosano y de los aceites esenciales de canela (Cinnamomum zeylanicum), clavo (Syzygium aromaticum) y tomillo (Thymus vulgaris) y dicloran sobre Rhizopus stolonifer. Los tratamientos más efectivos para inhibir in vitro a Rhizopus stolonifer fueron obtenidos con quitosano a 10 mg mL-1, con los tres aceites esenciales probados a la concentración de 0,3 mg mL-1, las mezclas de quitosano a 10 mg mL-1 con los aceites a 0,3 mg mL-1 y el dicloran a 1 mg mL-1. Los experimentos in situ mostraron que el tratamiento individual con quitosano fue el mejor para reducir el porcentaje de infección de los frutos de tomate (Lycopersicon esculentum) inoculados con Rhizopus stolonifer y que la mezcla de quitosano con aceites esenciales no mejora la actividad antifúngica. El quitosano y el dicloran fueron los mejores tratamientos para reducir la pérdida de peso de los frutos. Los tratamientos individuales con quitosano representan una alternativa natural para controlar la pudrición blanda en frutos de tomate.
Palabras clave: quitosano; aceites esenciales; Rhizopus stolonifer; podredumbre blanda.
Abstract
Rhizopus stolonifer is the causal agent of soft rot, postharvest disease that causes important economic losses. Synthetic fungicides such as dichloran have been used to control this microorganism; however, it has been shown that fungicides represent a risk for the environment and human health. Actually, natural alternatives are looked for the control of postharvest rotting. In vitro and in situ experiments the antifungal effect of chitosan, essential oils of cinnamon (Cinnamomum zeylanicum), clove (Syzygium aromaticum), and thyme (Thymus vulgaris) and dichloran on Rhizopus stolonifer were evaluated. The most effective treatments for in vitro inhibition of Rhizopus stolonifer were obtained by quitosano to 10 mg mL-1, with the three essential oils proved to the concentration of 0.3 mg mL-1, the mixtures chitosan to 10 mg mL-1 with the oils at 0.3 mg mL-1 and dichloran at 1 mg mL-1. In situ experiments showed that the individual treatment with chitosan was the best to reduce the infection percentage of the tomato (Lycopersicon esculentum) fruits inoculated with Rhizopus stolonifer and chitosan mixture with essential oils did not improve its antifungal activity. Chitosan and dichloran were the best treatments to reduce the weight loss of the fruits. Individual treatments with chitosan represent a natural alternative for the control of soft rot on tomato fruits.
Key words: Chitosan; essential oils; Rhizopus stolonifer; soft rot
ARTÍCULO DE INVESTIGACIÓN
Actividad antifúngica del quitosano y aceites esenciales sobre Rhizopus stolonifer (Ehrenb.:Fr.) Vuill., agente causal de la pudrición blanda del tomate
Antifungal activity of chitosan and essential oils on Rhizopus stolonifer (Ehrenb.:Fr.) Vuill causal agent of soft rot of tomato
Título corto: Actividad antifúngica sobre Rhizopus stolonifer
Alejandra María Alvarado Hernández1 , Laura Leticia Barrera Necha2 , Ana Niurka Hernández Lauzardo2 , Miguel Gerardo Velázquez del Valle2.
1Maestra en Ciencias.
2 Doctor en Ciencias y Profesor- Investigador. Instituto Politécnico Nacional, Centro de Desarrollo de Productos Bióticos, Carretera Yautepec-Jojutla, Km 6, calle CEPROBI No. 8, Col. San Isidro, Yautepec, Morelos, México CP 62731.
Recibido: agosto 19 de 2011 Aprobado: noviembre 30 de 2011
Resumen
Rhizopus stolonifer es el agente causal de la pudrición blanda, enfermedad poscosecha que ocasiona pérdidas económicas importantes. Se han empleado fungicidas sintéticos como el dicloran para controlar a este microorganismo, sin embargo, se ha demostrado que los fungicidas representan un riesgo para el ambiente y la salud humana. Actualmente se buscan alternativas naturales para el control de las pudriciones poscosecha. Se evaluó in vitro e in situ el efecto antifúngico del quitosano y de los aceites esenciales de canela (Cinnamomum zeylanicum), clavo (Syzygium aromaticum) y tomillo (Thymus vulgaris) y dicloran sobre Rhizopus stolonifer. Los tratamientos más efectivos para inhibir in vitro a Rhizopus stolonifer fueron obtenidos con quitosano a 10 mg mL-1, con los tres aceites esenciales probados a la concentración de 0,3 mg mL-1, las mezclas de quitosano a 10 mg mL-1 con los aceites a 0,3 mg mL-1 y el dicloran a 1 mg mL-1. Los experimentos in situ mostraron que el tratamiento individual con quitosano fue el mejor para reducir el porcentaje de infección de los frutos de tomate (Lycopersicon esculentum) inoculados con Rhizopus stolonifer y que la mezcla de quitosano con aceites esenciales no mejora la actividad antifúngica. El quitosano y el dicloran fueron los mejores tratamientos para reducir la pérdida de peso de los frutos. Los tratamientos individuales con quitosano representan una alternativa natural para controlar la pudrición blanda en frutos de tomate.
Palabras clave: quitosano, aceites esenciales, Rhizopus stolonifer, podredumbre blanda.
Abstract
Rhizopus stolonifer is the causal agent of soft rot, postharvest disease that causes important economic losses. Synthetic fungicides such as dichloran have been used to control this microorganism; however, it has been shown that fungicides represent a risk for the environment and human health. Actually, natural alternatives are looked for the control of postharvest rotting. In vitro and in situ experiments the antifungal effect of chitosan, essential oils of cinnamon (Cinnamomum zeylanicum), clove (Syzygium aromaticum), and thyme (Thymus vulgaris) and dichloran on Rhizopus stolonifer were evaluated. The most effective treatments for in vitro inhibition of Rhizopus stolonifer were obtained by quitosano to 10 mg mL-1, with the three essential oils proved to the concentration of 0.3 mg mL-1, the mixtures chitosan to 10 mg mL-1 with the oils at 0.3 mg mL-1 and dichloran at 1 mg mL-1. In situ experiments showed that the individual treatment with chitosan was the best to reduce the infection percentage of the tomato (Lycopersicon esculentum) fruits inoculated with Rhizopus stolonifer and chitosan mixture with essential oils did not improve its antifungal activity. Chitosan and dichloran were the best treatments to reduce the weight loss of the fruits. Individual treatments with chitosan represent a natural alternative for the control of soft rot on tomato fruits.
Key words: Chitosan, essential oils, Rhizopus stolonifer, soft rot.
Introducción
Rhizopus stolonifer (Ehrenb.:Fr.) Vuill causa la pudrición blanda en frutas y hortalizas, lo que ocasiona pérdidas económicas importantes durante la fase de poscosecha, debido a que este hongo tiene un crecimiento rápido y es de fácil transmisión por heridas producidas durante la manipulación de los frutos (Northover y Zhou, 2002; Velázquez-del Valle et al., 2008). La producción y exportación de tomate (Lycopersicon esculentum Mill.) es muy importante en México, al igual que en otros países de América Latina como Brasil y Chile. No obstante, se han reportado pérdidas significativas ocasionadas por Rhizopus stolonifer (Hahn, 2006). Para controlar las pudriciones se han utilizado fungicidas químicos sintéticos, con los riesgos que implican su uso, aunque en algunos casos se ha buscado reducir los daños que ocasionan (Kanetis et al., 2007). En particular, se ha reportado que el fungicida sintético dicloran es muy activo en contra de Rhizopus stolonifer (Adaskaveg et al., 2002), sin embargo, este fungicida puede tener efectos carcinogénicos en el ser humano. Por ello es necesario buscar alternativas naturales que controlen las pudriciones y que no afecten al ambiente y a la salud humana, entre las alternativas se destaca el uso del quitosano y de aceites esenciales (Tripathi y Dubey, 2004).
El quitosano es un derivado desacetilado de la quitina, polímero constituido fundamentalmente por unidades de β- (1, 4)-2 acetamido-2-desoxi-D-glucosa y β- (1, 4)-amino-2-desoxi-D-glucosa, que tiene propiedades policatiónicas y potencial para controlar pudriciones poscosecha (Bautista-Baños et al., 2006). Este polímero se ha empleado como película para cubrir y conservar algunos frutos (fresas, tomate, longan, etc.), y se ha conseguido controlar pudriciones y mejorar la calidad de los mismos (Jiang y Li, 2001; Devlieghere et al., 2004; Hernández-Muñoz et al., 2008).
Los aceites esenciales son líquidos oleosos, aromáticos y volátiles constituidos por una mezcla compleja de compuestos, principalmente terpenos y alcoholes fenólicos que han sido reportados como inhibidores de hongos poscosecha (Botrytis cinerea y Monilinia fructicola) en condiciones in vitro (Tripathi y Dubey, 2004). Recientemente se informó que la actividad antimicrobiana de las películas de quitosano se mejora cuando se les incorpora aceites esenciales de clavo y tomillo ((Hosseini et al., 2008) aunque no se ha reportado la eficacia in situ de estos aceites ni el potencial que pudieran tener las mezclas de los aceites con quitosano para controlar mas eficientemente la pudrición blanda en frutos. El objetivo de este trabajo fue determinar in vitro e in situ la actividad antifúngica del quitosano, de los aceites esenciales de clavo, canela y tomillo aplicados de manera individual y mezclados en comparación con dicloran sobre Rhizopus stolonifer.
Materiales y métodos
Material biológico. Se empleó la cepa R3 de Rhizopus stolonifer (Ehrenb.:Fr.) Vuill aislada mediante cámara húmeda de frutos de tomate (Licopersicon esculentum Mill.) “Saladette” provenientes de Yautepec, en el estado de Morelos, en México (Hernández-Lauzardo et al., 2006). La cepa R3 de Rhizopus stolonifer pertenece al Laboratorio de fitopatología del Centro de desarrollo de productos bióticos del Instituto Politécnico Nacional y se mantiene en refrigeración con resiembras periódicas.
En los ensayos in situ se utilizaron frutos de tomate “Saladette” de tamaño uniforme, estado rojo maduro y sin lesiones cosechados en Tlayacapan, en el estado de Morelos, en México.
Soluciones de quitosano, aceites esenciales y dicloran. Se preparó una solución concentrada de quitosano (Sigma-Aldrich, St Louis, MO, USA) de bajo peso molecular (20 mg mL-1). Se pesaron 2 g de quitosano y se disolvieron en 2 ml de ácido acético glacial y 50 ml con agua destilada, se agitó durante 24 h y se ajustó el pH a 5,6 con NaOH 0.1 N (El Ghaouth et al., 1991), la solución se aforó a 100 ml con agua destilada y se esterilizó por autoclave a 121 °C durante 15 min. Se tomaron las alícuotas correspondientes para adicionarse a los recipientes que contenían los medios de cultivo estériles de Agar Papa Dextrosa (PDA, Bioxon) y Caldo de Papa Dextrosa (PDB, Bioxon) y obtener las concentraciones de 2 y 10 mg mL-1.
Se emplearon los aceites esenciales comerciales de clavo (Syzygium aromaticum L.), canela (Cinnamomum zeylanicum Brine) y tomillo (Thymus vulgaris L.) (Compañía de Aceites y Esencias S. A. de C. V., México D. F., México). Los aceites se pesaron, se diluyeron y dispersaron en agua destilada estéril y contenían tween 80 (0,06 mg mL-1), se agregaron a los recipientes que contenían el medio de cultivo las cantidades necesarias para tener las concentraciones finales de 0,1 y 0,3 mg mL-1 (Barrera-Necha, et al., 2009).
Se utilizó el fungicida agrícola comercial dicloran, 2,6-dicloro-4-nitroanilina (Compañía Gowan de México), el cual se diluyó en agua destilada estéril para preparar una solución a concentración de 10 mg mL-1 y se adicionó a los recipientes que contenían los medios de cultivo para obtener una concentración final de 1 mg mL-1.
Evaluaciones in vitro. Los tratamientos individuales consistieron en: cajas de Petri con PDA (testigo), cajas de Petri con PDA y quitosano en concentraciones de 2 y 10 mg mL-1, cajas con cada uno de los tres aceites esenciales en concentraciones de 0.1 y 0.3 mg mL-1 y dicloran a 1 mg mL-1, tratamiento usado como control positivo. Los tratamientos combinados fueron: cajas con PDA con quitosano a 2 mg mL-1 y cada uno de los tres aceites a 0,1 y 0,3 mg mL-1, cajas con el polímero a 10 mg mL-1 y los tres aceites esenciales a 0,1 y 0,3 mg mL-1. Fragmentos de 5 mm de un cultivo de Rhizopus stolonifer en condiciones de crecimiento de 25 ± 2 °C durante 72 h en PDA, fueron utilizados como inóculo. Los ensayos se incubaron a 25 ± 2 °C durante 48 h. Se realizaron 6 repeticiones por tratamiento y el experimento se repitió tres veces.
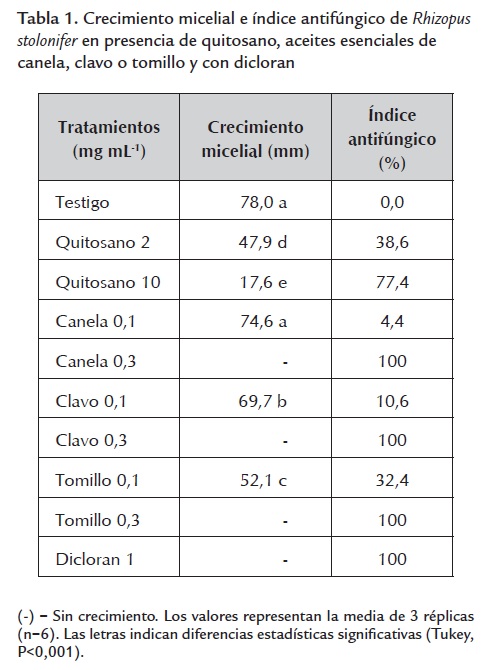
Crecimiento micelial. Cuando el tratamiento testigo cubrió totalmente la caja de Petri (48 h), se midió el diámetro de las colonias con un Vernier digital (Cienceware). Con los datos obtenidos se calculó el índice antifúngico para cada tratamiento (Guo et al., 2006).
IA=1-(Da/Db) x 100
Da: diámetro de crecimiento de los tratamientos evaluados.
Db: diámetro de crecimiento del testigo.
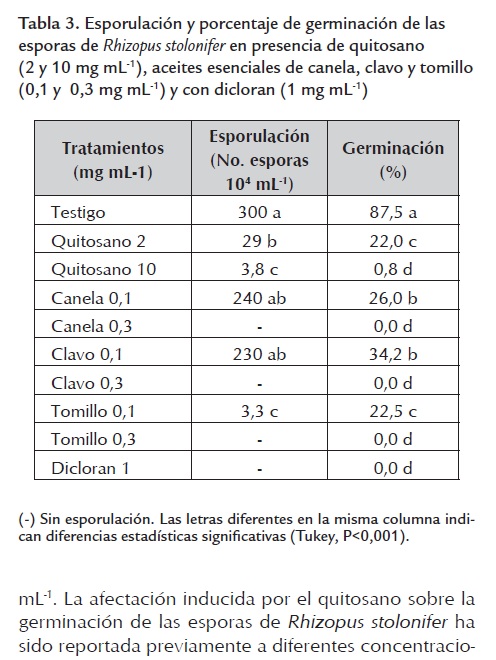
Esporulación. La esporulación de Rhizopus stolonifer en los diferentes tratamientos se evaluó a las 72 h de incubación. Se adicionaron 10 ml de agua destilada estéril, con una varilla de vidrio se raspó la superficie de las cajas para arrastrar las esporas y luego estas fueron transferidas a un frasco. Para inhibir la germinación a cada suspensión de esporas se le agregaron siete gotas de lactofenol, se agitaron y se tomaron 20 µl de las mismas y se colocaron en una cámara de Neubauer para cuantificar las esporas en un microscopio óptico (40X) (Nikon, Alphaphot-2YS2). Los datos se reportaron en número de esporas mL-1 (Hernández-Lauzardo et al., 2008).
Germinación de las esporas. Alícuotas de 50 µl con los tratamientos descritos previamente se colocaron en tubos Eppendorf. Se incubaron durante 12 h a 25 °C. Se tomaron 10 µl de cada tubo Eppendorf, se colocaron en un portaobjetos, se les agregó una gota de lactofenol y se cubrieron con un cubreobjetos. El conteo de la germinación de 100 esporas por muestra se realizó en un microscopio óptico (40X) con un contador manual. Las esporas se consideraron germinadas cuando el largo del tubo germinal fue igual o excedió la longitud de la espora (El Ghaouth et al., 1992).
Ensayo antifúngico in situ. Se emplearon frutos de tomate de la variedad “Saladette”, estado rojo maduro, sin daños mecánicos o síntomas de enfermedad. Se desinfectaron con hipoclorito de sodio al 1% durante 15 min, se lavaron tres veces con agua destilada y se dejaron secar a temperatura ambiente (25 ± 2 °C) sobre papel absorbente. Se establecieron los siguientes tratamientos: testigo negativo (agua destilada estéril sin inoculación de esporas), testigo positivo (agua destilada estéril), quitosano a 10 mg mL-1, los aceites esenciales a 0,3 mg mL-1, las combinaciones de quitosano a 10 mg mL-1 con cada aceite esencial a 0,3 mg mL-1 y el dicloran a 1 mg mL-1. En condiciones de esterilidad a cada fruto se le realizó con un bisturí, heridas de 2 mm de profundidad por 2 mm de ancho. Posteriormente cada fruto se sumergió totalmente durante 5 segundos en un vaso de precipitado que contenía cada tratamiento. Luego se colocaron en la campana de flujo, se secaron durante 5 minutos y se asperjaron con la solución de esporas de Rhizopus stolonifer mencionada anteriormente (excepto el testigo negativo). Los frutos tratados se incubaron en charolas de plástico organizadas horizontal y verticalmente para que los tratamientos tuvieran condiciones similares de iluminación, y temperatura (25 ± 2 °C) durante las 96 h del ensayo. Se evaluó el porcentaje de infección y el índice de severidad.
Porcentaje de infección e índice de severidad. Al término del periodo de almacenamiento, se cuantificaron los frutos que presentaban síntomas de pudrición blanda en cada tratamiento, el número total de frutos se consideró como el 100%. El índice de severidad se determinó sobre la superficie de los frutos con grados de daño según una escala establecida con las siguientes características; 0 = 0; 1 = 1-5%; 2 = 6-15%; 3 = 16-45%; 4 = 46-75% y 5 = 76-100% de daño visual por fruto y se calculó el índice de severidad mediante la ecuación descrita por Pérez et al., (1995): Índice de severidad = Xi(0) + Xi(1) + Xi(2) + Xi(3) + Xi(4) + Xi(5) / N donde Xi = número de frutos enfermos por cada grado de daño; 0, 1, 2, 3, 4, 5 = grado de daño en la escala utilizada y N = número total de frutos por unidad experimental.
Pérdida de peso. Los frutos de cada tratamiento se pesaron individualmente al inicio y al final del experimento. La pérdida de peso se evaluó a partir de la siguiente fórmula: pérdida de peso = (peso inicial - peso final) x 100.
Análisis estadísticos. Los experimentos se desarrollaron mediante un diseño experimental completamente al azar en arreglo simple. En los ensayos in vitro los datos obtenidos de crecimiento micelial y esporulación se analizaron mediante un análisis de varianza (ANOVA) de una vía y la comparación de medias se hizo con la prueba de Tukey utilizando el programa Sigma Stat 3.5. Los datos obtenidos en los ensayos in situ se analizaron de acuerdo a un ANOVA con el programa Sigma Stat 3.5.
Resultados y discusión
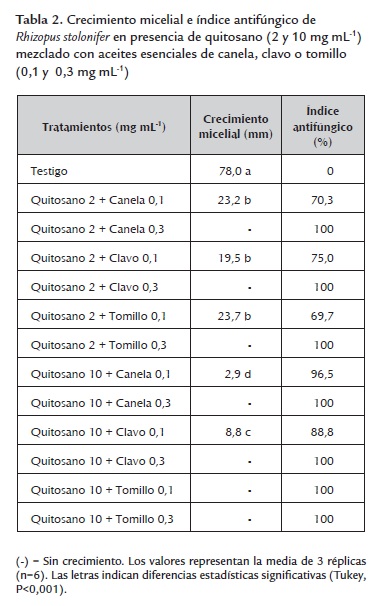
Efecto de los tratamientos sobre el crecimiento micelial de Rhizopus stolonifer. En la tabla 1 se muestran los resultados del crecimiento micelial de Rhizopus stolonifer y del índice antifúngico obtenido con las dos concentraciones de quitosano (2 y 10 mg mL-1) y los aceites esenciales de canela, clavo o tomillo (0,1 y 0,3 mg mL-1) y con dicloran (1 mg mL-1). El crecimiento micelial se redujo significativamente en comparación con el testigo en todos los tratamientos probados excepto en el tratamiento con aceite de canela a 0,1 mg mL-1. Se observó la inhibición total del crecimiento micelial con los aceites de canela, clavo y tomillo a 0,3 mg mL-1 y con el dicloran, resultados que coinciden con los reportados por Barrera-Necha et al., (2009), quienes utilizaron los aceites esenciales de canela, clavo y tomillo (0,1 y 0,3 mg mL-1) y observaron una total inhibición del crecimiento de Fusarium oxysporum f. sp. Gladioli. También se ha reportado una elevada actividad del fungicida dicloran en contra de Rhizopus stolonifer (Adaskaveg et al., 2002). De las dos concentraciones de quitosano evaluadas, la de 10 mg mL-1 mostró mayor índice antifúngico (77,4 %). Los resultados obtenidos con el quitosano son acordes con los reportados previamente donde se ha señalado que a mayores concentraciones de este polímero (0,5 a 2 mg mL-1) se observan mayores inhibiciones en el crecimiento micelial de Rhizopus stolonifer (Hernández-Lauzardo et al., 2007). En la tabla 2 se presentan los resultados del crecimiento micelial y el índice antifúngico obtenidos con las dos concentraciones de quitosano mezcladas con los aceites esenciales de canela, clavo o tomillo. El crecimiento de Rhizopus stolonifer se redujo significativamente en todos los tratamientos probados, observándose índices antifúngicos del 100% en la mezcla de quitosano (10 mg mL-1) con tomillo (0,1 mg mL-1) y en todas las mezclas de quitosano (2 y 10 mg mL-1) con los tres aceites esenciales a 0,3 mg mL-1. En general se observó un mayor efecto inhibitorio en el crecimiento micelial de Rhizopus stolonifer cuando se mezcló el quitosano con los aceites esenciales que cuando se utilizó este polímero de manera individual.
Efecto sobre la esporulación y germinación de las esporas. La esporulación fue cuantificada únicamente en los tratamientos con quitosano a 10 mg mL-1 y con aceite de tomillo a 0,1 mg mL-1, en los demás no hubo crecimiento micelial (tabla 3 ). Los resultados obtenidos en este trabajo con respecto al quitosano son similares a los obtenidos por Hernández-Lauzardo et al., (2008) donde se reportó una tendencia similar que refleja que las mayores concentraciones de quitosano de bajo peso molecular generaron mayores reducciones en la producción de esporas de Rhizopus stolonifer. En otro estudio se encontró que el quitosano a concentraciones menores del 1% afecta la esporulación de Botritis cinerea y Penicillium expansum al punto de disminuir considerablemente la cantidad de conidios (Liu et al., 2007). Por otra parte, un estudio reciente demostró que el aceite esencial de mandarina tiene la capacidad de inhibir la esporulación de los hongos fitopatógenos Alternaria alternata, Rhizoctonia solani, Curvularia lunata, Fusarium oxysporum y Helminthosporium oryzae (Chutia et al., 2009), sin embargo, no se encontraron reportes sobre posibles efectos de aceites esenciales sobre la esporulación de Rhizopus stolonifer. La germinación de las esporas de Rhizopus stolonifer (tabla 3 ) se inhibió significativamente en todos los tratamientos probados. Se observó una total inhibición de la germinación en los tratamientos con los tres aceites esenciales a 0,3 mg mL-1 y con el dicloran a 1 mg mL-1. La afectación inducida por el quitosano sobre la germinación de las esporas de Rhizopus stolonifer ha sido reportada previamente a diferentes concentraciones que oscilan desde 1 hasta 2 mg mL-1 (Hernández-Lauzardo et al., 2007 y 2008) y presentan patrones semejantes a los reportados en este trabajo, donde una mayor concentración del polímero produce una mayor inhibición en la germinación de las esporas. Por otro lado, acorde con los resultados obtenidos en este trabajo, Barrera-Necha et al., (2008) reportaron que los aceites esenciales de clavo y canela (250 µg mL-1) inhibieron en un 98% la germinación de los conidios de Colletotrichum gloeosporioides, sin embargo, el aceite de tomillo no afectó la germinación de los conidios de este hongo.
En la tabla 4 se presentan los resultados de la esporulación y germinación de las esporas de Rhizopus stolonifer tratadas con mezclas de quitosano y los tres aceites esenciales. Todos los tratamientos inhibieron significativamente la esporulación con respecto al testigo. Las mezclas de quitosano (2 mg mL-1) con los tres aceites a 0,3 mg mL-1 y las mezclas de quitosano (10 mg mL-1) con los tres aceites a 0,1 y 0,3 mg mL-1 inhibieron totalmente la producción de esporas. Por otro lado, la germinación de las esporas se inhibió de manera significativa en todas las mezclas probadas, observándose una inhibición absoluta en los tratamientos con cualquiera de los tres aceites probados a la concentración de 0,3 mg mL-1 mezclados con quitosano (2 y 10 mg mL-1). Este trabajo constituye el primer reporte del efecto de combinaciones de quitosano con aceites esenciales sobre la esporulación y germinación de esporas de Rhizopus stolonifer.
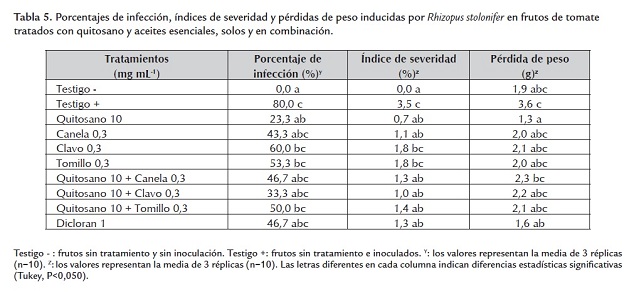
Evaluación de la aplicación de quitosano y de aceites esenciales en frutos de tomate. El estudio in situ se realizó utilizando los tratamientos que mostraron mayor efectividad para inhibir el desarrollo in vitro de Rhizopus stolonifer (quitosano a 10 mg mL-1, los aceites esenciales a 0,3 mg mL-1, las mezclas de quitosano a 10 mg mL-1 con cada aceite esencial a 0,3 mg mL-1 y el dicloran a 1 mg mL-1). En la tabla 5 se muestran los porcentajes de infección, índices de severidad y pérdidas de peso inducidas por Rhizopus stolonifer en frutos de tomate. El único tratamiento que logró inhibir significativamente la infección de Rhizopus stolonifer en los frutos de tomate fue el quitosano a 10 mg mL-1, los frutos presentaron solamente un 23,3% de infección, mientras que en el testigo sin tratamiento se observó un 80%, dato que es consistente con los resultados reportados recientemente por Badawy y Rabea (2009) quienes demostraron que el quitosano aplicado en concentraciones de 2 a 4 mg mL-1 puede controlar infecciones de Botritis cinerea en frutos de tomate. Los aceites esenciales no lograron disminuir significativamente el porcentaje de infección de los frutos, resultado que podría atribuirse a la naturaleza química de los aceites que contienen una amplia gama de compuestos volátiles, los cuales podrían disiparse de la superficie de los frutos y afectar la capacidad de inhibir la infección de Rhizopus stolonifer. (Guynot et al., 2003). Adicionalmente existen diversos factores tales como el pH y el contenido de azúcares y proteínas que pueden afectar la actividad antimicrobiana de los aceites esenciales (Gutiérrez et al., 2009). A pesar de los reportes previos que destacan la actividad antifúngica del dicloran contra Rhizopus stolonifer (Adaskaveg et al., 2002) e inclusive de la capacidad de este químico para controlar la pudrición blanda en frutos de durazno (De Carvalho et al., 2009), en el presente trabajo el dicloran no logró inhibir significativamente el porcentaje de infección, comportamiento que podría atribuirse a características intrínsecas de los frutos de tomate utilizados que interferirían con este compuesto.
Con relación al índice de severidad, se observó que todos los tratamientos redujeron significativamente este parámetro con excepción de los tratamientos individuales con aceites esenciales de clavo y tomillo. El quitosano y el dicloran fueron los únicos tratamientos que inhibieron en un buen porcentaje la pérdida de peso de los frutos, por encima de los aceites esenciales individuales y de las mezclas de estos con el quitosano. En investigaciones realizadas con Colletotrichum gloeosporioides en frutos de papaya, de manera análoga a estos resultados, se observó que el tratamiento individual con quitosano controló la antracnosis en los frutos, sin mejorar este efecto la adición de extractos vegetales (Bautista-Baños et al., 2003). El quitosano puede presentar interacciones con algunos componentes del agente antimicrobiano adicional. Recientemente se sugirió que el quitosano podría interactuar mediante puentes de hidrógeno con los terpenos de los aceites esenciales afectando la actividad antifúngica de las mezclas (Mayachiew et al., 2010).
Conclusiones
El tratamiento individual con quitosano fue el mejor para reducir la infección de los frutos de tomate inoculados con Rhizopus stolonifer.
Las mezclas de quitosano con los aceites esenciales de canela, clavo o tomillo no mostraron una mejor actividad antifúngica que el quitosano individual en los ensayos in situ.
El tratamiento individual con quitosano representa una alternativa natural para controlar la pudrición blanda en frutos de tomate.
Agradecimientos
Se agradece el apoyo financiero de la Secretaría de investigación y posgrado del Instituto Politécnico Nacional.
Referencias bibliográficas
1 Adaskaveg, J. E., Förster, H. and Sommer, N. F. 2002. Principles of postharvest pathology and management of decays of edible horticultural crops. In: A. Kader (ed.). Postharvest Technology of Horticultural Crops. University of California. Oakland, USA. pp. 163-195.
2 Badawy, M. E. I. and Rabea, E. I. 2009. Potential of the biopolymer chitosan with different molecular weights to control postharvest gray mold of tomato fruit. Postharvest Biology and Technology 51 (1): 110-117.
3 Barrera-Necha, L. L., Bautista-Baños, S., Flores-Moctezuma, H. I. y Rojas-Estudillo, A. 2008. Efficacy of essential oils on the conidial germination, growth of Colletotrichum gloeosporioides(penz.) Penz. And Sacc. and control of postharvest diseases in papaya (Carica papaya L.). Plant Pathology Journal 7 (2): 174-178.
4 Barrera-Necha, L. L., Garduño, C. y García-Barrera J. 2009. In vitro antifungal activity of essential oils and their compounds on mycelial growth of Fusarium Oxisporum f. sp. gladioli (Massey) Snyder and Hensen. Plant Pathology Journal 8 (1): 17-21.
5 Bautista-Baños, S., Hernández-Lauzardo, A. N., Velázquez-del Valle, M. G., Ait Barka, E., Bósquez-Molina, E. y Wilson, C. L. 2006. Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities. Crop Protection 25 (2): 108-118.
6 Bautista-Baños, S., Hernández-López, M., Bósquez-Molina, E. y Wilson, C. L. 2003. Effects of chitosan and plant extracts on growth of Colletotrichum gloeosporioides, anthracnose levels and quality of papaya fruit. Crop Protection 22 (9): 1087-1092.
7 Chutia, M., Deka-Bhuyan, P., Pathak, M. G., Sarma, T. C. and Boruah, P. 2009. Antifungal activity and chemical composition of Citrus reticulata Blanco essential oil against phytopathogens from North East India. LWT-Food Science and Technology 42 (3): 777-780.
8 De Carvalho, V. L., da Cunha, R. L., Clalfun, N. N. J. and Moura, P. H. A. 2009. Alternatives for pos-tharvest control of brown rot and soft rot in peach fruits. Revista Brasileira de Fruticultura 31 (1): 78-83.
9 Devlieghere, F., Vermeulen, A. and Debevere, J. 2004. Chitosan: antimicrobial activity, interactions with food components and applicability as a coating on fruit and vegetables. Food Microbiology 21 (6): 703-714.
10 El Ghaouth, A., Arul, J., Ponnampalam, R. and Boulet, M. 1991. Use of chitosan coating to reduce water loss and maintain quality of cucumbers and bell pepper fruits. Journal of Food Processing and Preservation 15 (5): 359-368.
11 El Ghaouth, A., Arul, J., Grenier, J. and Asselin, A. 1992. Antifungal activity of chitosan on two postharvest pathogens of strawberry fruits. Phytopathology 82 (4): 398-402.
12 Guo, Z., Chen, R., Xing, R., Liu, S., Yu, H., Wang, P., Li, C. and Li, P. 2006. Novel derivatives of chitosan and their antifungal activities in vitro. Carbohydrate Research 341 (3): 351-354.
13 Gutiérrez, J., Barry-Ryan, C. and Bourke, P. 2009. Antimicrobial activity of plant essential oils using food model media: efficacy, synergistic potential and interactions with food components. Food Microbiology 26 (2): 142-150.
14 Guynot, M. E., Ramos J., Seto, L., Purroy, P., Sanchis, V. and Marín, S. 2003. Antifungal activity of volatile compounds generated by essential oils against fungi commonly causing deterioration of bakery products. Journal of Applied Microbiology 94 (5): 893-899.
15 Hahn, F. 2006. Rhizopus stolonifer detection by sensing the tomato peduncle scar. Biosystems Engineering 95 (2): 171-179.
16 Hernández-Lauzardo, A. N., Bautista-Baños, S., Velázquez-del Valle, M. G. y Trejo-Espino, J. L. 2006. Identification of Rhizopus stolonifer Ehrenb. (Ex Fr.) Lind causal agent of Rhizopus rot disease of fruits and vegetables. Revista Mexicana de Fitopatología 24 (1): 65-69.
17 Hernández-Lauzardo, A. N., Hernández-Martínez, M., Velázquez-del Valle, M. G., Guerra-Sánchez M. G. y Melo-Giorgana, G. E. 2007. Actividad antifúngica del quitosano en el control de Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. y Mucor spp. Revista Mexicana de Fitopatología 25 (2): 109-113.
18 Hernández-Lauzardo, A. N., Bautista-Baños, S., Velázquez-del Valle, M. G., Méndez-Montealvo, M. G., Sánchez-Rivera M. M. y Bello-Pérez L. A. 2008. Antifungal effects of chitosan with different molecular weights on in vitro development of Rhizopus stolonifer (Ehrenb.:Fr.) Vuill. Carbohydrate Polymers 73 (4): 541-547.
19 Hernández-Muñoz, P., Almenar, E., Del Valle, V., Vélez, D. y Gavara, R. 2008. Effect of chitosan coating combined with postharvest calcium treatment on strawberry (Fragaria x ananassa) quality during refrigerated storage. Food Chemistry 110 (2): 428-435.
20 Hosseini, M. H., Razavi, S. H., Mousavi, S. M. A., Yasaghi, S. A. S. and Hasansaraei, A. G. 2008. Improving antibacterial activity of edible films based on chitosan by incorporating thyme and clove essential oils and EDTA. Journal of Applied Sciences 8 (16): 2895-2900.
21 Jiang, Y. M. and Li, Y. B. 2001. Effect of chitosan coating on postharvest life and quality of longan fruit. Food Chemistry 73 (2): 139-143.
22 Kanetis, L., Förster, H. and Adaskaveg, J. E. 2007. Comparative efficacy of the new postharvest fungicides azoxystrobin, fludioxonil and pyrimethanil for managing citrus mold. Plant Disease 91 (11): 1502-1511.
23 Liu J., Tian, S., Meng, X. and Xu, Y. 2007. Effects of chitosan on control of postharvest diseases and physiological responses of tomato fruit. Postharvest Biology and Technology 44 (3): 300-306.
24 Mayachiew, P., Devahastin, S., Mackey, B. M. and Niranjan, K. 2010. Effects of drying methods and conditions on antimicrobial activity of edible chitosan films enriched with galangal extract. Food Research International 43 (1): 125-132.
25 Northover, J. and Zhou, T. 2002. Control of Rhizopus rot of peaches with postharvest treatments of tebuconazole, fludioxonil and Pseudomonas syringae. Canadian Journal of Plant Pathology 24 (2): 144-153.
26 Pérez, M. N., Flores, P. J., García, V. L. y Lozano V. C. 1995. Factores genéticos y ambientales relacionados con la dinámica temporal y efecto de las enfermedades en fríjol (Phaseolus vulgaris L.) en Marín, Nuevo León, México. Revista Mexicana de Fitopatología 13 (1): 1-9.
27 Tripathi, P. and Dubey, N. K. 2004. Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables. Postharvest Biology and Technology 32 (3): 235-245.
28 Velázquez-del Valle, M. G., Bautista-Baños, S., Hernández-Lauzardo A. N., Guerra-Sánchez M. G. y Amora-Lazcano, E. 2008. Estrategias de control de Rhizopus stolonifer Ehrenb. (Ex Fr.) Vuill., agente causal de pudriciones postcosecha en productos agrícolas. Revista Mexicana de Fitopatología 26 (1): 49-55.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2011 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).