Producción y purificación parcial de enzimas hidrolíticas de Aspergillus ficuum en fermentación sólida sobre residuos agroindustriales
Palabras clave:
fermentación sólida, torta de canola, Aspergillus ficuum, fitasa, xilanasa, Solid fermentation, canola pressed cake, aspergillus ficuum, phytase, xylanase (es)Producción y purificación parcial de enzimas hidrolíticas de Aspergillus ficuum en fermentación sólida sobre residuos agroindustriales
Production and partial purification of Aspergillus ficuumhydrolytic enzymes in solid state fermentation of agroindustrial residues
Marcia Costa 1 , Marcelo Torres 1 , Haroldo Magariños 1 , Alejandro Reyes 2
1 Instituto de Ciencia y Tecnología de los Alimentos, Facultad de Ciencias Agrarias, Universidad Austral de Chile, Valdivia, Chile. mcosta@uach.cl mecostalobo@gmail.com
2 Instituto de Bioquímica, Facultad de Ciencias, Universidad Austral de Chile, Valdivia, Chile.
Recibido: mayo 31 de 2010 Aprobado: noviembre 25 de 2010
Resumen
En el presente trabajo se describe la producción de las enzimas fitasa, celulasa, xilanasa y proteasa conAspergillus ficuum cepa DSM 932 mediante fermentación en estado sólido (SSF) usando torta de canola y pomaza de cranberry como sustratos. Como medida indirecta de la producción de las enzimas se usó en cada caso la actividad enzimática. la torta de canola resultó ser un mejor sustrato para fitasa, celulasa y xilanasa, en tanto que la pomaza de cranberry resultó ser un sustrato potencial para proteasa. Mediante ultrafiltración escalonada fue posible purificar parcialmente los extractos enzimáticos de fitasa, celulasas y xilanasas, obtenidos a partir de torta de canola. La fitasa resultó tener un tamaño >100 kDa, en tanto que las celulasas y xilanasas presentan actividad en los retenidos de 10, 30 y 50 kDa, lo que indicaría que las isoenzimas de ambos complejos tienen pesos moleculares que oscilan entre 10 y 100 kDa.
Palabras clave: fermentación sólida, torta de canola, Aspergillus ficuum, fitasa, xilanasa.
Abstract
In this paper, describes the production of the enzymes phytase, cellulase, xylanase and protease by Aspergillus ficuum DSM 932 strain, in solid state fermentation (SSF) using canola cake and cranberry pomace as substrates. The enzyme activity was used in each case as an indirect measure of the enzymes production. Canola meal turned out to be a better substrate for phytase, cellulase and xylanase, while cranberry pomace was found to be a potential substrate for protease. Various ultrafiltration operations were carried out, decreasing the cut off membranes out in order to purify partially extracts of enzymes phytase, cellulase and xylanase, obtained from canola meal. Phytase was found to have a size >100 kDa, whereas cellulase and xylanase activity present in the retained 10, 30 and 50 kDa, suggesting that isozymes of both complexes have molecular weights ranging between 10 and 100 kDa.
Key words: Solid fermentation; canola pressed cake; aspergillus ficuum; phytase; xylanase.
Introducción
La fermentación en estado sólido (en adelante SSF) es una técnica conocida desde hace siglos y se define como el proceso fermentativo en el cual los microorganismos crecen sobre una matriz sólida en escasez o ausencia de agua libre (Blandino et al., 2005; Krishna, 2005). El sustrato debe contener sólo la humedad suficiente para favorecer el crecimiento y la actividad metabólica del microorganismo (De Ory et al., 2007). Estos sustratos no son solubles en agua y constituyen las fuentes de carbono, vitaminas y minerales que favorecen el crecimiento microbiano (Singh y Nigam, 1994). En la actualidad, la fermentación sobre sustrato sólido se usa con gran éxito en la producción de antibióticos, micotoxinas, surfactantes, ácidos orgánicos, compuestos aromáticos, pesticidas y enzimas, entre otros (Blandino et al., 2005; De Ory et al., 2007).
Los sustratos utilizados en este tipo de fermentación son muy variados, destacándose los cereales tales como trigo, centeno, arroz y maíz (De Ory et al., 2007; Harland y Harland, 1980), y subproductos agroindustriales como la torta de canola (Duvnjak et al., 1995). También se usan desechos de la agroindustria, los cuales son considerados los mejores sustratos para SSF ya que además de agregarle valor le proporcionan los nutrientes necesarios para el crecimiento del microorganismo (Krishna, 2005), ejemplo de ello son los residuos de manzana, plátano, uva, cítricos, caña de azúcar (Blandino et al., 2005) y pomaza de cranberry, entre otros (Shetty y Zheng, 1998).
La torta de canola es un subproducto de la industria productora de aceite comestible que contiene aproximadamente un 34% de proteínas, un 6% de ácido fítico, un 15% de fibra y un 26% de carbohidratos (Duvnjak y Nair, 1990), y se usa en alimentación de rumiantes. La pomaza de cranberry es un desecho de la industria productora de jugo de cranberry y contiene aproximadamente un 70% de fibra, un 2,2% de proteínas, un 8,4% de carbohidratos y antioxidantes polifenólicos (Howard et al., 2010).
Las fitasas son fosfatasas que pertenecen a la subfamilia de las fosfatasas ácidas histidina, las cuales catalizan la hidrólisis de las uniones fosfomonoester del fitato (sales de mio- inositol hexakisfosfato) o del mio-inositol 1, 2, 3, 4, 5, 6-hexakisdihidrógeno fosfato (ácido fítico), produciendo derivados penta, tetra, tri, di y monofosfato del mioinositol y fosfato inorgánico (Pi) (Duvnjak y Al - Asheh, 1994; Krishna, 2005). Existen dos clases de fitasas de importancia, las cuales reciben su nombre según la posición específica en donde comienza la hidrólisis en el grupo éster fosfato en la molécula del fitato, ellas son la 3- fitasa (EC 3.1.3.8) y la 6-fitasa (EC 3.1.3.26) (Roopesh et al., 2006). Su uso principal es en la industria de alimentos, donde se emplea en forma de suplemento en piensos para animales no rumiantes tales como los cerdos, los cuales no son capaces de utilizar el fósforo presente en el ácido fítico (mayor reservorio de fósforo en vegetales), debido a la ausencia de fitasa en su sistema digestivo. Este ácido fítico es eliminado en las heces, generando polución del suelo y eutroficación del agua por fosfatos. De esta forma, si se incorporan fitasas se reducen los efectos contaminantes ya que estos animales pueden acceder a una mayor biodisponibilidad de fosfato para sus necesidades fisiológicas (Roopesh et al., 2006; Walsh y Casey, 2003).
Celulasas es el nombre genérico que recibe un complejo de enzimas capaces de degradar celulosa, un polisacárido formado por moléculas de glucosa unidas entre sí por enlaces β- 1,4 (Krishna, 2005; Yamamoto et al., 1995).
Este complejo enzimático está conformado por la endo-1,4-β-D-glucanasa (EC 3.2.1.4), cuya función es hidrolizar los enlaces β-1,4 de la celulosa para producir gluco- oligosacáridos; la exo-1,4-β-D-glucanasa (celobiohidrolasa) (EC 3.2.1.91), que produce celobiosa a partir de celulosa y la β-D-glucosidasa (EC 3.2.1.21) que degrada los gluco-oligosacáridos a glucosa, se usa principalmente en las primeras etapas de la producción de glucosa y de etanol y para el tratamiento de materiales que contienen lignocelulosa (Blandino et al., 2005; Krishna, 2005; De Vries y Visser, 2001; Yamamoto et al.,1995).
Por otra parte, xilanasas es el nombre genérico para una familia de enzimas que catalizan la ruptura de los enlaces xilosídicos internos de la molécula de heteroxilano (xilano), un tipo de polisacárido constituyente mayoritario de la hemicelulosa, componente importante de la biomasa de la pared celular en vegetales (Fang et al., 2008; Anthonyet al., 2003). Las enzimas que participan de la biodegradación del heteroxilano son las endoxilanasas (EC 3.2.1.8), que rompen el esqueleto de xilano en pequeños oligosacáridos, y las β-xilosidasas (EC 3.2.1.37), que a su vez los degradan a moléculas de xilosa (De Vries y Visser, 2001). Su uso principal es en procesos de clarificación de vinos y jugos, y en procesos de biodecoloración de pulpa de papel (Krishna, 2005; Zhaoxin et al., 2008).
Las proteasas son enzimas muy importantes respecto a su rol fisiológico y por sus aplicaciones comerciales, ya que son fisiológicamente necesarias para los organismos vivientes tales como plantas, animales y microorganismos (Boer y Peralta, 2000). Además, son de las enzimas fúngicas hidrolíticas producidas por SSF en mayor volumen, alcanzando su producción cerca del 60% del total mundial de enzimas producidas industrialmente (Krishna, 2005). Las aplicaciones de proteasas son muy variadas, destacándose su uso en las industrias del cuero, la seda, los alimentos, los medicamentos, los detergentes, entre otras (Tunga et al., 2003).
En atención a los antecedentes antes señalados, se planteó como objetivo general de este trabajo estimar la potencialidad de la torta de canola y de la pomaza de cranberry como sustratos para la fermentación sólida deAspergillus ficuum, y la producción de diversas enzimas hidrolíticas tales como fitasas, celulasas, xilanasas y proteasas. Y como objetivos específicos, obtener extractos semipurificados de las enzimas fitasas, celulasas y xilanasas.
Materiales y métodos
Medios de cultivo
Se usó torta de canola (65 g) y pomaza de cranberry (150 g) suplementados con sulfato de amonio a razón de 1:20 como sustratos para cultivos en SSF en placas de Petri de 150 mm de diámetro a modo de prototipos de reactores tipo bandejas, y fueron esterilizadas en autoclave (12 1oC, 15 min). La humedad final de ˜ 40% se logró una vez inoculados. Todos los ensayos se efectuaron en duplicado y los análisis en triplicado.
Cepa y propagación de inóculo
Para cada ensayo se preparó una suspensión de esporas al extraerlas desde una placa de Agar Papa Dextrosa del hongo A. ficuum con 3 mL de Tritón X-100 al 0,1% estéril. Luego se tomaron alícuotas de 50 μL de este stock de esporas (4,36 x 107 esporas mL-1), se inocularon en caldo de activación (Bacto-Dextrosa 20 g L-1, Difco y extracto de levaduras 4 g L-1, Difco) y se incubaron en agitador orbital (180 rpm, 25 oC, 24-36 h) hasta lograr una suspensión de micelio con morfología de pellet de ˜ 3 mm de diámetro. De esta suspensión se inocularon 35 mL en cada una de las placas que contenían torta de canola, y 5 mL en las que contenían pomaza de cranberry.
Cultivos SSF
Las placas se incubaron en una estufa a 25 oC con circulación de aire saturado por 6 días (ensayo con torta de canola) y por 14 días (ensayo con pomaza de cranberry), tomando muestras diarias espacialmente al azar (˜ 7,5 g para ensayo con torta canola y ˜ 5,5 g para ensayo con pomaza de cranberry) en cámara de flujo laminar, las que fueron guardadas en tubos Falcon estériles y refrigeradas a 4oC hasta realizar el proceso de extracción de todas las muestras en cada ensayo.
Lo anterior con la finalidad de obtener las curvas de las cinéticas de producción de cada enzima durante los cultivos en SSF en ambos sustratos. Como indicativo de producción se usó en cada caso la actividad enzimática de las diferentes enzimas.
Una vez conocidas las cinéticas de producción de cada enzima se procedió a efectuar cultivos en SSF pero sólo usando torta de canola como sustrato, deteniendo la fermentación el día indicado como de máxima actividad de cada enzima, para conformar de esa forma volúmenes mayores de cada extracto y proceder a purificarlas parcialmente.
Ensayos enzimáticos y de proteínas totales
Extracción. Al finalizar la toma de muestras para cada ensayo, se realizó el proceso de obtención de cada uno de los extractos crudos que contenían las enzimas producidas en cada tiempo de muestreo. El proceso de extracción sólido-líquido se efectuó con una disolución estéril de Tritón X-100 al 0,1% a razón 5:1 respecto del peso de la muestra en un agitador orbital a 25 oC por 2 h a 250 rpm, seguido de una etapa de centrifugación a 7.520xG por 10 min a 4 oC, obteniendo de los sobrenadantes los extractos crudos que se utilizaron en los diferentes ensayos de actividad enzimática.
Determinación de la actividad enzimática. Para determinar la actividad fitásica se usó como sustrato ácido fítico (en forma de su sal dodecasódica, Sigma) y el método utilizado fue el descrito por Harland y Harland (1980) modificado, el cual hace uso del reactivo de Taussky - Shorr, que permite detectar el fosfato inorgánico (Pi) mediante una reacción en que primeramente ocurre una reducción del ácido fosfomolíbdico por el sulfato ferroso y posteriormente se forma un complejo azul de Pi-molibdato reducido, cuya absorbancia se mide a 660 nm (Taussky y Shorr, 1953).
Para determinar la actividad celulásica y xilanásica se utilizó el método propuesto por Miller (1959) modificado, en el que luego de enfrentar 0,5 mL de cada extracto con 1 mL de carboximetilcelulosa (Merck, 1% p/v en buffer glicina-NaOH 0,05M, pH 9,0) o 1 mL de Birchwood xilano (Sigma, 0,5% p/v en buffer citrato 0,05M, pH 5,4) durante 10 min a 50 oC, se formaron azúcares reductores (celulosa y xilosa respectivamente), y para detectarlos se usó el reactivo DNS (ácido 3,5-dinitrosalicílico, color amarillo) que al reaccionar con dichos azúcares se reducía a ácido 3-amino-5-nitrosalicilico de color rojo, cuya absorbancia se midió a 510 nm. Para determinar la actividad proteasa se usó el método descrito por Xu et al. (2000) modificado. Finalmente, para la determinación de proteínas totales se utilizó la técnica descrita por Lowry et al. (1951). Cabe señalar que todas las mediciones espectrofotométricas se realizaron en el instrumento Spectronic Genesys 5.
Se definió que una unidad de actividad enzimática fitásica (FTU), celulásica (U) y xilanásica (U) corresponde a la cantidad de enzima que libera 1 µmol de Pi/min, 1 µmol de glucosa/min y 1 µmol de xilosa/min bajo las condiciones de cada ensayo, respectivamente. Se definió como una unidad de actividad enzimática proteásica (U) al cambio de una unidad de absorbancia por hora a 280 nm para 1,0 mL de volumen total de ensayo. Para efectos de esta investigación, la actividad enzimática se expresó en términos de FTU/gr sustrato sólido seco (FTU/gSs) y U/gr de sustrato sólido seco (U/gSs), en tanto que la actividad específica fue expresada en términos de FTU/mg proteína y U/mg proteína.
Semipurificación de los extractos enzimáticos
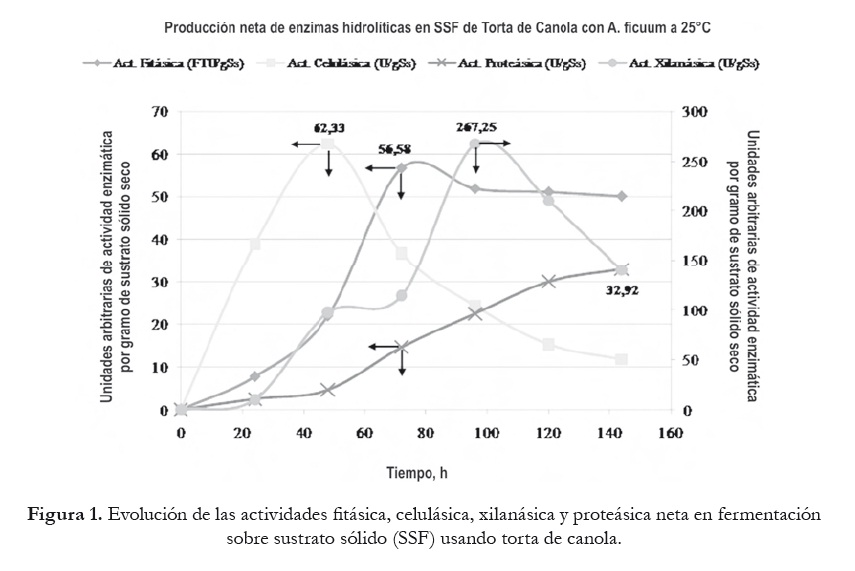
De acuerdo con la información entregada por cada una de las cinéticas de producción de cada una de las enzimas, se procedió a obtener los extractos de cultivos en SSF sobre canola el día de máxima actividad, y a microfiltrarlos (Millipore 0,45 µ), tomando la precaución de medir actividad enzimática de fitasa, celulasa y xilanasa antes y después (figura 1). A continuación, se procedió a purificarlos parcialmente mediante un proceso de ultrafiltración escalonada usando una celda de ultrafiltración Amicon de 50 mL de capacidad con membranas Millipore de 100 kDa (60 rpm, 30 min, 20 oC para fitasa, celulasa y xilanasa), y continuando con tubos Centriplus de 50 kDa (4500 rpm, 60 min, 4 oC), 30 kDa (4500 rpm, 90 min, 4 oC) y 10 kDa (4500 rpm, 120 min, oC) (para celulasa y xilanasa), verificando en cada etapa la actividad enzimática específica. Los retenidos finales fueron diafiltrados para aumentar la purificación. En las figuras 2 y 3 se presenta un esquema de cómo se llevó a cabo cada uno de estos procesos.
Resultados y discusión
Producción de enzimas hidrolíticas mediante SSF
Los resultados de la fermentación en torta de canola se presentan en la figura 1, donde es posible apreciar que la máxima producción neta de fitasa se logró al tercer día (56,58 FTU/gSs; e.d. por g de sólido seco). Esta producción es similar a la obtenida por Costa et al. (2009), no obstante la mayor concentración de inóculo aplicada, concordando con Krishna y Nokes (2001) que señalan que el tamaño del inóculo no interfiere en la producción de la enzima. Asimismo, Duvnjak et al. (1995) en SSF de A. ficuum NRRL 3135 sobre torta de canola con 64% de humedad lograron una producción máxima de fitasa al tercer día (˜ 5 FTU/g). Así también, Chantasartrasamee et al. (2005) en SSF de A. oryzae, sobre medio basado en un triturado de soya y harina de arroz, lograron un máximo de 16 FTU/g al cuarto día de fermentación.
Para celulasa se obtuvo un máximo de producción neta al segundo día (62,33 U/gSs). Blandino et al. (2005) realizaron ensayos en SSF con A. awamori sobre pomaza de uva blanca obteniendo un máximo de producción de esta enzima al primer día (9,6 U/gSs). Así también, Gutiérrez-Correa et al. (2010), en SSF con A. niger, usando perlita (especie de vidrio volcánico amorfo), lograron un máximo de 1,2 FPA (actividad en filtro de papel) al tercer día. Por su parte, Kang et al. (2004), a partir de una SSF con A. niger sobre medio basado en salvado de trigo y paja de arroz obtuvieron una producción máxima de 100 U/g entre el quinto y sexto día de fermentación.
Respecto a xilanasa, el máximo de producción neta se alcanzó al cuarto día (267,25 U/gSs). Dicha producción es mayor a la obtenida por Blandino et al. (2005), que fue de 40,4 U/gSs al primer día para una SSF con A. awamori sobre pomaza de uva blanca. Asimismo, Zhaoxin et al. (2008) realizaron ensayos en SSF con A. ficuum usando un medio que contenía bagazo y salvado de trigo, y obtuvieron un máximo de 70 U/mL al quinto día. Por su parte, Prasertsan et al. (1997) en SSF, con A. niger en un medio que contenía torta de palma con un 50% de humedad, obtuvieron un máximo de producción de 14,79 U/g al tercer día de fermentación.
Finalmente, para proteasa su producción máxima neta se alcanzó en el sexto y último día del periodo de fermentación (32,92 U/gSs). Xu et al. (2000), a partir de una SmF con A. niger usando medio de cultivo YM (manitol - extracto de levadura), determinando la actividad mediante la hidrólisis de BSA fracción V, y midiendo A280, obtuvieron un máximo de 2800 U/L al sexto día. Por su parte, Boer y Peralta (2000) realizaron ensayos en SmF con A. tamarii en un medio de cultivo que contenía 1% de salvado de trigo y otro con 1% de harina de soya, determinando la actividad mediante la reacción de hidrólisis de la caseína y midiendo la tirosina libre mediante el método de Lowry obtuvieron un máximo de producción entre el cuarto y quinto día (120 U/mL) para el medio con salvado de trigo, y al sexto día (161 U/mL) para el medio con harina de soya.
De acuerdo con los resultados obtenidos, la torta de canola resultó ser un buen sustrato para la producción de estas enzimas hidrolíticas ya que la composición de la misma (descrita en la Introducción) contiene una variedad de fuentes nutritivas que son aprovechadas por A. ficuum DSM 932 para su crecimiento.
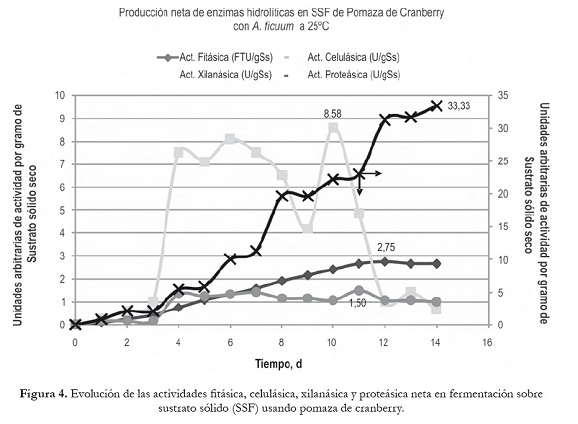
Los resultados de la fermentación en pomaza de cranberry se presentan en la figura 4, donde se aprecia que la producción de fitasa neta alcanzó un máximo al duodécimo día de fermentación (2,75 FTU/gSs), la de celulasa neta al décimo día (8,58 U/gSs), xilanasa neta al undécimo día (1,5 U/gSs) y proteasa neta al decimocuarto y último día de fermentación (33,33 U/gSs). Al compararlos con la producción lograda en torta de canola, con la sola excepción de proteasa, el resto de las enzimas hidrolíticas presentan muy bajos niveles, contrario a lo esperado para celulasa y xilanasa, dado elevado el contenido de fibra de este residuo, pero este sustrato tiene el inconveniente de presentar una elevada acidez lo cual hizo que el crecimiento de A. ficuum fuera más lento; aún así, pomaza de cranberry se ha utilizado en SSF con Lentinus edodes y Rhizopus oligosporus, para producir antioxidantes como ácido elágico que posee propiedades antimicrobianas y anticancerígenas (Shetty y Vattem, 2002, 2003; Shetty et al., 2005).
Semipurificación de los extractos enzimáticos
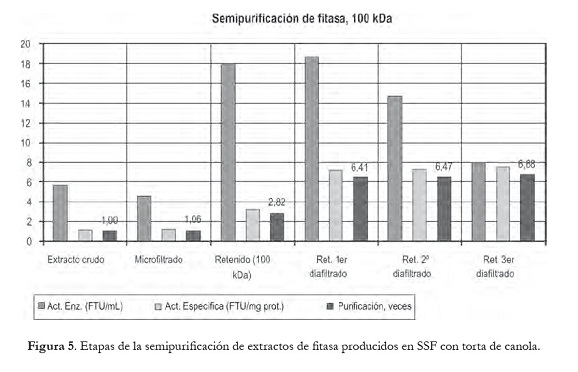
La figura 5 muestra los resultados obtenidos en las distintas etapas de semipurificación de los extractos crudos de fitasa, donde se aprecia que se concentró y purificó parcialmente 6,68 veces el extracto de una SSF en canola, mediante tecnologías de membrana y diafiltrando tres veces consecutivas el retenido de 100 kDa, siendo posible observar el aumento de la actividad específica durante todo el proceso, y el gran efecto de la diafiltración (3,18 → 7,53). Además, cabe señalar que sólo el retenido presentó actividad fitásica, lo que es indicativo de que la enzima tiene un tamaño = 100 kDa. Estos resultados son similares a los reportados por Costa et al. (2009), quienes estudiaron la producción de enzima fitasa en SmF y SSF utilizando la misma cepa de A. ficuum usada en esta investigación. Droráková et al. (1997) reportaron un tamaño ˜ 100 kDa para una fitasa de A. niger. Asimismo, Walsh y Casey (2003) obtuvieron para una fitasa de A. niger ATCC 9142 un tamaño ˜ 84 kDa, lo cual concuerda con lo propuesto por Ullah y Gibson (1987), quienes indicaron que el peso aproximado de la enzima nativa oscila entre 85 a 100 kDa.
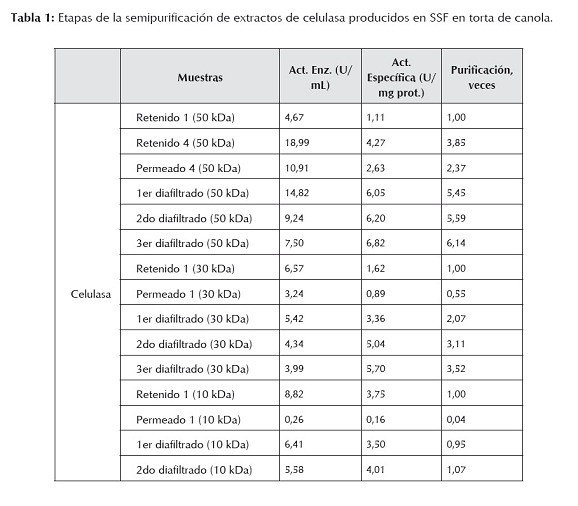
La tabla 1 presenta los resultados obtenidos en las distintas etapas de semipurificación de extractos crudos de celulasa, se observa que se concentró y purificó parcialmente 6,14 veces el extracto de una SSF en canola, mediante tecnologías de membrana y diafiltrando tres veces consecutivas el retenido de 50 kDa; el retenido de 30 kDa se concentró y purificó parcialmente 3,53 veces, y finalmente, con el retenido de 10 kDa sólo se logró 1,07 veces. También es posible apreciar el aumento de la actividad específica en estos retenidos durante todo el proceso y el efecto de la diafiltración. Cabe señalar, que sólo el filtrado de 100 kDa presentó actividad celulásica, lo que es indicativo de que las enzimas que forman parte de este complejo tienen tamaños que oscilan entre 10 y 100 kDa. Este comportamiento reafirma que la celulasa no es una sola enzima sino un complejo multienzimático que actúa de una forma sinérgica para la degradación de la celulosa (Wood y McCrae, 1979). Este fenómeno se refiere a la observación de que la actividad máxima de degradación de la celulosa no se da por enzimas individuales, sino por mezclas de tres o más enzimas (Nidetzky et al., 1994).
De Vries y Visser (2001) presentan los tamaños moleculares de diversas celulasas confirmando la gran variabilidad existente. Es así como para algunas especies de Aspergillus señalan: una endoglucanasa de A. nidulans de 12,5 kDa, una β-glucosidasa de A. nidulans de 26 kDa, una endoglucanasa de A. oryzae de 31 kDa, una β-glucosidasa de A. niger de 49 kDa, una exoglucanasa de A. niger de 52,5 kDa, una endoglucanasa de A. aculeatus de 66 kDa, otra β-glucosidasa de A. niger de 96 kDa, etc. Asimismo, Yamamoto et al. (1995) obtuvieron para una endoglucanasa de A. niger IFO 31125 un tamaño de ˜40 kDa.
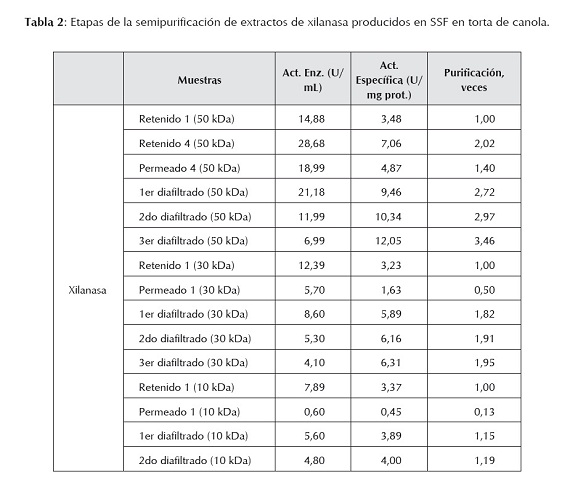
La tabla 2 presenta los resultados obtenidos en las distintas etapas de semipurificación de extractos crudos de xilanasa, donde se observa que se concentró y purificó parcialmente 3,46 veces el extracto de una SSF en canola, mediante tecnologías de membrana y diafiltrando tres veces consecutivas el retenido de 50 kDa, el retenido de 30 kDa se concentró y purificó parcialmente 1,95 veces, y finalmente, el retenido de 10 kDa se concentró y purificó parcialmente 1,19 veces. También es posible apreciar el aumento de la actividad específica en estos retenidos durante todo el proceso, y el efecto de la diafiltración. Al igual que el extracto de celulasas, sólo el filtrado de 100 kDa presentó actividad xilanásica, lo que es indicativo de que las enzimas que forman parte de este complejo tienen tamaños que oscilan entre 10 kDa y 100 kDa. Este comportamiento es similar a la celulasa, es decir, el de un complejo multienzimático, donde cada componente tiene una función específica, representando una muy buena estrategia para degradar de forma eficiente la compleja molécula de xilano (Polaina y MacCabe, 2007).
De Vries y Visser (2001), al igual que para celulasa, presentan los tamaños moleculares de diversas xilanasas de algunas especies de Aspergillus: una endoxilanasa de A. niger de 13 kDa, una endoxilanasa de A. aculeatus de 18 kDa, una endoxilanasa de A. kawachii de 35 kDa, una endoxilanasa de A. oryzae de 46,5 kDa, una β-xilosidasa deA. fumigatus de 60 kDa, una β-xilosidasa de A. foetidus de 83 kDa, otra β-xilosidasa de A. fumigatus de 90 kDa, etc. Asimismo, Zhaoxin et al. (2008) informan un tamaño ˜35 kDa para una de las enzimas del complejo xilanasa de Aspergillus ficuum AF-98, y Fang et al. (2008) informan ˜18,8 kDa para una de las enzimas del complejo xilanasa de Aspergillus carneus M 34.
Conclusiones
La producción máxima neta de fitasa se alcanzó al tercer día en torta de canola y al duodécimo día en pomaza de cranberry. En celulasas la máxima producción neta se presentó al segundo día en torta de canola y al décimo día en pomaza de cranberry. La producción máxima neta de xilanasas se alcanzó al cuarto día en torta de canola y al undécimo día en pomaza de cranberry, y finalmente, la proteasa mostró una producción máxima neta al sexto día en torta de canola y al decimocuarto día en pomaza de cranberry.
La producción mediante SSF de fitasa, celulasa y xilanasa fue mayor en torta de canola con respecto a pomaza de cranberry, en tanto que la producción de proteasa fue muy similar para ambos sustratos sólidos.
La enzima fitasa de A. ficuum DSM 932 mostró tener un tamaño >100 kDa pues al ultrafiltrar extractos enzimáticos por membranas de 100 kDa de cut-off, sólo se presentó actividad en el retenido.
Las enzimas de los complejos celulasa y xilanasa de A. ficuum DSM 932 mostraron tener tamaños moleculares entre 10 y 100 kDa, es así como al ultrafiltrar los extractos enzimáticos crudos por membranas de 100 kDa cut-offsólo mostraron actividad en el filtrado y a su vez los extractos ultrafiltrados presentaron actividad en los retenidos de 50 kDa, 30 kDa y 10 kDa de cut-off, respectivamente.
Aplicando tecnologías de membrana, microfiltración, ultrafiltración escalonada y diafiltración, fue posible purificar 6,68 veces un extracto de fitasa (fracción retenida 100 kDa), 6,14 veces un extracto de celulasa (fracción retenida 50 kDa), y 3,46 veces un extracto de xilanasa (fracción retenida 50 kDa) producidas en SSF con torta de canola.
Agradecimientos
Este trabajo fue posible gracias al Proyecto DID-UACH S-2008-54; igualmente, se agradece a las empresas Oleotop y Cran Chile.
Referencias bibliográficas
1 Anthony, T., Chandra Raj, K., Rajendran, A., Gunasekaran, P. 2003. High molecular weight cellulase - free xylanase from alkali - tolerant Aspergillus fumigatus AR 1. Enzyme and Microbial Technology 32: 647-654.
2 Blandino, A., Botella, C., De Ory, I., Webb, C., Cantero, D. 2005. Hydrolytic enzyme production by Aspergillus awamori on grape pomace. Biochemical Engineering Journal 26: 100-106.
3 Boer, C.G., Peralta, R.M. 2000. Production of extracellular protease by Aspergillus tamarii. J Basic Microbiol: 40 (2): 75-81.
4 Chantasartrasamee, K., Israngkul Na Ayuthaya, D., Intarareugsorn, S., Dharmsthiti, S. 2005. Phytase activity from Aspergillus oryzae AK9 cultivated on solid state soybean meal medium. Process Biochemistry 40: 2285-2289.
5 Costa, M., Lerchundi, G., Villarroel, F., Torres, M., Schöbitz, R. 2009. Producción de enzima fitasa de Aspergillus ficuum con residuos agroindustriales en fermentación sumergida y sobre sustrato sólido. Rev Colomb Biotecnol 11(1): 73-83.
6 De Ory, I., Caro, I., Díaz, A. B., Blandino, A. 2007. Evaluation of the conditions for the extraction of hydrolytic enzymes obtained by solid state fermentation from grape pomace. Enzyme and Microbial Technology,, 41: 302-306.
7 De Vries, R. P., Visser, J. 2001. Aspergillus enzymes involved in degradation of plant cell wall polysaccharides. Microbiol Mol Biol Rev 65 (4): 497-522.
8 Droráková, J., Volfová, O., Kopecký, J. 1997. Characterization of phytase produced by Aspergillus niger. Folia Microbiologica 42 (4): 349-352.
9 Duvnjak, Z., Ebune, A., Al-Asheh, S. 1995. Production of phytase during solid state fermentation using Aspergillus ficuum NRRL 3135 in canola meal. Bioresource Technology 53: 7-12.
10 Duvnjak, Z., Al-Asheh, S. 1994. Characteristics of phytase produced by Aspergillus carbonarius NRC 401121 in canola meal. Acta Biotechnologica 14 (3): 223-233.
11 Duvnjak, Z., Nair, V. C. 1990. Reduction of phytic acid content in canola meal by Aspergillus ficuum in solid state fermentation process. Appl Microbiol Biotechnol 34: 183-188.
12 Fang, H-Y., Chang, S-M., Lan, C-H., Fang, T. J. 2008. Purification and characterization of a xylanase from Aspergillus carneus M 34 and its potential use in photoprotectant preparation. Process Biochemistry 43: 49-55.
13 Gutiérrez-Correa, M., Gamarra, N. N., Villena, G. K. 2010. Cellulase production by Aspergillus niger in biofilm, solid-state, and submerged fermentations. Appl Microbiol Biotechnol 87(2):545-51.
14 Harland, B. F., Harland, J. 1980. Fermentative reduction of phytase in rye, white, and whole wheat breads. Cereal Chem 57 (3): 226-229.
15 Howard, L. R., White, B. L., Prior, R. L. 2010. Proximate and Polyphenolic Characterization of Cranberry Pomace. J Agric Food Chem 58: 4030-4036.
16 Kang, S. W., Park, Y. S., Lee, J. S., Hong, S. I., Kim, S. W. 2004. Production of cellulases and hemicellulases by Aspergillus niger KK2 from lignocellulosic biomass. Bioresource Technology 91: 153-156.
17 Krishna, C., Nokes, S. E. 2001. Influence of inoculum size on phytase production and growth in solid-state fermentation by Aspergillus niger. Transactions of the ASAE 44 (4): 1031-1036.
18 Krishna, C. 2005. Solid State Fermentation Systems - An Overview. Critical Reviews in Biotechnology,, 25: 1-30.
19 Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. 1951. Protein measurement with the Folin phenol reagent. J Biol Chem 193: 265-275.
20 Miller, G. L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31 (3): 426-428.
21 Nidetzky, B., Steiner, W., Hayn, M., Claeyssens, M. 1994. Cellulose hydrolysis by the cellulases from Trichoderma reesei: a new model for synergistic interaction. Biochem J 298 Pt 3: 705-710.
22 Polaina, J., MacCabe, A. P. 2007. Industrial Enzymes Structure, Function and Applications. Springer, 641 pp.
23 Prasertsan, P., Kittikul, A. H., Kunghae, A., Maneesri, J., Oi, S. 1997. Optimization for xylanase and cellulase production from Aspergillus niger ATTC 6275 in palm oil mill wastes and its application. World Journal of Microbiology & Biotechnology 13: 555-559.
24 Roopesh, K., Ramachandran, S., Nampoothiri, K. M., Szakacs, G., Pandey, A. 2006. Comparison of phytase production on wheat bran and oilcakes in solid state fermentation by Mucor racemosus. Bioresource Technology 97: 506-511.
25 Shetty, K., Vattem, D. A., Lin, Y. T. 2005. Enrichment of phenolic antioxidants and anti-Helicobacter pylori properties of cranberry pomace by solid - state bioprocessing. Food Biotechnology 19 (1): 51-68.
26 Shetty, K., Vattem, D. A. 2002. Solid - state production of phenolic antioxidants from cranberry pomace by Rhizopus oligosporus. Food Biotechnology 16 (3): 189-210.
27 Shetty, K., Vattem, D. A. 2003. Ellagic acid production and phenolic antioxidant activity in cranberry pomace (Vaccinium macrocarpon) mediated by Lentinus edodes using a solid - state system. Process Biochemistry 39: 367-379.
28 Shetty, K., Zheng, Z. 1998. Cranberry processing waste for solid state fungal inoculant production. Process Biochemistry 33 (3): 323-329.
29 Singh, D., Nigam, P. 1994. Solid state (substrate) fermentation systems and their applications in biotechnology. J Basic Microbiol 34 (6): 405-423.
30 Taussky, H., Shorr, E. 1953. A microcolorimetric method for the determination of inorganic phosphorus. Journal of Biological Chemistry 202 (2): 675-685.
31 Tunga, R., Shrivastava, B., Banerjee, R. 2003. Purification and characterization of a protease from solid state cultures of Aspergillus parasiticus. Process Biochemistry 38: 1553-1558.
32 Ullah, A. H., Gibson, D. M. 1987. Extracellular phytase (E.C. 3.1.3.8) from Aspergillus ficuum NRRL 3135: purification and characterization. Prep Biochem 17 (1): 63-91.
33 Walsh, G., Casey, A. 2003. Purification and characterization of extracellular phytase from Aspergillus niger ATCC 9142. Bioresource Technology 86: 183-188.
34 Wood, T. M., McCrae, S. I. 1979. Synergism between enzymes involved in the solubilization of native cellulose. Advances in Chemistry Series 181: 181-209.
35 Xu, J., Wang, L., Ridgway, D., Gu, T., Moo-Young, M. 2000. Increased heterologus protein production in Aspergillus niger fermentation through extracellular proteases inhibition by pelleted growth. Biotechnol Prog 16: 222-227.
36 Yamamoto, K., Akiba, S., Kimura, Y., Kumagai, H. 1995. Purification and characterization of a protease - resistant cellulase from Aspergillus niger. J Ferment Bioeng 79 (2): 125-130.
37 Zhaoxin, L., Fengxia, L., Mei, L., Xiaomei, B., Haizhen, Z., Yi, W. 2008. Purification and characterization of xylanase from Aspergillus ficuum AF - 98. Bioresource Technology 99: 5938-5941.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2010 Revista Colombiana de Biotecnología

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Esta es una revista de acceso abierto distribuida bajo los términos de la Licencia Creative Commons Atribución 4.0 Internacional (CC BY). Se permite el uso, distribución o reproducción en otros medios, siempre que se citen el autor(es) original y la revista, de conformidad con la práctica académica aceptada. El uso, distribución o reproducción está permitido desde que cumpla con estos términos.
Todo artículo sometido a la Revista debe estar acompañado de la carta de originalidad. DESCARGAR AQUI (español) (inglés).