REPRODUCCIÓN DE Trachemys callirostris callirostris(EMYDIDAE) EN AMBIENTES GENERADOS POR LA MINERÍA EN LA GUAJIRA, COLOMBIA
Reproduction of Trachemys callirostris callirostris (Emydidae) in environments created by mining in La Guajira, Colombia
DOI:
https://doi.org/10.15446/abc.v19n3.41597Palabras clave:
anidación, cacería, hicotea. (es)hicotea, hunting, nesting. (en)
Artículo de investigación
REPRODUCCIÓN DE Trachemys callirostris callirostris(EMYDIDAE) EN AMBIENTES GENERADOS POR LA MINERÍA EN LA GUAJIRA, COLOMBIA
Reproduction of Trachemys callirostris callirostris (Emydidae) in environments created by mining in La Guajira, Colombia
CINDY LEGUÍZAMO-PARDO1, M. Sc.; MARÍA ARGENIS BONILLA GÓMEZ2, Ph. D.
1 Grupo Biología de Organismos Tropicales, Universidad Nacional de Colombia, Bogotá, Colombia. ccleguizamop@unal.edu.co
2 Profesora Asociada, Departamento de Biología, Universidad Nacional de Colombia, Grupo Biología de Organismos Tropicales (BIOTUN), Bogotá, Colombia. mabonillag@unal.edu.co
Autor de correspondencia: Cindy Leguízamo Pardo, ccleguizamop@unal.edu.co
Recibido 16 de enero de 2014, aceptado con modificaciones 22 de marzo de 2014, fecha de reenvío 19 de abril de 2014.
Citation / Citar este artículo como: LEGUÍZAMO-PARDO C, BONILLA GÓMEZ MA. Reproducción de Trachemys callirostris callirostris (Emydidade) en ambientes generados por la minería en La Guajira, Colombia. Acta biol. Colomb. 2014;19(3):363-380.
RESUMEN
La tortuga hicotea (Trachemys callirostris callirostris) es una subespecie sometida a una alta extracción en Colombia, de la cual no se conoce nada sobre su reproducción en zonas altamente alteradas con bajo impacto por la cacería. Para ello, en tres ambientes acuáticos generados por la minería de carbón en la mina del Cerrejón, departamento de La Guajira, estudiamos algunas características reproductivas de la hicotea durante el periodo reproductivo de 2011 (marzo a junio). Solamente en las lagunas de estabilización registramos un éxito de eclosión positivo (56,9 %). En el embalse de minería, la tasa de depredación de 100 % fue el factor limitante del éxito de eclosión, por lo que recomendamos el aislamiento de los nidos del principal depredador (zorro patón: Procyon cancrivorus) y el traslado de nidadas para su incubación ex-situ. La baja anidación registrada en la zona rehabilitada pudo haberse debido a una extracción de hembras adultas, a factores limitantes del hábitat que influyen en el crecimiento de los individuos, o por factores de tipo demográfico. Las diferentes variables estudiadas a nivel de los huevos y los neonatos en los tres sectores, evidencian la posibilidad de que las hembras anidantes posean tamaños mayores que las de otras poblaciones de Colombia sometidas a la cacería. Sin embargo, para establecer el grado de variación geográfica, es necesario determinar la variación temporal de las características reproductivas en la población del Cerrejón.
Palabras clave: anidación, cacería, hicotea.
ABSTRACT
The Colombian slider turtle (Trachemys callirostris callirostris) is a subspecies under a high level of exploitation in Colombia, of which nothing is known about its reproduction in highly disturbed areas with low hunting pressure. We studied some reproductive traits in three different aquatic environments created by coal mining in the Cerrejon mine, La Guajira department, during part of the reproductive season in 2011 (between March and June). We recorded hatching success (56.9 %) only in the stabilization ponds. In the mining reservoir, the 100 % predation rate was the factor limiting hatching success. The recommended option there is protect the nests from the main predator (Procyon cancrivorus) and the relocation of some of them for ex-situ incubation. The low level of nesting recorded in the rehabilitated area may have been the result of extraction of adult females, but also could be due to habitat limiting factors influencing the growth of individuals, or by demographic factors. Size variables measured for clutches, eggs, and hatchlings at the three study sites, showed the possibility that nesting females are larger than those of other populations subjected to hunting in Colombia. However, to determine the extent of geographic variation when compared to other populations it will be necessary to examine temporal variation in reproductive traits of the Cerrejon population.
Keywords: hicotea, hunting, nesting.
INTRODUCCIÓN
En las tortugas de agua dulce, características reproductivas como edad y tamaño a la madurez, tamaño de la nidada, frecuencia de postura, periodos y zonas de anidación, comúnmente presentan variaciones de acuerdo con el clima y el hábitat, tanto a nivel poblacional como específico (Gibbons, 1990; Gibbons y Greene, 1990). Estas variaciones son más evidentes en especies con rangos de distribución amplios, como las especies del género Trachemys, entre ellas Trachemys scripta scripta, la más estudiada de las tortugas de agua dulce (Gibbons, 1982; Gibbons, 1990; Gibbons y Greene, 1990; Aresco, 2004).
La tortuga hicotea, Trachemys callirostris callirostris, es una subespecie que se distribuye en Colombia y Venezuela, principalmente en la región Caribe colombiana desde el occidente del golfo de Urabá hasta el sur de La Guajira (para 1975, Medem las consideró localmente extintas en este departamento), incluyendo los complejos cenagosos de los ríos Sinú, San Jorge, Magdalena y Ranchería (Castaño-Mora, 2002). Su posición taxonómica a nivel de especie planteada por Seidel (2002) fue reevaluada en diciembre de 2011 por el Grupo de Trabajo en Taxonomía de Tortugas, el cual propuso en su revisión anual la asignación provisional de T. c. callirostris a subespecie de Trachemys ornata, es decir, a Trachemys ornata callirostris (TTWG, 2011). Sin embargo, para efectos de facilitar los vínculos con la literatura publicada, en este estudio se seguirá la denominación de Seidel (2002).
En Colombia, algunos aspectos de la biología y la ecología reproductiva de la tortuga hicotea han sido estudiados en algunas de sus poblaciones, principalmente en ecosistemas naturales, a saber: en la ciénaga El Totumo (Atlántico) y ejemplares de la Estación de Biología Tropical "Roberto Franco" por Medem (1975); en la Mojana (Sucre) por Sampedro et al., (2003a, 2003b); y en la depresión Momposina por Bernal et al., (2004), Daza (2005), Correa (2006), Restrepo et al., (2006), Daza y Páez (2007), Restrepo et al., (2007).
En Colombia, se estima que el apareamiento se da durante la estación de lluvias, alrededor de los meses de septiembre (Medem, 1975) y noviembre (Sampedro et al., 2003b). Al igual que ocurre con otras especies acuáticas tropicales, su anidación es discontinua y se presenta durante los meses de la estación seca (Miller y Dinkelacker, 2008). En Colombia, la temporada de anidación sucede principalmente entre febrero y mayo, aunque puede iniciar en diciembre o enero (Medem, 1975; Daza, 2005; Correa, 2006; Bock et al., 2010). También se tiene evidencia de una temporada de anidación adicional, probablemente entre agosto y noviembre, y de varias posturas en un mismo periodo de anidación (Medem, 1975; Sampedro et al., 2003b; MAVDTUN, 2009; Bock et al., 2010). La extensión del ciclo de vida de esta subespecie no se conoce, pero podría ser similar a la de Trachemys scripta debido a su cercanía filogenética (Seidel, 2002; Fritz et al., 2012); dicha extensión ha sido estimada en 30 años (Gibbons y Semlitsch, 1982).
En el contexto cultural y alimentario, las hicoteas son parte muy importante de las sociedades de la región Caribe (MAVDT-UN, 2009). Las tasas de extracción en las poblaciones de estas tortugas (que desde la década de 1970 se han venido incrementando para el uso comercial de su carne), han generado un descenso en el tamaño promedio de los adultos; actualmente cerca del 70 % de los pescadores las caza para venderlas, particularmente las hembras que son más apetecidas por su mayor tamaño, carne blanda y porque luego de capturadas se mantienen vivas por más tiempo, en especial si están sin desovar (Medem, 1975; Fuentes et al. 2003; Bernal et al., 2004; MAVDT-UN, 2009). Se ha comprobado que la cacería está relacionada con la disminución de los tamaños promedio de las hembras de T. c. callirostris, lo cual ha llevado también a una reducción en los tamaños de las nidadas (Bernal et al., 2004; Daza, 2005; Daza y Páez, 2007).
Frente a esta amenaza por sobreexplotación y a la creciente transformación de la región Caribe, que han llevado a una degradación de sus sistemas cenagosos en los últimos años (principalmente debido a la contaminación y a la sedimentación), evidenciada en las ciénagas del sur del Cesar como consecuencia del impacto antrópico en sus alrededores y cuencas (ríos Magdalena y Lebrija; Jaramillo et al., 2013), insta a la necesidad de adelantar investigaciones en áreas transformadas donde también habitan hicoteas. La mina El Cerrejón y su área de influencia en La Guajira (Colombia) presentan diferentes tipos de ambientes acuáticos generados por las actividades mineras, en donde se han observado hicoteas pero no se conoce nada acerca de su ecología reproductiva. Por tanto, el objetivo principal de este trabajo fue conocer, en tres diferentes ambientes acuáticos en la mina del Cerrejón, algunas de las características reproductivas de la hicotea y la forma en que estas se relacionan.
MATERIALES Y MÉTODOS
Área de estudio
El estudio fue llevado a cabo en la mina del Cerrejón, ubicada en el departamento de La Guajira al Noreste de Colombia, a una altitud promedio de 100 m (10°57'10"–11°09'47" N y 72°43'58"–72°30'54" W). Esta es la mina de carbón a cielo abierto más grande del mundo y sus depósitos se hallan en una extensión de 640.000 ha (Báez y Diazgranados, 2010). En Cerrejón la temporada seca ocurre entre enero y marzo, el resto del año se presentan lluvias que son más suaves entre abril y junio, y más intensas entre agosto y diciembre; julio representa un breve verano con un descenso de las lluvias (Gualdrón, 2011).
El muestreo fue realizado en tres ambientes acuáticos con un grado de alteración alto, por ser de origen artificial y con una cobertura vegetal original removida total o parcialmente: (1) "Complejo Lagunas de estabilización" (Lag_est), (2) embalse de sumidero de minería "Embalse 3" (Mine_E3), y (3) embalse en zona rehabilitada "El Muerto" (Rehab_EM) (Fig. 1). El primero funciona para el tratamiento de aguas residuales domésticas mediante biodegradación, el segundo actúa como receptor de las aguas provenientes de los acuíferos subterráneos (aguas de minería) de las zonas de perforación cercanas, y el tercero por hallarse en una zona rehabilitada recibe el agua de un arroyo natural (Aguas blancas).
El sector Rehab_EM es el que más semeja un ambiente natural, con una cobertura arbustiva a boscosa dominada por especies como el trupillo (Prosopis juliflora), aromo (Vachellia farnesiana), yaguaro (Caesalpinia mollis) y brasil (Haematoxylum brasiletto), y en menor medida el uvito macho (Cordia alba), quebracho (Astronium graveolens), olivo prieto (Morisonia americana) y guamacho (Pereskia guamacho), como resultado del Programa de Rehabilitación consistente en la reforestación de áreas transformadas por la minería, que para el caso de este sector fue empleado como botadero de material rocoso (residuo de las perforaciones), y su rehabilitación se inició en 1990 empleando pasto buffel (Cenchrus ciliaris) como cobertura inicial para fijar el suelo reintroducido (Gualdrón, 2011). Se encuentra alejado de las vías de equipo pesado y de la actividad minera (mínimo 1,2 km), y dada su ubicación periférica algunos habitantes de la región entran allí a pescar (Fig. 1a).
El sector Lag_est está conformado por un conjunto de cinco lagunas, cuya periferia se encuentra enmallada y posee puntos para el paso de fauna terrestre (aberturas de 20x38 cm). Se encuentra ubicado cerca del Centro de Rehabilitación de Fauna de Cerrejón (CRFC), la vía del tren y el río Ranchería (Fig. 1b). La vegetación que rodea estas lagunas es herbácea y es objeto de podas frecuentes. El sector Mine_E3 se encuentra muy cerca de las zonas activas de explotación y de las vías de tránsito de equipo pesado, además colinda con un fragmento de bosque nativo y también guarda cercanía con el río Ranchería (Fig. 1c).
Con relación a la calidad de agua en los sectores, los datos obtenidos por Cerrejón dentro de sus actividades de monitoreo para Lag_est (mediciones trimestrales entre julio-2010 y abril-2011) y Mine_E3 (mediciones mensuales entre julio-2010 y junio-2011), muestran valores de oxígeno disuelto dentro de los límites permitidos para aguas con fines de preservación de flora y fauna (Decreto 1594 de 1984, Artículo 45), y junto con los valores de demanda biológica y química de oxígeno ayudan a sustentar la idea de que no existe gran cantidad de materia orgánica en descomposición en sus aguas. Los valores de nitratos, nitritos y fosfatos indican que no hay contaminación por macronutrientes, generalmente derivados de la actividad agrícola, la cual no es desarrollada alrededor de los sectores de muestreo. Los sulfatos, aunque moderadamente bajos en Lag_est, se encuentran bastante elevados en Mine_E3, probablemente por ser aguas de origen subterráneo. La calidad del agua en Rehab_EM no es monitoreada por Cerrejón.
Temporada de anidación y periodo de incubación
Para definir la duración de la temporada de anidación, se tomó como inicio el mes en el que se registró el primer nido y como final el mes en el que se registró el último nido puesto en cada sector.
Para determinar el periodo de incubación se estimaron las fechas de postura y de eclosión para cada nido monitoreado, y luego se calculó el número de días transcurridos durante ese periodo. De este modo, para la fecha de postura se asignó un número de días al momento de encontrar el nido, de acuerdo con: (1) la presencia de huevos de color crema, cubiertos por el mucus oviductal de la madre, con un punto blanco conspicuo correspondiente al saco de aire, y una hendidura circular en posición longitudinal (un día), (2) huevos con la misma coloración crema pero sin el mucus oviductal de la madre (tres días), y (3) huevos con coloración crema (siete días) a blanca (diez días) pero con cáscara relativamente suave y flexible. A los nidos que contenían huevos con cáscara blanca y más endurecida, se les consideró en "estado avanzado" y no les fue asignado un número de días de postura. Esta clasificación se construyó a partir de las observaciones suministradas por los auxiliares del CRFC, con un extenso conocimiento tradicional sobre los nidos de hicotea, las cuales también fueron contrastadas y complementadas con las observaciones al desarrollo de los huevos en los nidos realizadas por Medem (1975) para la hicotea, y por Moll y Legler (1971) para T. venusta.
Para calcular la fecha de eclosión se estimó el número de días transcurridos desde iniciado este proceso, de acuerdo con el grado de absorción del vitelo de los neonatos, de la siguiente forma: (1) neonatos con vitelos grandes o aún dentro del cascarón (uno o dos días), (2) neonatos con vitelos medianos a pequeños (tres días), (3) neonatos con vitelos absorbidos pero con el plastrón en proceso de cicatrización (cinco días), y (4) neonatos con plastrones completamente cicatrizados (siete días). Esta estimación fue posible gracias a que los neonatos no salen del nido hasta no absorber por completo el vitelo. Para los nidos avanzados y para los que fueron hallados con neonatos, la fecha de postura se calculó empleando el valor promedio del periodo de incubación obtenido, contado hacia atrás a partir de la fecha de eclosión.
Zonas de anidación
Para caracterizar las zonas de anidación, a cada nido monitoreado se le midió: (1) la mínima distancia lineal al borde del agua, (2) la textura del suelo al tacto, evaluando sus características tanto seco, como húmedo y saturado en agua, según lo cual se llega a una textura particular dentro de la gama de los suelos arenosos, limosos o arcillosos (Casanova et al., 2004), y (3) el tipo de vegetación predominante a 2 m a la redonda del nido (según cobertura a nivel del terreno). Esta última variable se clasificó en cuatro estratos verticales de acuerdo con la altura de la vegetación, así: rasante (0 a 0,3 m), herbácea (0,3 a 1,5 m), arbustiva (1,5 a 5 m) y arbórea (>5 m) (adaptado de Rangel y Velásquez, 1997).
Adicionalmente, hacia el final del muestreo (junio de 2011) se caracterizaron las principales zonas de anidación identificadas, es decir aquellas en donde se presentó una alta concentración de nidos relativo a cada sector, con base en la altura máxima de la vegetación, los estratos verticales de la vegetación presente (rasante, herbáceo, arbustivo, arbóreo), la textura del suelo al tacto y la inclinación del terreno, medida con hipsómetro (TruPulse, serie 200B).
Nidos, huevos y neonatos
El muestreo se realizó entre el 9 de marzo y el 21 de junio de 2011. Por medio de recorridos a lo largo del perímetro de las lagunas, dos a tres veces por semana en cada sector, se ubicaron nidos de hicotea mediante la detección de los rastros con la ayuda de los auxiliares del CRFC. A cada nido encontrado se le retiró cuidadosamente la tapa e inspeccionó su contenido, el cual podía estar constituido por huevos o neonatos. Los acá denominados "nidos monitoreados" fueron aquellos cuyo contenido se encontraba vivo, mientras que aquellos con el contenido completamente depredado se denominaron "nidos ya depredados".
Cuando el contenido estaba constituido por huevos, se procedió a sacarlos del nido sin alterar su posición inicial durante la manipulación con el fin de no producir el aborto de los embriones, para contarlos, medirlos y revisar el estado en el que se encontraban. Al finalizar se procedió a depositarlos nuevamente en el nido, guardando lo mejor posible su posición espacial dentro del mismo. Para facilitar la localización y el monitoreo de los nidos, disminuir su depredación y retener los neonatos, alrededor de la entrada se instaló una malla plástica (25 x 70 cm, ojo de malla 2 mm) sostenida por cuatro varillas metálicas, formando un cuadrado. Tomando como marco de referencia el periodo de incubación promedio reportado por Correa (2006) y Restrepo et al. (2007), el cual está entre 7,6 y 8,0 semanas, los nidos que después de siete semanas de incubación no presentaron señales de eclosión fueron revisados, si aún estaban en incubación se cerraban y revisaban nuevamente pasados siete días, y de ser necesario cada tres días hasta su destino final.
Cuando el contenido del nido estaba constituido por neonatos, estos fueron depositados dentro de una caja de icopor con arena humedecida (para recrear en cierta medida las condiciones del nido) y trasladados luego al CRFC, donde se midieron en el término de las siguientes 24 horas. Allí fueron mantenidos en ambientes artificiales dentro de cubetas plásticas inclinadas, elaborados con agua, arena y rocas; desde el principio se mantuvieron juntos los neonatos de cada nido, sin mezclar las nidadas. Cuando no se encontraron los neonatos en el nido, pero los rastros no evidenciaban su pérdida por depredación sino la eclosión, se tomaron como nacidos vivos; en consecuencia no fue posible medir todos los neonatos. Los rastros consistieron en un pequeño orificio a un lado de la entrada y cascarones rotos dentro del nido (sin signos de depredación por hormigas), con un extremo fragmentado en fibras, tal como lo retrataron Moll y Legler (1971) para T. venusta. Es probable que estos neonatos hayan migrado al agua, pues cerca del nido no se encontraron conchas que evidenciaran depredación, y en algunos casos también se encontró un pequeño hoyo debajo de la malla.
También se midieron algunas características de la forma del nido: profundidad, volumen de la cavidad, y diámetros menor y mayor de la entrada, estos últimos con el fin de calcular el área de la entrada al nido aproximando su forma a una elipse de acuerdo con la ecuación: Π * (Diámetro menor/2) * (Diámetro mayor/2). Para medir el volumen, se introdujo una bolsa plástica que se llenó con agua hasta la entrada del nido, y luego se midió el volumen contenido con jeringas de 50 y 3 mL.
Características reproductivas
Se registró el tamaño de la nidada (número total de huevos en el nido; Miller, 2000), el largo y ancho de los huevos, y las siguientes medidas para los neonatos: largo recto del caparazón (LRC), ancho del caparazón (AC, en la cisura de los escudos marginales 6 y 7), largo recto del plastrón (LRP) y altura de las conchas (AltC), siguiendo las recomendaciones de Rueda-Almonacid et al., (2007). Las longitudes se tomaron con calibrador manual de 0,05 mm de precisión, y el peso con balanza digital de 0,1 g de precisión (marca Tanita). Con el largo y ancho de los huevos se calculó su volumen empleando la fórmula del elipsoide de acuerdo con la ecuación: (4/3)Π * (Ancho/2)2 * (Largo/2)
Adicionalmente, a los nidos que registraron neonatos se les calculó el éxito de eclosión (porcentaje del número de huevos eclosionados sobre el tamaño de la nidada; Miller, 2000).
Depredación de nidos
El seguimiento a la depredación se hizo de dos formas, una mediante el conteo de los huevos depredados al inicio del monitoreo, y la otra mediante la observación externa hasta hallar rastros de depredación. Dependiendo de estos, se daba fin al mismo junto con el registro de los rastros y el conteo de los huevos depredados. En aquellos nidos donde hubo depredación parcial o total de la nidada, se calculó el porcentaje de depredación en el nido (número de huevos y neonatos depredados en el nido sobre el tamaño de la nidada por cien; Miller, 2000).
De otra parte, para determinar los depredadores invertebrados se tomaron muestras de las hormigas observadas en los nidos y fueron conservadas en alcohol al 70 %; la determinación se hizo siguiendo las claves de Palacio y Fernández (2003). Para determinar a uno de los depredadores vertebrados que atacaba los nidos durante la noche, se montaron dos cámaras trampa desde el atardecer y hasta la mañana siguiente durante tres noches en diferentes puntos alrededor de la laguna del sector Mine_ E3, puesto que su acción mostraba ser muy importante allí, utilizando como cebo un huevo de hicotea depredado (que aún conservaba buena parte de su contenido) dentro de un nido falso. Aunque el atrayente funcionó, las cámaras no registraron al depredador. Por tanto, para su identificación se empleó como guía la descripción de este animal aportada por los auxiliares del CRFC, quienes afirmaban conocer el animal, y se contrastó con literatura relacionada (Medem, 1975; Morales-Jiménez et al., 2004;Tirira, 2007). El otro depredador vertebrado fue observado en campo, y por esto fue fácil determinarlo, así como conocer sus rastros al depredar los nidos de hicotea.
Análisis estadístico
Para explorar la independencia entre las características reproductivas en cada sector, previa verificación de los supuestos de normalidad, se realizó un análisis de correlación empleando el coeficiente de Spearman, entre: (1) el porcentaje de depredación de los tres sectores con la distancia al agua (Correa, 2006; Restrepo et al., 2007), (2) el éxito de eclosión de los nidos del sector Lag_est con la distancia al agua, la profundidad y el volumen del nido (Moll y Legler, 1971; Congdon y Gibbons, 1990; Bernal et al., 2004), y (3) el tamaño de la nidada de los tres sectores con: la distancia al agua, el área de entrada, la profundidad y el volumen del nido (Congdon y Gibbons, 1990).
Para comparar el largo y ancho de los huevos se construyó un diagrama de dispersión categorizado por sector con los valores promedio de estas variables por nido. También se evaluó la correlación entre el tamaño de la nidada y el promedio del largo, ancho y volumen del huevo por nido en cada sector, empleando el coeficiente de correlación de Pearson (dada la normalidad de estas variables).
Para explorar la asociación entre las variables de los neonatos del sector Lag_est (LRC, AC, LRP, AltC y peso), se realizó un análisis de componentes principales (ACP) con base en matrices de correlación, debido a que las variables no eran homogéneas (con una misma escala de medida; Guisande et al., 2006). Para observar en mayor detalle la distribución de los casos en función de las variables de los neonatos, se construyó la matriz de los diagramas de dispersión, empleando los valores promedio por nido en lugar de los valores individuales, con el fin de tener una representación gráfica más clara al reducir la cantidad de puntos.
Para estudiar la distribución de las variables categóricas textura del suelo y tipo de vegetación circundante al nido, entre el conjunto de nidos monitoreados en cada sector, con el fin de obtener la caracterización de las zonas de anidación, se realizó un análisis de correspondencias múltiples (ACM). Este análisis, que trabaja únicamente con variables cualitativas, analiza las variables por medio de frecuencias y elabora una representación geométrica de los caracteres (cualquier tipo de atributo) y las poblaciones (grupos de individuos que se pueden dividir en una categoría; en nuestro caso, los nidos) en función de la distribución de sus frecuencias relativas (para lo cual emplea la distancia geométrica Χ2; Guisande et al., 2006). Para este análisis, se definieron las categorías de las variables de la siguiente manera: sector de procedencia (Lag_est,, Mine_E3, Rehab_EM), textura del suelo (franca, franco-arenosa, franco-limosa) y tipo de vegetación circundante al nido (rasante, herbácea, arbustiva, arbórea). Todos los análisis se realizaron con el programa Statistica versión 7 (Statsoft, 2004).
RESULTADOS
Temporada de anidación y periodo de incubación
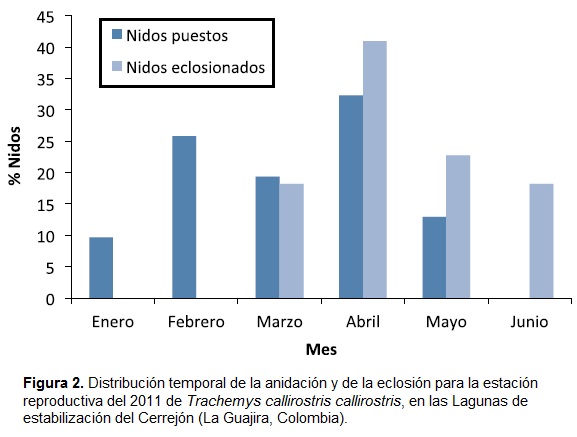
La distribución temporal de la anidación y de la eclosión para el año 2011 se presenta únicamente para el sector Lag_ est, dado que solo allí se registró eclosión. Esta distribución muestra que la temporada de anidación inició en enero y concluyó en mayo, y presentó dos picos, uno en febrero y otro en abril, siendo este último el que registró la mayor cantidad de nidos (diez; Fig. 2). Así mismo, la eclosión de los nidos comenzó en marzo y finalizó en junio, y presentó sólo un pico en abril con un valor de 41% (nueve nidos).
En los sectores Mine_E3 y Rehab_EM, la temporada de anidación de 2011 fue menor que en Lag_est. En ambos sitios, la anidación comenzó en marzo y finalizó en mayo. Sin embargo, la presencia de algunos nidos ya depredados en Mine_E3 desde el inicio del muestreo, plantea la posibilidad de que la anidación haya iniciado desde febrero.
El periodo de incubación se determinó únicamente para el sector Lag_est, y fue equivalente a 52 días en promedio, con un intervalo de 45 a 60 días de duración.
Zonas de anidación
La distancia promedio a la que estuvieron los nidos con respecto al borde de los cuerpos de agua fue de 1,87 m en Lag_est (DE=3,00; n=39), 5,39 m en Mine_E3 (DE=3,72; n=72), y 4,56 m en Rehab_EM (DE=2,65; n=5), y en ninguno de los casos superó 16 m.
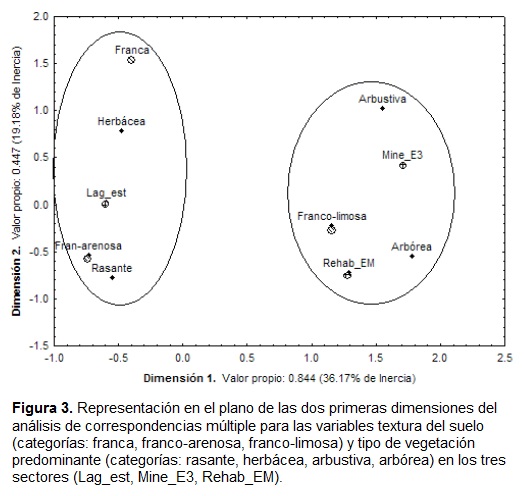
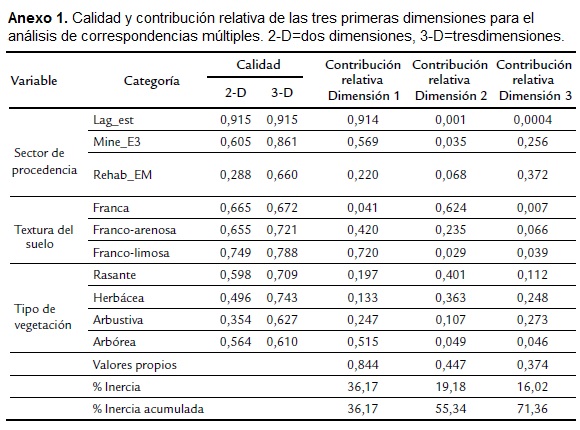
La caracterización de las zonas de anidación obtenida a partir del ACM, con base en las variables categóricas "textura del suelo" y "tipo de vegetación circundante" de los nidos monitoreados, definió dos grupos: uno constituido por nidos ubicados en zonas con suelos de texturas franca y franco-arenosa, y rodeados por vegetación rasante y herbácea (entre 0 y 1,5 m de altura), característico del sector Lag_est; y otro constituido por nidos ubicados en suelos franco-limosos rodeados por vegetación arbustiva y arbórea (entre 1,5 y 9 m de altura), propio de los sectores Mine_E3 y Rehab_EM (Fig. 3).
En este análisis, la dimensión 1 se relaciona con el estrato de la vegetación, pues hacia la izquierda están ubicados los estratos bajos y hacia la derecha los estratos altos, mientras que la dimensión 2 se relaciona con la textura del suelo, donde los suelos francos se encuentran en la parte superior del eje y los suelos franco, franco-arenosos y franco-limosos hacia la parte inferior. Las dos primeras dimensiones del ACM explicaron en conjunto el 55,3 % de la varianza (% inercia acumulada) y definieron muy bien la agrupación descrita, pues los valores de calidad fueron altos para todas las variables (excepto por sector Rehab_EM y vegetación arbustiva, cuyos valores fueron los más bajos; Anexo 1). Si se agrega la dimensión 3, con la cual se explica un 71,4 % de la varianza (Anexo 1), la asociación descrita se mantiene. Lo anterior es consistente con la descripción hecha al final del muestreo a las principales zonas de anidación identificadas, en la cual se encontró que en el sector Lag_ est, estas zonas están constituidas por superficies planas (inclinación= 0°) y únicamente cubiertas por hierba (desprovistas de vegetación arbustiva y arbórea), pero con suelos de textura variable, desde franca, a franco-arenosa y franco-limosa. En este sector predominó el estrato rasante de la vegetación (< 30 cm) durante la sequía, tanto por las condiciones climáticas, como por las frecuentes podas de hierba que se realizaron allí. Durante las lluvias de mayo y junio, la vegetación alcanzó alturas entre 30 cm y 1,5 m.
Por otra parte, en los sectores Mine_E3 y Rehab_EM las zonas de anidación fueron muy similares. Allí todos los estratos de la vegetación estuvieron presentes (a excepción del arbustivo en algunas zonas de Mine_E3), la altura del dosel estuvo entre 6 y 9 m, y los suelos tuvieron texturas francas y franco-limosas. La diferencia estuvo a nivel de la inclinación de las zonas, que fue menos pronunciada en Mine_E3 (entre 2,2 y 17,0°) que en Rehab_EM (entre 2,4 y 28,0°).
Nidos, huevos y neonatos
En el sector Lag_est se monitorearon 31 nidos, uno de los cuales se perdió por la erosión causada por las fuertes lluvias de La Niña (entre finales de abril e inicios de junio de 2011), y adicionalmente, se registraron ocho nidos ya depredados (39 nidos en total). En el sector Mine_E3 se monitorearon siete nidos y se registraron además 66 nidos ya depredados (para un total de 73 nidos); estos últimos habían sido depredados completamente por un depredador vertebrado que escarbaba los nidos haciéndoles perder su forma original, dejando los cascarones de los huevos alrededor del mismo, razón por la cual el tamaño de la nidada fue medido solo cuando el rastro de los cascarones era claro (también se les midió la distancia lineal al borde del agua). En el sector Rehab_EM se monitorearon únicamente cinco nidos, dos de los cuales quedaron aislados a consecuencia de las lluvias y no se pudo conocer su destino final.
El área de entrada al nido tuvo valores promedio similares en Lag_est y Mine_E3, con una menor variación en el último (Prom.=36,1 cm2; DE=9,5; n=32, y Prom.=32,5 cm2; DE=5,4; n=7, respectivamente); mientras que en Rehab_ EM tanto el promedio como la variación fueron mucho mayores (Prom.=41,9 cm2; DE=21,5; n=4). En cuanto a la profundidad del nido, los sectores que tuvieron tanto promedios como variaciones similares fueron Lag_est (Prom.=12,1 cm; DE=1,7; n=32) y Rehab_EM (Prom.=12,5 cm; DE=1,2; n=5), mientras que Mine_E3 presentó los mayores valores (Prom.=14,4 cm; DE=2,2; n=7).
El volumen del nido en el sector Mine_E3 obtuvo el valor promedio más alto y la menor variación (Prom.=536,9 mL, DE=66,3; n=7), a diferencia de Lag_est y Rehab_EM donde tanto los valores promedio como las variaciones fueron similares (Prom.=377,7 mL; DE=138,0; n=26, y Prom.=389,8 mL; DE=146,5; n=5, respectivamente).
Las dimensiones de los huevos (largo, ancho y volumen) fueron bastante homogéneas en cada sector y entre sectores (Tabla 1); en general, el tamaño de los huevos fue de 4,0 cm de largo por 2,5 cm de ancho, y el volumen de 13,9 mL. Al evaluar la dispersión de los valores promedio del ancho y el largo de los huevos por nido en los tres sectores, el tamaño promedio mostró estar principalmente entre los 2,45 a 2,70 cm de ancho en los tres sectores, y entre los 3,8 y 4,1 cm de largo en Mine_E3 y Lag_est (Fig. 4); se observa que el tamaño promedio de los huevos de Rehab_EM fue el más variable, mientras que en Mine_E3 se mantuvo dentro de valores intermedios, y que en los nidos de Lag_est los huevos alcanzaron tamaños promedio desde intermedios a altos. Al correlacionar el tamaño de la nidada con las variables promedio del huevo (ancho, largo y volumen), no fueron significativas para ninguno de los tres sectores.
Las medidas morfométricas y el peso de los neonatos del sector Lag_est tuvieron en general una variación muy baja (Tabla 2). Las dimensiones LRC, AC y LRP, estuvieron en promedio por encima de los 3,1 cm, con valores muy similares entre el AC y el LRP. De acuerdo con los resultados del ACP, las variables LRC, AC, LRP y peso, se relacionaron con valores negativos del factor 1, y la variable AltC se relacionó con valores altos del factor 2 (Tabla 3). Lo anterior muestra que el factor 1 se relaciona con el tamaño y masa corporal de los individuos, mientras que el factor 2 sólo se refiere al grosor ventro-dorsal del cuerpo. A su vez, el factor 1 explica la mayor parte de la varianza (81 %), mientras que el factor 2 explica únicamente el 13 % (Tabla 3). Por tanto, las variables relacionadas con el factor 1 son suficientes para explicar la variación del tamaño de los neonatos en el sector Lag_est.
En los diagramas de dispersión de las variables empleadas en el ACP, empleando los valores promedio de los nidos, se observa una relación lineal entre las variables LRC, AC y LRP (del factor 1) y que entre dichas variables los puntos se distribuyen principalmente en los valores intermedios y altos (Fig. 5). En contraste, la AltC con las demás variables muestra una mayor dispersión de los puntos, la cual no evidencia (excepto con el peso) una relación de tipo lineal (Fig. 5).
Características reproductivas
El tamaño promedio de la nidada en Lag_est y en Rehab_EM fueron muy similares, mientras que en Mine_E3 este valor fue más bajo (Tabla 1). En cuanto a los valores máximos, estos fueron similares en los tres sectores, mientras que el mínimo fue más bajo en Mine_E3 (Tabla 1).
El tamaño de la nidada en el sector Lag_est se correlacionó positiva y significativamente con la profundidad (r=0,42, p=0,017) y con el volumen del nido (r=0,45, p=0,022), de modo que nidadas más grandes se encontraron en nidos más profundos y con mayor espacio; con el área de entrada al nido no se correlacionó de forma significativa. En los otros dos sectores, el tamaño de la nidada tampoco tuvo una correlación significativa con las variables de la forma del nido (área de entrada, profundidad y volumen), y tampoco lo fueron las correlaciones entre el tamaño de la nidada y las variables promedio del huevo por nido (largo, ancho y volumen) en los tres sectores.
En el sector Lag_est, el único en donde hubo eclosión, esta ocurrió en 22 de los 30 nidos monitoreados. De estos, seis nidos eclosionaron por completo, mientras que los otros 16 eclosionaron parcialmente. En los ocho nidos que no eclosionaron, cuatro fueron depredados en su totalidad, tres fueron depredados parcialmente y uno sufrió muerte embrionaria en el total de la nidada; en este nido los embriones se encontraban en la fase final de desarrollo, equiparable a la etapa 25 descrita para T. scripta por Greenbaum (2002). De este modo, el éxito de eclosión promedio para los nidos monitoreados (exceptuando los cuatro que sufrieron de depredación total) en el sector Lag_est fue de 56,9 % (DE=37,5 %; n=26). Por otro lado, el éxito de eclosión no se correlacionó significativamente con la distancia al agua, ni con la profundidad, el área de la entrada ni el volumen del nido.
Depredación de nidos
Los depredadores invertebrados que se registraron fueron hormigas, siendo frecuente el género Solenopsis (candelilla, ajímolido) y ocasional el género Labidus (pachaca). Las primeras atacaban masivamente un nido durante varios días (alrededor de una semana); en varios de los nidos, al abrir y retirar los huevos se podía observar que las hormigas llegaban a través de varios canales subterráneos. También era común encontrarlas en los nidos recién puestos o recién eclosionados. Por el contrario, la hormiga Labidus sp., depredaba un nido en tan solo dos o tres días, quizá gracias a su mayor tamaño.
En cuanto a los vertebrados, el de hábito nocturno, que escarbaba los nidos hasta dejarlos totalmente expuestos y sin su forma original, los depredaba totalmente tumbando la malla (por ende debía poseer una fuerza considerable), poseía una cola anillada y se le conocía con el nombre común de "zorro patón", resultó ser el mapache suramericano, Procyon cancrivorus. Esta especie se distribuye en la zona de estudio (a diferencia de P. lotor) y su descripción coincide con los rasgos anteriormente descritos (Morales-Jiménez et al., 2004; Tirira, 2007), además Medem (1975) lo mencionó como uno de los principales depredadores de nidos de hicotea.
El otro depredador vertebrado que fue visto directamente en campo se trató del lobo pollero (Tupinambis teguixin). Su forma de depredar el nido, también observada en campo, era mediante un túnel que cavaba hacia la cavidad del nido y por el cual se introducía e iba sacando uno a uno los huevos y los consumía a corta distancia; una vez que ubicaba el nido, lo continuaba depredando por varios días, a veces hasta consumirlo totalmente; muy similar a lo descrito por Moll y Legler (1971) para el lagarto Ameiva.
A diferencia del sector Lag_est, donde solamente el 31,6 % de los nidos sufrió de depredación total, en los otros dos sectores la pérdida proporcional de nidos por depredación total fue mucho mayor (97,2 % en Mine_E3, y dos de los tres nidos monitoreados en Rehab_EM), y los pocos casos con depredación parcial estuvieron acompañados de muerte embrionaria en los huevos ilesos, particularmente en Mine_ E3, en donde todos los nidos registrados fueron depredados total o parcialmente. Sin embargo, en Lag_est la afectación de los nidos por depredación parcial fue comparativamente mayor (57,9 %, 22 nidos), aunque dicha depredación ocurrió en cinco de estos nidos después de la eclosión (cuatro tuvieron eclosión total y uno eclosión parcial).
El porcentaje de depredación en el nido fue en promedio muy alto en el sector Mine_E3, con un valor de 99,4 % (DE=4,2 %; n=73). Allí, el 89,0 % de los nidos fueron depredados totalmente por P. cancrivorus, el 5,5 % por Solenopsis sp. y el 5,5 % por T. teguixin. En el sector Rehab_EM, los tres nidos monitoreados hasta su destino final alcanzaron un porcentaje de depredación promedio en el nido también alto (95,2 %). De estos, dos nidos fueron depredados por Solenopsis sp., y el otro lo fue por T. teguixin y Solenopsis sp.
En el sector Lag_est, el porcentaje de depredación promedio en el nido fue de 59,5 % (DE=36,2 %; n=38), más bajo que en los otros dos sectores. El 73,7 % y 10,5 % de los nidos fueron depredados entre parcial y totalmente por Solenopsis sp. y por Labidus sp., respectivamente; y el 5,3 % fueron depredados totalmente por P. cancrivorus. Únicamente el 10,5 % de los nidos resultaron ilesos. Por otra parte, las correlaciones entre la distancia al agua y el porcentaje de depredación en el nido en cada uno de los sectores no fueron significativas.
DISCUSIÓN
Temporada de anidación y periodo de incubación
La distribución temporal de la anidación y de la eclosión permitió identificar que abril fue el mes con mayor ocurrencia de ambos fenómenos en el sector Lag_est, lo cual coincidió con las primeras lluvias frecuentes en la región, de acuerdo con los datos del IDEAM (Instituto de Hidrología, Meteorología y Estudios Ambientales) para Valledupar y Riohacha. En particular para la eclosión, algunos autores han señalado que las lluvias son uno de los factores mejor relacionados con la estimulación de los embriones para eclosionar (Moll y Legler, 1971; Correa, 2006; Miler y Dinkelacker, 2008), justificado en que por un lado suaviza la tierra para que las crías puedan salir del nido y por el otro incrementa el nivel del agua, esto referido principalmente a ambientes naturales (en Lag_est el nivel es regulado). Cabe recordar que las primeras lluvias esporádicas en Lag_est ocurrieron en marzo, y en ese momento también inició la eclosión. Los resultados muestran entonces una relación entre la eclosión y la llegada de las lluvias.
Entre los diferentes trabajos donde se ha medido el periodo de incubación en poblaciones de T. c. callirostris (Medem, 1975; Correa, 2006; Restrepo et al., 2007), este último (promedio: 53 días, intervalo: 48 a 62 días), fue el más similar al obtenido en el presente estudio para el sector Lag_est (promedio: 52 días, intervalo: 45 a 60 días). Tal similitud puede deberse a que ambos trabajos se hicieron sobre nidadas in-situ (sin traslado del punto de desove) y protegidas con mallas. Sin embargo, hay una fuerte diferencia a nivel del clima, y es que el 2003 (muestreo de Restrepo et al., 2003) fue un año bajo la influencia de El Niño, mientras que el 2011 lo fue bajo el de La Niña. El periodo de incubación es una variable que puede mostrar variación geográfica debido justamente a las condiciones del lugar (Tucker y Warner, 1999; Correa, 2006). En menor medida, la humedad del nido puede afectar la tasa de desarrollo embrionario, sin embargo su efecto se da en conjunto con la temperatura (Packard et al., 1987; Congdon y Gibbons, 1990; Tucker et al., 1998). Así, esta aparente no variación geográfica del periodo de incubación entre Isla León y Cerrejón requiere evaluarse con estudios adicionales que muestren cómo es la variación local de esta variable, y contrastándola con el microambiente del nido.
Las clasificaciones diseñadas para estimar las fechas de postura y de eclosión a pesar de que permitieron calcular periodos de incubación dentro de los intervalos reportados, deben ser evaluadas con estudios sobre el desarrollo del huevo y del embrión en T. c. callirostris, con el fin de determinar si son apropiadas para continuar siendo usadas en campo.
Zonas de anidación
En las investigaciones acerca de la elección del sitio de anidación en tortugas de agua dulce, las zonas de anidación han tenido principalmente dos perfiles: uno que consiste de vegetación herbácea y suelos de textura arenosa a limosa (Medem, 1975; Congdon y Gibbons, 1990; Wilson, 1998; Bernal et al., 2004; Restrepo et al., 2006), y otro con sitios expuestos o de vegetación rastrera y suelos arenosos (Moll y Legler, 1971; Kolbe y Janzen, 2002; Correa, 2006). El grupo de zonas de anidación característico de Lag_est se asemejó más a este último, con la salvedad de que el diseño de las lagunas y el mantenimiento de las áreas circundantes a estas, contribuye a que su aspecto sea mucho más homogéneo que en los sectores Mine_E3 y Rehab_EM. El otro grupo definido mediante el ACM, pese a caracterizarse por una vegetación arbustiva a arbórea, poseía un sotobosque abierto en el que algunos nidos cercanos a la orilla podían recibir luz solar directa en horas de la mañana o de la tarde, dependiendo de la orilla. Lo interesante de estos resultados es que las hicoteas en Cerrejón habitan y anidan en diferentes ambientes, en particular estos que son de origen antrópico y poseen diferentes calidades de agua, lo cual cabe dentro de lo esperado, pues se sabe que es una especie de hábitats generalistas y que puede incluso encontrarse en zonas contaminadas (Bock et al., 2010).
La elección del sitio de anidación no es un proceso aleatorio en tortugas, así lo han demostrado estudios en especies de agua dulce (Wilson, 1998; Kolbe y Janzen, 2002; Miller y Dinkelacker, 2008), al igual que en T. c. callirostris en Isla León, donde las hembras aparentemente prefirieron anidar en zonas de suelos limosos y asociadas al Jacinto de agua (Eichornia crassipes), pese a estar presentes otras coberturas vegetales (herbáceas, arbustivas y mezcladas) y otros tipos de suelos (seis categorías entre limosos, arenosos y arcillosos) de acuerdo con Restrepo et al., (2006). Aunque en el presente estudio no se evaluó como tal la selección de zonas de anidación, la concentración de nidos en unas zonas particulares de las orillas (las acá denominadas principales zonas de anidación), pudiera ser el reflejo de una selección por parte de las hembras a las condiciones disponibles en cada sector. Quedaría por ver si en estos tres ambientes, diferentes a los naturales, la disponibilidad de zonas de anidación en cada uno es lo suficientemente variada como para que las hembras seleccionen en su mayoría algún tipo en particular, a pesar de ser relativamente homogéneos, como es el caso de Lag_est.
Por otro lado, los resultados obtenidos para la distancia promedio entre el nido y el borde del agua coinciden con los de Restrepo et al., (2006), en los cuales T. c. callirostris anidó principalmente dentro de los cinco primeros metros. Sobre este hecho, se habla de un trade-off entre el riesgo de depredación de la hembra y la supervivencia y el buen desarrollo de las nidadas (Wood y Bjorndal, 2000; Spencer, 2002; Spencer y Thompson, 2003; Restrepo et al., 2006), pero nuestros resultados no permiten extender la discusión hasta ese punto.
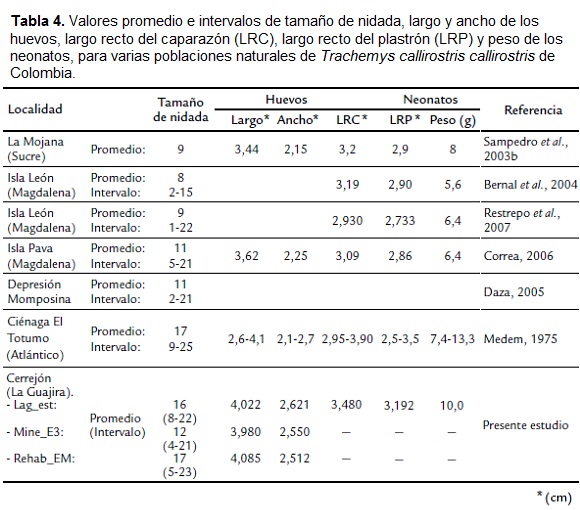
En Lag_est, es claro que los nidos estuvieron sometidos a una exposición más directa de las condiciones de asoleamiento, lluvia y vientos. Las variaciones en las condiciones que esto pudo generar al interior del nido no se determinaron en el presente estudio, pero al parecer fueron lo suficientemente adecuadas para el buen desarrollo embrionario, reflejado indirectamente en las dimensiones de los neonatos, que pueden considerarse grandes si se les compara con los promedios de otras poblaciones (Tabla 4). En el estudio de Correa (2006), esto tampoco pareció ser un limitante para el adecuado desarrollo embrionario.
Características reproductivas, huevos y neonatos
Los tamaños de nidada promedio de cada sector fueron comparativamente mayores a los de otros estudios de poblaciones de T. c. callirostris en Colombia bajo presión de cacería, como La Mojana y varias localidades de la depresión Momposina, excepto el reportado por Medem (1975), el cual coincidió con el promedio máximo observado en este estudio en el sector Rehab_EM (Tabla 4). A nivel de los intervalos las diferencias fueron menores, en particular con el trabajo de Medem (1975), quién reportó nidadas de nueve a 25 huevos (o incluso 30, según se lo señalaron los pobladores).
Dada la relación positiva que existe entre el tamaño de la nidada y el tamaño de la hembra en tortugas, la cual ha sido hallada en varias especies del género Trachemys (Gibbons, 1982; Congdon y Gibbons, 1983; Congdon y Gibbons, 1985; Gibbons y Greene, 1990) y en T. c. callirostris (Bernal et al., 2004; Daza, 2005; Daza y Páez, 2007), los altos valores promedio del tamaño de las nidadas obtenidos en todos los sectores (sobre todo en Lag_est y Rehab_EM), podrían ser un indicio de que las hembras adultas allí poseen tamaños grandes.
Los estudios que han confirmado esta relación en T. c. callirostris han sido realizados en poblaciones bajo diferentes niveles de cacería, enfocada en la extracción de hembras adultas (Bernal et al., 2004; Daza, 2005; Daza y Páez, 2007). La conclusión general de estos trabajos ha sido que en estas zonas, el tamaño de las hembras se ve afectado tanto por las diferencias en las características del hábitat, como por los niveles de cacería, evidenciando una disminución en los tamaños promedio de las hembras, y en consecuencia también en el tamaño de las nidadas, especialmente en las zonas secas con altos niveles de cosecha (Bock et al., 2010). Por tanto, es probable que los niveles bajos de cacería dentro de la mina estén permitiendo la presencia de estas supuestas hembras grandes en los sectores. Sin embargo, esta hipótesis necesita ser corroborada con la medición directa de los individuos juveniles y adultos, así como evaluar las características del hábitat (e.g. productividad) y su influencia en el tamaño y crecimiento de los individuos, en aras de elucidar la dinámica poblacional de la hicotea dentro de estos ambientes.
Por otra parte, la correlación positiva entre el tamaño de la nidada y la profundidad y el volumen del nido en Lag_est, podría significar que las hembras emplearon la profundidad como guía para reconocer si la cavidad del nido era la adecuada para el número de huevos a depositar. Empero, ninguna de estas dos variables habría tenido mayor incidencia en el éxito de eclosión.
Sin embargo, se ha observado en otras especies de tortugas una relación positiva entre el tamaño de la hembra y la profundidad del nido, básicamente porque extremidades más largas pueden ahondar más en el terreno (Wilson, 1998; Valenzuela, 2001; Ferreira y Castro, 2003; Correa 2006), y la hicotea, como muchas otras tortugas, excava el nido con sus patas traseras (Medem, 1975). Lo anterior podría estar aportando una evidencia indirecta más de que las hembras anidantes en los sectores estudiados poseen tamaños relativamente grandes. Al respecto, los tamaños de nidada promedio más altos y similares que fueron obtenidos en Lag_est y Rehab_EM (16 y 17, respectivamente), tuvieron también profundidades promedio casi iguales (12,1 y 12,7 cm, respectivamente); mientras que en Mine_E3 el resultado pareciera contradecir el presente argumento, pues contó con la mayor profundidad promedio pero el menor tamaño de nidada promedio de los tres sectores. Esta relación debe tomarse como un artefacto, puesto que los tamaños de muestra con los que se promediaron ambas variables en este sector fueron muy disímiles (siete y 38 nidos, respectivamente), debido a que allí la mayoría de los nidos fueron depredados por P. cancrivorus, el cual (como ya se mencionó) dañaba por completo el nido al depredarlo y por tanto las variables de forma no podían ser tomadas. En comparación con otros estudios de T. c. callirostris en Colombia, los valores promedios de la profundidad del presente estudio, excepto el de Mine_E3, estarían entre los obtenidos por Medem, 1975 (11,6 cm); Sampedro et al., 2003 (11,4 cm) y Correa, 2006 (13,0 cm), lo que podría indicar una baja variación geográfica, e incluso temporal, en las regiones estudiadas.
El tamaño de los huevos en los tres sectores también fue comparativamente mayor que lo reportado para otras zonas del Caribe colombiano, en términos del largo y ancho promedio (Tabla 4) y de los intervalos dentro de los que se observó la mayor agrupación de estas variables promedio por nido (véase Fig. 4). De haberse encontrado una relación entre estas últimas y el tamaño de la nidada, se habría contado con una evidencia para apoyar la hipótesis de la presencia de hembras adultas grandes en los sectores de estudio. Lo anterior a través de la relación entre el ancho del huevo y el tamaño de la hembra, la cual se ha encontrado, con menos frecuencia que la relación tamaño de nidada-tamaño de la hembra, en T. scripta (Congdon y Gibbons, 1990; Mitchell y Pague, 1990) y en otras especies dulceacuícolas (Congdon y Gibbons, 1990) como T. venusta (Vogt, 1990).
En los neonatos de Lag_est, las variables morfométricas y el peso fueron las que mejor explicaron su tamaño y masa corporal, y cuyos valores fueron superiores a los obtenidos en otros estudios con T. c. callirostris (Tabla 4). Esto podría ser un buen indicio para la subpoblación de Lag_est, debido a que el tamaño grande en las crías de tortugas ha demostrado ser clave para su supervivencia en los primeros estadios (Janzen et al., 2000a; Janzen et al., 2000b; Myers et al., 2007). Estudios en T. scripta elegans han demostrado que los neonatos con mayor tamaño, tienen mayor probabilidad de llegar por primera vez al agua después de salir del nido, gracias a que poseen más agilidad y por tanto logran evadir mejor a los depredadores en tierra (Janzen et al., 2000a; Myers et al., 2007).
Algo que también se ha demostrado ampliamente es que una buena humedad en el nido permite que el embrión absorba mejor las reservas del vitelo, y por ende alcance un mayor tamaño (Congdon y Gibbons, 1990; Tucker et al., 1998). Con base en esto, se puede suponer que los neonatos, considerablemente grandes de Lag_est, contaron con un microambiente de los nidos óptimo para el buen desarrollo. Para complementar esta hipótesis, se recomienda estudiar la inversión parental (cantidad de energía asignada a cada cría; Marlen y Fischer, 1999) junto con las variables microambientales del nido, con el fin de evaluar cómo interactúan estos factores en la supervivencia de los neonatos.
El éxito de eclosión promedio en Lag_est (56,9 %) resultó ser de los más altos registrados para T. c. callirostris en Colombia. Diferentes estudios en ciénagas de la depresión Momposina, en los que se ha determinado el éxito de eclosión con el mismo método (misma temporada de anidación, búsqueda de nidos por recorridos y protección de nidos con mallas), han obtenido diferentes valores: 56 % en Isla León en el 2003 (Restrepo et al., 2007), 30,9 % en Isla Pava en el 2005 (Correa, 2006) y 13,4 % también en Isla León en el 2000 (aunque este no empleó mallas; Bernal et al., 2004). Estos resultados reflejan la variación temporal que tiene el éxito de eclosión en esa zona, el cual no solamente ha obedecido a la pérdida de nidadas por depredación natural y humana, sino al efecto de la temperatura del nido en el desarrollo embrionario y a la efectividad de las mallas para proteger los nidos (Correa, 2006; Restrepo et al., 2007).
Como complemento a lo anterior, y con el fin de explorar el efecto de las condiciones físicas del nido, se evaluó la relación entre el éxito de eclosión y las variables de la forma del nido (área de entrada, profundidad y volumen), las cuales no fueron significativas, indicando que estas no tuvieron efecto sobre el desarrollo embrionario en los nidos del sector Lag_est. Por tanto, el microambiente de los nidos habría desempeñado el papel principal en el óptimo desarrollo de los huevos en Lag_est. Esto no sería de extrañar, dada la importancia que tienen la humedad y la temperatura en el desarrollo y determinación sexual de los embriones en tortugas (Bull, 1980; Packard et al., 1987; Congdon y Gibbons, 1990; Cagle et al., 1993; Tucker et al., 1998; Pieau et al., 1999; Valenzuela, 2001, Janzen y Phillips, 2006; Correa-H et al., 2010), y que también ha sido observado en T. c. callirostris (Restrepo et al., 2007) y T. scripta (Congdon y Gibbons, 1990).
En el sector Lag_est no hay manera de discutir el efecto que tuvo la temperatura del nido en el desarrollo de los embriones, puesto que no se midió esta variable. La profundidad del nido tampoco se relacionó con el éxito de eclosión, pero se sabe que esta variable juega un papel importante en el desarrollo embrionario, pues puede por un lado afectar el periodo de incubación (Ferreira y Castro, 2003) o determinar, en conjunto con la posición espacial del huevo dentro del nido, el microambiente para los huevos; de modo que no son iguales las condiciones para aquellos que están en la parte superior, ni para aquellos que están en el centro o en la base del nido, ya sea somero o más profundo (Congdon y Gibbons, 1990; Wilson, 1998).
Depredación de nidos
Las mallas empleadas para la protección de los nidos no fueron una barrera importante contra los depredadores en ninguno de los tres sectores. Tanto P. cancrivorus como T. teguixin atacaron los nidos, ya fuera dañando o levantando la malla (el primero), o cavando un túnel desde fuera para alcanzar el nido (el segundo), y las hormigas por su tamaño pudieron llegar a la mayoría de los nidos atravesando la malla o forrajeando bajo suelo.
En Lag_est la mayoría de los nidos monitoreados fueron depredados por la hormiga Solenopsis sp., solo de manera parcial (16 nidos); en estos nidos, al parecer no se afectó la viabilidad de los huevos sobrevivientes, pues la mayoría eclosionó (14 nidos), diferente a lo ocurrido con los nidos atacados por Labidus sp. y P. cancrivorus, los cuales los depredaban totalmente y en menor tiempo que Solenopsis sp. Es probable que esto se debiera al hecho de que las hormigas no alteraron la superficie de los nidos que depredaron, puesto que su acción se dio bajo tierra (observación de campo) y por tanto el microambiente no se habría alterado de forma tal que permitió el desarrollo embrionario de los huevos que salieron ilesos del ataque previo.
Sin embargo, lo anterior podría haber sido diferente si no se hubiera presentado simultáneamente otro factor que pudo haber influido de manera importante en la protección de los nidos (incluso más que las mallas), y por ende favoreció el éxito de eclosión. Se trata de la numerosa presencia de babillas (Caiman crocodilus fuscus) en el sector Lag_est, la cual pudiera haber actuado como ahuyentador de P. cancrivorus de las zonas centrales de las lagunas, en donde se asoleaban las babillas y a su vez se hallaban la mayor cantidad de nidos del sector.
Lo anterior contrastó con la situación que se presentó en Mine_E3, donde P. cancrivorus depredó totalmente el 89,0 % de los nidos. Como se mencionó antes, en este sector la vegetación es diferente (con presencia de hierbas hasta árboles) y no era común encontrar a las babillas asoleándose a lo largo de la orilla del embalse. Evidentemente, la vegetación puede ofrecer un mejor camuflaje a los nidos que en Lag_est, pero no basta con eso para minimizar la depredación. Los depredadores vertebrados, como mapaches (Procyon sp.), lagartos y armadillos, se valen principalmente del olfato para localizar los nidos de tortugas, especialmente por el olor proveniente de los fluidos de la madre al momento de la postura, como se evidenció en nidos de Chelydra serpentina en Michigan (EE. UU.) con Procyon lotor y Vulpes fulva (Congdon et al., 1987) y de T. venusta en Panamá con Ameiva ameiva y Dasypus novemcinctus (Moll y Legler, 1971). Tanto P. cancrivorus como T. teguixin prácticamente arrasaron con el total de los nidos del periodo de anidación del 2011 en Mine_E3.
En ambientes naturales de la depresión Momposina, las tasas de depredación registradas para T. c. callirostris han sido variables; en Isla Pava fueron altas (83 % por vertebrados y 48 % por invertebrados y hongos) Correa (2006), mientras que en Isla León fueron relativamente bajas en dos años diferentes (Bernal et al., 2004; Restrepo et al., 2007). En estos últimos, las tasas de depredación de nidos por invertebrados fueron de 32 % en 2000 y 13,8 % en 2003, mientras que por vertebrados fueron de 24 % en ambos años (Bernal et al., 2004; Restrepo et al., 2007). Sin embargo, la tendencia general en otras especies dulceacuícolas ha sido que las tasas de depredación por lo general son mucho mayores, prácticamente de 100 %. En Pseudemys floridana y T. scripta por ejemplo, se registró una tasa de depredación de 98 % (Aresco, 2004), y en T. venusta de 84,8 % (Moll y Legler, 1971). Los resultados de nuestro estudio se asemejaron más a esta última tendencia, con el total de los nidos depredados total o parcialmente en Mine_E3, 89,5 % en Lag_est y 60 % en Rehab_EM; siguiendo esta tendencia, es probable que los nidos que allí quedaron aislados también hayan sido depredados en alguna medida.
CONCLUSIONES
La temporada de anidación y el periodo de incubación medidos se encuentran dentro de los valores reportados para la especie en Colombia. Es importante que se ponga a prueba el método empleado aquí para estimar las fechas de postura y de eclosión, para en tal caso ajustarlo y validar su uso. Las zonas de anidación descritas comparten características con lo hallado para T. c. callirostris y otras especies dulceacuícolas, a nivel de la vegetación y el tipo de suelos. Sin embargo, las diferencias están circunscritas a que en este estudio se trabajó en ambientes de origen antrópico, los cuales la hicotea tolera, más se desconoce la viabilidad de estas agregaciones en dichos ambientes. Las características de los nidos, huevos, neonatos y el éxito de eclosión, muestran en general valores mayores a los promedios reportados para poblaciones de otras zonas de Colombia, lo cual sugiere la posibilidad de que las hembras anidantes en Cerrejón posean tamaños superiores como consecuencia de los bajos niveles de cacería en la mina.
AGRADECIMIENTOS
Agradecemos a la Universidad Nacional de Colombia, Cerrejón, y Colciencias con el Programa Jóvenes Investigadores e Innovadores año 2010 por la financiación de este proyecto, a Lina Báez de la Dirección de Gestión Ambiental de Cerrejón por su fundamental apoyo en la gestión y la ejecución de este trabajo, al Grupo Biología de Organismos Tropicales por su apoyo a la investigación, a Luz Mery González, Ivón Sepúlveda y Fernanda Parra del servicio de Consultoría Estadística de la Universidad Nacional de Colombia y a Eliana Martínez por su asesoría en estadística, a Claudia Ortíz por su ayuda en la determinación del material entomológico, a Jonis Ospino, Alfredo Salgado, Pedro Castillo y José Chivará por su colaboración en el trabajo de campo. La investigación se enmarcó en el programa de fauna de la Dirección de Gestión Ambiental del Cerrejón y se declara que no existen conflicto de interes.
ANEXOS
BIBLIOGRAFÍA
Aresco MJ. Reproductive ecology of Pseudemys floridana and Trachemys scripta (Testudines: Emydidae) in Northwestern Florida. J Herpetol. 2004;38(2):249-256. DOI: https://doi.org/10.1670/169-03A
Báez L, Diazgranados MC. Las tortugas marinas de La Guajira. Bogotá, D.C.: Cerrejón, Conservación Internacional; 2010. p. 17.
Bernal M, Daza JM, Páez V. Ecología reproductiva y cacería de la tortuga Trachemys scripta (Testudinata: Emydidae), en el área de la Depresión Momposina, norte de Colombia. Rev Biol Trop. 2004;52(1):229-238.
Bock BC, Páez VP, Daza JM. Trachemys callirostris (Gray 1856)– Colombian slider, jicotea, hicotea, galapago, morrocoy de agua. Chelon Res Monogr. 2010;5:042.1-042.9.DOI: 10.3854/crm.5.042.callirostris.v1.2010
Bull JJ. Sex determination in reptiles. Q Rev Biol. 1980;55(1):3-21.
Cagle KD, Packard GC, Miller K, Packard MJ. Effects of the microclimate in natural nests on development of embryonic painted turtles, Chrysemys picta. Funct Ecol. 1993;7(6):653-660. DOI: 10.2307/2390185
Casanova M, Vera W, Leighton WL, Salazar O. Edafología. Guía de clases prácticas. Universidad de Chile, Facultad de Ciencias Agronómicas, Departamento de Ingeniería y Suelos; 2004. p. 24-28.
Castaño-Mora OV. Libro rojo de los reptiles amenazados de Colombia. Bogotá, D.C.: Instituto de Ciencias Naturales, Universidad Nacional de Colombia; 2002.p. 118-119.
Congdon JD, Gibbons JW. Relationships of reproductive characteristics to body size in Pseudemys scripta. Herpetologica. 1983;39(2):147-151.
Congdon JD, Gibbons JW. Egg Components and Reproductive Characteristics of Turtles: Relationships to Body Size. Herpetologica. 1985;41(2):194-205.
Congdon JD, Gibbons JW. Turtle eggs: Their ecology and evolution. In: Gibbons W, editor. Life history and ecology of the slider turtle. Washington, D.C.: Smithsonian Institution Press; 1990. p. 109-123.
Congdon JD, Breitenbach GL, Van Loben-Sels RC, Tinkle DW. Reproduction and nesting ecology of snapping turtles (Chelydra serpentina) in southeastern Michigan. Herpetologica. 1987;43(1):39-54.
Correa JC. Ecología reproductiva de las tortugas Podocnemis lewyana (Podocnemidae) y Trachemys callirostris callirostris (Emydidae) en Isla Pava, Ciénaga La Rinconada, Depresión Momposina, Colombia (tesis de pregrado). Medellín: Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia; 2006. p. 99.
Correa-H JC, Cano-Castaño AM, Páez VP, Restrepo A. Reproductive Ecology of the Magdalena River Turtle (Podocnemis lewyana) in the Mompos Depression, Colombia. Chelonian Conserv Biol. 2010;9(1):70–78. DOI: https://doi.org/10.2744/CCB-0784.1
Daza JM. Variación morfométrica y su relación con el potencial reproductivo en siete subpoblaciones de Trachemys callirostris callirostris (Testudines: Emydidae) en la Depresión Momposina, Norte de Colombia (tesis de maestría). Medellín: Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia; 2005.p. 66.
Daza JM, Páez V. Morphometric variation and its effect on reproductive potential in female Colombian slider turtles (Trachemys callirostris callirostris). Herpetologica. 2007;63(2):125-134. DOI: https://doi.org/10.1655/0018-0831(2007)63[125:MVAIEO]2.0.CO;2
Ferreira PD, Castro PTA. Geological control of Podocnemis expansa and Podocnemis unifilis nesting areas in Rio Javaés, Bananal Island, Brazil. Acta Amaz. 2003;33(3):445-468.DOI: https://doi.org/10.1590/S0044-59672003000300010
Fritz U, Stuckas H, Vargas-Ramírez M, Hundsdörfer AK, Maran J, Päckert M. Molecular phylogeny of Central and South American slider turtles: implications for biogeography and systematics (Testudines: Emydidae: Trachemys). J Zoolog Syst Evol Res. 2012;50(2):125-136. DOI:10.1111/j.1439-0469.2011.00647.x
Fuentes S, Sampedro A, Ardila M. Importancia de la jicotea (Trachemys scripta callirostris: Chelonia, Emydidae) como recurso natural en la comunidad de isla del Coco, región de la Mojana, departamento de Sucre, Colombia. Revista Biología. 2003;17(2):126-133.
Gibbons JW. Reproductive patterns in freshwater turtles. Herpetologica.1982;38(1):222-227.
Gibbons JW. The slider turtle. In: Gibbons W, editor. Life history and ecology of the slider turtle. Washington, D.C.: Smithsonian Institution Press; 1990. p. 3-18.
Gibbons JW, Greene JL. Reproduction in the slider and other species of turtles. In: Gibbons W, editor. Life history and ecology of the slider turtle. Washington, D.C.: Smithsonian Institution Press; 1990. p. 124-134
Gibbons W, Semlitsch RD. Survivorship and longevity of a long-lived vertebrate species: How long do turtles live?. J Anim Ecol. 1982;51(2):523-527.
Greenbaum E. A standardized series of embryonic stages for the emydid turtle Trachemys scripta. Can J Zool. 2002;80:1350-1370. DOI: 10.1139/z02-111
Gualdrón, R. Cerrejón. Hacia la Rehabilitación de las tierras intervenidas por la minería a cielo abierto. Colombia: Editorial Panamericana Formas e Impresos; 2011.p. 26-189.
Guisande GC, Felpeto BA, Maneiro EI, Alarcón RI, Vergara CA, Vaamonde LA. Tratamiento de datos. España: Ediciones Díaz de Santos; 2006. p. 235-274.
Jaramillo A, Villamizar-M V, Calvo J, Rangel-Ch JO, Parra LN. Los sedimentos de las ciénagas El Congo, Musanda, Doña María, El Sordo, Juncal, Baquero, Morales y Costilla. In: Rangel-Ch JO, editor. Colombia Diversidad Biótica XIII. Complejo cenagoso Zapatosa y ciénagas del Sur del Cesar. Bogotá, Colombia: Instituto de Ciencias Naturales, Universidad Nacional de Colombia; 2013. p. 55-84.
Janzen FJ, Phillips PC. Exploring the evolution of environmental sex determination, especially in reptiles. J Evolution Biol. 2006;19(6):1775-1784. DOI: 10.1111/j.1420-9101.2006.01138.x
Janzen F, Tucker JK, Paukstis G. Experimental analysis of an early life-history stage: avian predation selects for larger body size of hatchling turtles. J Evolution Biol. 2000a;13:947-954. DOI: 10.1046/j.1420-9101.2000.00234.x
Janzen F, Tucker JK, Paukstis G. Experimental analysis of an early life-history stage: selection on size of hatchling turtles. Ecology. 2000b;81(8):2290-2304. DOI: https://doi.org/10.1890/0012-9658(2000)081[2290:EAOAEL]2.0.CO;2
Kolbe JJ, Janzen FJ. Impact of nest-site selection on nest success and nest temperature in natural and disturbed habitats. Ecology. 2002;83(1):269-281. DOI: https://doi.org/10.1890/0012-9658(2002)083[0269:IONSSO]2.0.CO;2
Marlen MD, Fischer R. Parental investment in the red-eared slider turtle, Trachemys scripta elegans. J Herpetol. 1999;33(2):306-309.
Medem F. La reproducción de la "icotea" (Pseudemys scripta callirostris), (Testudines: Emydidae). Caldasia. 1975;11:83-101.
Miller JD. Determinación del tamaño de la nidada y el éxito de eclosión. En: Eckert KL, Bjorndal KA, Abreu-Grobois FA, Donnelly M, editores. Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. Grupo Especialista en Tortugas Marinas UICN/CSE, Publicación No. 4. Blanchard, Pennsylvania: Consolidated Graphic Communications; 2000. p. 143-149.
Miller JD, Dinkelacker AP. Reproductive structures and strategies of turtles. In: Wyneken J, Godfrey MH, Bels V. Biology of Turtles. USA: CRC Press; 2008. p. 225-278.
Ministerio de Ambiente, Vivienda y Desarrollo Territorial (MAVDT), Universidad Nacional de Colombia (UN). Plan de Manejo orientado al uso sostenible de la tortuga hicotea en Colombia. Bogotá, D.C.: Ministerio de Ambiente, Vivienda y Desarrollo Territorial-Universidad Nacional de Colombia; 2009. p. 76.
Mitchell JC, Pague CA. Body size, reproductive variation, and growth in the slider turtle at the Northeastern edge of its range. In: Gibbons W, editor. Life history and ecology of the slider turtle. Washington, D.C.: Smithsonian Institution Press; 1990. p. 146-151.
Moll EO, Legler JM. The life history of a neotropical slider turtle, Pseudemys scripta (Schoepff), in Panamá. Bulletin of the Los Angeles County Museum of Natural History, Science. 1971;11:1-102.
Morales-Jiménez AL, Sánchez F, Poveda K, Cadena A. Mamíferos terrestres y voladores de Colombia, Guía de Campo. Bogotá, D.C.: Ramos López Editorial; 2004. p. 78-100.
Myers EM, Tucker JK, Chandler CH. Experimental analysis of body size and shape during critical life-history events of hatchling slider turtles, Trachemys scripta elegans. Func Ecol. 2007;21(6):1106-1114. DOI: 10.1111/j.1365-2435.2007.01337.x
Packard GC, Packard MJ, Miller K, Boardman TJ. Influence of moisture, temperature, and substrate on snapping turtle eggs and embryos. Ecology. 1987;68(4):983-993. DOI: https://doi.org/10.2307/1938369
Palacio EE, Fernández F. Clave para las subfamilias y géneros. En: Fernández F, editor. Introducción a las hormigas de la región Neotropical. Bogotá, Colombia: Instituto de Investigación de Recursos Biológicos Alexander von Humboldt; 2003. p. 233-260.
Pieau C, Dorizzi M, Richard-Mercier N. Temperature-dependent sex determination and gonadal differentiation in reptiles. Cell Mol Life Sci. 1999;55:887-900. DOI: 10.1007/s000180050342
Rangel-Ch JO, Velázquez A. Métodos de estudio de la vegetación. En: Rangel-Ch JO, editor. Colombia Diversidad Biótica II. Tipos de vegetación en Colombia. Bogotá, Colombia: Editorial Guadalupe Ltda.; 1997. p. 59-87.
Restrepo A, Piñeros VJ, Páez VP. Nest site selection by Colombian slider turtles, Trachemys callirostris callirostris (Testudines: Emydidae), in the Mompos Depression, Colombia. Chelonian Conserv Biol. 2006;5(2):249–254. DOI: https://doi.org/10.2744/1071-8443(2006)5[249:NSSBCS]2.0.CO;2
Restrepo A, Piñeros VJ, Páez VP. Características reproductivas de la tortuga Trachemys callirostris callirostris (Testudinata: Emydidae) en Isla León, depresión momposina, Colombia. Caldasia. 2007;29(2):283-295.
Rueda-Almonacid JV, Carr JL, Mittermeier RA, Rodríguez-Mahecha JV, Mast RB, Vogt RC, et al. Las tortugas y los cocodrilianos de los países andinos del trópico. Serie de guías tropicales de campo No. 6. Conservación Internacional. Bogotá, Colombia: Editorial Panamericana Formas e Impresos; 2007. p. 79-106, 271-284.
Sampedro A, Ardila M, Fuentes S. Aspectos de la morfometría de la jicotea Colombiana (Trachemys scripta callirostris: Chelonia, Emydidae) y sus posibles ventajas para la supervivencia. Revista Biología. 2003a;17(2):114-119.
Sampedro A, Ardila M, Fuentes S. Datos sobre la reproducción de la jicotea (Trachemys scripta callirostris: Chelonia, Emydidae) en la subregión de la Mojana, departamento de Sucre, Colombia. Revista Biología. 2003b;17(2):120-125.
Seidel M. Taxonomic observations on extant species and subspecies of slider turtles, genus Trachemys. J Herpetol. 2002;36(2):285-292. DOI:10.1670/0022-1511(2002)036[0285:TOOESA]2.0.CO;2
Spencer R-J. Experimentally testing nest site selection: fitness trade-offs and predation risk in turtles. Ecology. 2002;83(8):2136-2144. DOI: https://doi.org/10.1890/0012-9658(2002)083[2136:ETNSSF]2.0.CO;2
Spencer R-J, Thompson MB. The significance of predation in nest site selection of turtles: An experimental consideration of macro and microhabitat preferences. Oikos. 2003;102(3):592-600. DOI: 10.1034/j.1600-0706.2003.12436.x
Statsoft, Inc. Statistica (Data analysis software system), version 7; 2004.
Tirira D. Guía de campo de los mamíferos del Ecuador, Publicación especial sobre los mamíferos del Ecuador 6. Ediciones Murciélago Blanco. Quito, Ecuador; 2007. p. 576.
Tucker J, Filoramo N, Paukstis GL, Janzen FJ. Response of red-eared slider, Trachemys scripta elegans, eggs to slightly differing water potentials. J Herpetol. 1998;32(1):124-128.DOI: 10.2307/1565492
Tucker JK, Warner DA. Microgeographic Variation in Response of Red-eared Slider (Trachemys scripta elegans) Embryos to Similar Incubation Environments. J Herpetol. 1999;33(4):549-557. DOI: 10.2307/1565571
Turtle Taxonomy Working Group (TTWG) (Van Dijk PP, Iverson JB, Shaffer HB, Bour R, Rhodin AGJ). Turtles of the world, 2011 update: Annotated checklist of taxonomy, synonymy, distribution, and conservation status. En: Rhodin AGJ, Pritchard PCH, van Dick PP, Saumure RA, Buhlmann KA, Iverson JB, Mittermeier RA, editors. Conservation Biology of freshwater turtles and tortoises: A compilation project of the UICN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs No. 5. Chelonian Research Foundation; 2011. p. 000.165-000.242.DOI: 10.3854/crm.5.000.checlist.v4.2011
Valenzuela N. Constant, shift, and natural temperature effects on sex determination in Podocnemis expansa turtles. Ecology. 2001;82(11):3010-3024. DOI: https://doi.org/10.1890/0012-9658(2001)082[3010:CSANTE]2.0.CO;2
Vogt RC. Reproductive parameters of Trachemys scripta venusta in Southern Mexico. In: Gibbons W, editor. Life history and ecology of the slider turtle. Washington, D.C.: Smithsonian Institution Press; 1990. p. 162-168.
Wilson DS. Nest-site selection: microhabitat variation and its effects on the survival of turtle embryos. Ecology. 1998;79(6):1884-1892. DOI: https://doi.org/10.1890/0012-9658(1998)079[1884:NSSMVA]2.0.CO;2
Wood DW, Bjorndal KA. Relation of temperature, moisture, salinity, and slope to nest site selection in loggerhead sea turtles. Copeia. 2000;1:119–128. DOI: https://doi.org/10.1643/0045-8511(2000)2000[0119:ROTMSA]2.0.CO;2
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. German Forero-Medina, Vivian P. Páez, Mario F. Garcés-Restrepo, John L. Carr, Alan Giraldo, Mario Vargas-Ramírez. (2016). Research and Conservation Priorities for Tortoises and Freshwater Turtles of Colombia. Tropical Conservation Science, 9(4), p.194008291667370. https://doi.org/10.1177/1940082916673708.
2. Arango-Lozano Julián, Patiño-Siro Dahian, Toro-Cardona Felipe. (2023). Reaching new environments through illegal trade: evidence of a widely traded turtle in Colombia. Aquatic Ecology, 57(2), p.471. https://doi.org/10.1007/s10452-023-10023-z.
3. Gustavo Andrés López-Martínez, Jorge Iván Rondón-Zabala, Eduardo Martínez-Parales, Rosa Helena Moya-Arévalo, Oscar Andrés Rodríguez. (2020). DEPREDACION POR INSECTOS DE NIDOS Y NEONATOS PROTEGIDOS DE PODOCNEMIS VOGLI (SABANAS INUNDABLES DEL CASANARE).. Acta Biológica Colombiana, 25(3), p.354. https://doi.org/10.15446/abc.v25n3.80441.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2014 Acta Biológica Colombiana

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
1. La aceptación de manuscritos por parte de la revista implicará, además de su edición electrónica de acceso abierto bajo licencia Attribution-NonCommercial-ShareAlike 4.0 (CC BY NC SA), la inclusión y difusión del texto completo a través del repositorio institucional de la Universidad Nacional de Colombia y en todas aquellas bases de datos especializadas que el editor considere adecuadas para su indización con miras a incrementar la visibilidad de la revista.
2. Acta Biológica Colombiana permite a los autores archivar, descargar y compartir, la versión final publicada, así como las versiones pre-print y post-print incluyendo un encabezado con la referencia bibliográfica del articulo publicado.
3. Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
4. Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos institucionales, en su página web o en redes sociales cientificas como Academia, Researchgate; Mendelay) lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).