Estimación del riesgo de contaminación de fuentes hídricas de pesticidas (Mancozeb y Carbofuran) en Ventaquemada, Boyacá - Colombia
Risk estimate of water sources contamination of pesticides (Mancozeb and Carbofuran) in Ventaquemada, Boyacá – Colombia
DOI:
https://doi.org/10.15446/acag.v65n4.50325Palabras clave:
Impacto ambiental, residualidad, detección y cuantificación, voltametría diferencial de pulso (VDP), reactivos. (es)Environmental impact, residuality, detection and quantification, differential pulse voltammetry (DPV), reagents (en)
El uso indiscriminado de plaguicidas en los cultivos, genera un impacto ambiental negativo que afecta a los organismos vivos, al suelo y al recurso hídrico, éste último esencial para la vida. Por lo tanto, es necesario evaluar la residualidad de este tipo de sustancias en fuentes de agua que sirven como abastecimiento a la comunidad, los animales y en labores agrícolas. Con base en lo anterior, se plantea una metodología electroquímicamente sencilla, confiable, asequible y amigable con el medio ambiente, para la cuantificación de Mancozeb y Carbofurano en fuentes hídricas. El estudio fue realizado usando como electrolito de soporte, solución buffer Britton-Robinson; electrodo de trabajo de carbón vítreo, Ag/AgCl como electrodo de referencia y platino como electrodo auxiliar. Se validaron los métodos de voltametría diferencial de pulso (VDP) para ambos compuestos, los cuales presentaron un potencial de -590 y 445mV, respectivamente. La linealidad de los métodos, presentó un coeficiente de correlación de 0.9948 y 0.9962, los límites de detección y cuantificación fueron de 0.0003 y 0.5 mg/L para Mancozeb y 0.0002 y 0.4 mg/L para Carbofurano. La recuperación estuvo entre un 85 y 96% con una desviación estándar relativa por debajo del 10%. Se evaluaron 25 muestras de agua provenientes de fuentes hídricas ubicadas en la zona norte del Municipio de Ventaquemada, Boyacá- Colombia, donde hay una alta producción agrícola, especialmente de los cultivos de papa y zanahoria. De las muestras analizadas, el Mancozeb no se detectó en 16 muestras, pero en el resto de ellas, sobrepasó la normatividad vigente. En cuanto al Carbofurano, se descubrió en 22 muestras, lo que indica que estos compuestos están afectando el recurso hídrico y sugiere que se deben tomar medidas correctivas y preventivas para reducir el impacto ambiental de los plaguicidas en esta región.
Estimación del riesgo de contaminación de fuentes hídricas de pesticidas (Mancozeb y Carbofuran) en Ventaquemada, Boyacá – Colombia
Risk estimate of water sources contamination of pesticides (Mancozeb and Carbofuran) in Ventaquemada, Boyacá – Colombia
William Roberto Alza Camacho, José Mauricio García Colmenares y Sandra Patricia Chaparro Acuña*
Escuela de Ciencias Químicas. Facultad de Ciencias. Universidad Pedagógica y Tecnológica de Colombia. Tunja, Boyacá– Colombia. *Autora para correspondencia: patricia.chaparro@uptc.edu.co
Rec.:30.04.2015 Acep.:30.07.2015
Resumen
El uso indiscriminado de plaguicidas en los cultivos, genera un impacto ambiental negativo que afecta a los organismos vivos, al suelo y al recurso hídrico, éste último esencial para la vida. Por lo tanto, es necesario evaluar la residualidad de este tipo de sustancias en fuentes de agua que sirven como abastecimiento a la comunidad, los animales y en labores agrícolas. Con base en lo anterior, se plantea una metodología electroquímicamente sencilla, confiable, asequible y amigable con el medio ambiente, para la cuantificación de Mancozeb y Carbofurano en fuentes hídricas. El estudio fue realizado usando como electrolito de soporte, solución buffer Britton–Robinson; electrodo de trabajo de carbón vítreo, Ag/AgCl como electrodo de referencia y platino como electrodo auxiliar. Se validaron los métodos de voltametría diferencial de pulso (VDP) para ambos compuestos, los cuales presentaron un potencial de –590 y 445mV, respectivamente. La linealidad de los métodos, presentó un coeficiente de correlación de 0.9948 y 0.9962, los límites de detección y cuantificación fueron de 0.0003 y 0.5 mg/L para Mancozeb y 0.0002 y 0.4 mg/L para Carbofurano. La recuperación estuvo entre un 85 y 96% con una desviación estándar relativa por debajo del 10%. Se evaluaron 25 muestras de agua provenientes de fuentes hídricas ubicadas en la zona norte del Municipio de Ventaquemada, Boyacá– Colombia, donde hay una alta producción agrícola, especialmente de los cultivos de papa y zanahoria. De las muestras analizadas, el Mancozeb no se detectó en 16 muestras, pero en el resto de ellas, sobrepasó la normatividad vigente. En cuanto al Carbofurano, se descubrió en 22 muestras, lo que indica que estos compuestos están afectando el recurso hídrico y sugiere que se deben tomar medidas correctivas y preventivas para reducir el impacto ambiental de los plaguicidas en esta región.
Palabras clave: Impacto ambiental, residualidad, detección y cuantificación, voltametría diferencial de pulso (VDP), reactivos.
Abstract
The extensive use of pesticides on crops generates a negative environmental impact that affects soil and water resources. It is necessary to evaluate residual quantities of these substances in water sources that is used by people, animals and agriculture. A simple, reliable and environmentally friendly methodology was developed for the determination of Mancozeb and Carbofuran in water. It was used Britton–Robinson buffer solution as supporting electrolyte, glassy carbon as working electrode, Ag /AgCl as reference electrode and platinum auxiliary electrode. Differential pulse voltammetry (VDP) methods were validated for mancozeb and Carbofuran, which presented a potential of –590 and 445mV, respectively. Linearity presented a correlation coefficient of 0.9948 and 0.9962, detection and quantification limits were 0.0003 and 0.5 mg/L to Mancozeb, 0.0002 and 0.4 mg/L for Carbofuran, and the recoveries were within 85 and 96% (RSD <10%). The voltametry and UV–vis method comparison showed that electrochemical quantification was better. The method was satisfactorily applied for analysis of water samples (25) from Ventaquemada, Boyacá – Colombia, where there is a high agricultural production, especially potato and carrot crops. Mancozeb, was not detected in 16 water source samples, but the rest, surpassed the current regulations. Carbofuran was detected in 22 water source samples, indicating that these compounds are affecting water sources and suggest that the government should take corrective and preventive measures to reduce the environmental impact of pesticides in northern zone of this town.
Keywords: Environmental impact, residuality, detection and quantification, differential pulse voltammetry (DPV), reagents.
Introducción
El uso indiscriminado de plaguicidas es preocupante por sus efectos sobre el equilibrio de los ecosistemas, debido a que ha sido reconocido como fuente potencial de impacto negativo sobre el medio ambiente y su presencia en aguas y suelos se ha incrementado notoriamente. Se ha determinado que los fungicidas e insecticidas, son los productos más aplicados para la reducción y/o eliminación de plagas. El Mancozeb y Carbofurano, se destacan como los plaguicidas comerciales más solicitados por los agricultores. El Mancozeb es básicamente, la sal de etilenbisditiocarbamato usada ampliamente para proteger cultivos agrícolas de enfermedades fúngicas (Paro et al. 2012), debido a su amplio espectro biológico; los bajos costos de producción y a su perfil toxicológico seguro (Mujawar et al. 2014). Sin embargo, se ha evidenciado que la etilentiourea (ETU), metabolito que se forma al disociarse en el agua en presencia de oxígeno y que tiene alta movilidad en suelos debido a su elevada solubilidad en agua, es la responsable de su toxicidad a largo plazo en humanos y en el medio ambiente. Se ha comprobado que tiene efectos perjudiciales en animales de laboratorio, los cuales han llegado a presentar cambios histopatológicos en el hígado, en las glándulas suprarrenales y en las glándulas mamarias (Paro et al. 2012); necrosis renal, aberraciones cromosomales, degeneración neural (Brody et al. 2013), daño en el ADN (Medjdoub et al. 2011), y es disruptor endocrino (Bhaskar & Mohanty, 2014). La toxicidad del Mancozeb, se relaciona con la contaminación del suelo por labores agrícolas, elevándose el interrogante de cómo se afecta el metabolismo de las plantas y cómo es su impacto en la composición de los alimentos y en su calidad toxicológica (Pereira et al. 2014). Los métodos indirectos para la cuantificación de este fungicida, incluyen espectrofotometría UV–Vis (Paramasivam & Chandrasekaran, 2013), cromatografía de gases acoplada con espectrometría de masas (Mujawar et al. 2014), espectrometría FTIR, cromatografía líquida de alto rendimiento HPLC (López et al. 2013), cromatografía líquida acoplada a espectrometría de masas y métodos vibracionales (Moros et al. 2007).
El carbofurano (2,3 dihidro–2,2–dimetil–7–benzofuranil–metilcarbamato) es un insecticida y acaricida de contacto, sistémico y de amplio espectro usado en una gran variedad de cultivos (Bermúdez et al. 2011; Plangklang & Reungsang, 2009). Este compuesto es muy tóxico para los mamíferos y la LD50 para ratas es de 50 mg/kg. Sus propiedades tóxicas incluyen la inhibición de la acetilcolinesterasa, convulsiones violentas y trastorno neuromuscular si se inhala (ITII, 1994). También se reporta que es teratogénico, genotóxico, mutagénico, hepatotóxico (Gbadegesin et al. 2014) y disruptor endocrino (Hernández et al. 2011). La solubilidad en agua es alta, por lo tanto, se considera un contaminante potencial de aguas subterráneas por lixiviación. El riesgo de que el carbofurano afecte plantas y microorganismos, o su presencia en el agua en altas cantidades, depende de su concentración en el suelo y de los procesos de absorción y desorción (Bermúdez et al. 2011). Debido a su gran toxicidad y aplicabilidad se reportan varios métodos de cuantificación dentro de los que están espectrofotometría UV–Vis (Tamrakar et al. 2007), cromatografía líquida de alto rendimiento (Bermúdez et al. 2011; Otieno et al. 2010), cromatografía de gases, fluorimetría, sensores amperométricos (Sun et al. 2012) y cromatografía de gases acoplada a espectrometría de masas (Otieno et al. 2010; Bravo et al. 2005). El monitoreo de plaguicidas en aguas, es importante para la protección de la salud humana y el control del medio ambiente. Sin embargo, los métodos anteriormente mencionados para la cuantificación de estos plaguicidas requieren equipos costosos, pretratamientos de la muestra complicados, operadores profesionales y residuos peligrosos para el medio ambiente, lo cual limita su aplicación. La electroquímica para la detección y cuantificación de plaguicidas, es un método alternativo de amplio espectro, económico, versátil y amigable con el ambiente, que tiene ventajas sobre otras técnicas analíticas como su alta especificidad y sensibilidad, operación sencilla para el tratamiento de las muestras y bajo costo (Jeyapragasam & Saraswathi, 2014). El objetivo de este trabajo fue validar las metodologías voltamétricas para la cuantificación de carbofurano y mancozeb y determinar la residualidad de estos plaguicidas en aguas provenientes de fuentes hídricas del norte del Municipio de Ventaquemada, Boyacá– Colombia.
Materiales y métodos
Instrumentos
El estudio se llevó a cabo en un polarógrafo BAS CV 50W equipado con un analizador voltamperométrico, y estación electroquímica CGME analizador, la estación electroquímica estaba conformada de un electrodo de trabajo carbón vítreo BASI MF–2070®, electrodo de referencia Ag/AgCl BASI MF–2052® y un electrodo auxiliar de platino BASI MW–1032®. Adicionalmente, se usó una balanza analítica BOECO BAS 32® resolución 0.0001g, pH–metro Schott CG 842® resolución 0.01 y conductivímetro YSI 63® resolución 0.1. Todos los equipos cuentan con sus certificados de calibración.
Materiales
Todos los reactivos empleados fueron grado analítico: Mancozeb 99,9% (etileno bis ditiocarbamato de manganeso coordinado con iones de zinc) de Sigma, Carbofurano 99,9% (2,3–dihidro–2,2–dimetilbenzofuran–7–il metilcarbamato) de sigma, hidróxido de sodio 98% Panreac, ácido bórico 99,8% Merck, ácido fosfórico 85% Carlos Herba, ácido perclórico 65% Panreac, ácido acético 99,5–100,5% Panreac, ácido sulfúrico 98% de M&B, perclorato de sodio 98% de Alfa Aesar, EDTA 99–101% de Panreac. Todas las soluciones se prepararon con agua desionizada de conductividad 0,05uS (Sistema Milli–Di ® y Simplicity).
Soluciones
A partir de soluciones estándar de 1000mg/L de cada plaguicida (Mancozeb y Carbofurano), se prepararon soluciones de trabajo de 100 y 10mg/L. Las medidas electroquímicas o voltamétricas se realizaron en buffer Britton Robinson como electrolito de soporte (0,618g de ácido bórico, 0,56mL de ácido acético, 0,48mL de ácido orto–fosfórico en un volumen de 100mL con agua desionizada), el pH se ajustó con NaOH y H2SO4 1M para mancozeb a pH 5 y carbofurano a pH 2,8.
Selección del pH de trabajo
Se evaluó el comportamiento electroquímico de mancozeb en un rango de pH de: 1–10, en solución Briton–Robinson, el pH seleccionado para carbofurano fue tomado según lo reportado por Bravo et al. (2005), que sugiere pH 2.8 para este insecticida.
Parámetros para la detección electroquímica
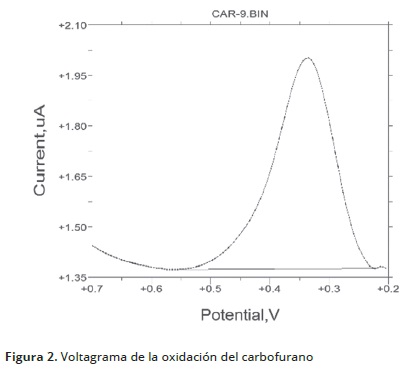
La optimización de las condiciones para la determinación de la señal de cada plaguicida, se evaluó mediante un diseño factorial 34 (Sensibilidad 1, 10 y 100µA/V; Tiempo de quietud 5, 10 y 15s; Amplitud de onda 20, 25 y 30mV y Tiempo de desoxigenación 50, 60 y 70s). En la Tabla 1, se detallan las condiciones a las cuales se llevó a cabo el estudio. Para la cuantificación de Mancozeb, se agregó un volumen conocido de solución de trabajo en un rango de 0,1–3,0mg/L, 3mL de agua y 4mL de la solución electrolítica. La mezcla obtenida, se transfirió a la celda electroquímica, se programó el equipo según las condiciones optimizadas previa a los parámetros y se procedió a la medición. Los potenciales seleccionados para la determinación cuantitativa de cada plaguicida fueron tomados según la respuesta voltamétrica de oxidación que el compuesto generaba. Estos potenciales fueron establecidos por determinación anódica: Mancozeb (–590 ± 12mV), y Carbofurano (445 ± 9mV). Los potenciales contrastados con otros métodos voltamétricos presentan desplazamientos en los potenciales redox, debido a que emplean electrodo trabajo de gota de mercurio, modificación de electrodos y diversos electrolitos de soporte; Mancozeb –430mV, (Swarupa et al. 2013), –455mV (Shan et al. 1999), Carbofurano 688Mv.
Selección de la curva de calibración
Las concentraciones de las soluciones estándar de mancozeb fueron 0.3, 0.5, 0.7, 0.9, 1.0, 2.0, 3.0, 4.0 y 5.0mg/L y para carbofurano 0.5, 0.7, 0.9, 1.0, 2.0, 3.0, 4.0, 5.0, 6.0 y 7.0mg/L.
Validación de los métodos
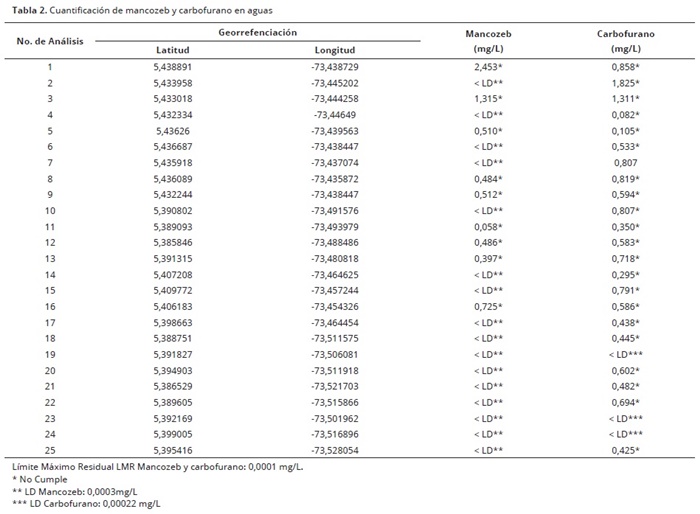
Se determinaron los principales atributos del método: límite de detección (DL), límite de cuantificación (QL), sensibilidad (Eurachem, 2005); precisión (con desviación estándar y coeficiente de variación) y exactitud (con porcentaje de recuperación), lo que se logró mediante la evaluación de seis lotes de soluciones compuestas por un blanco (solución Britton Robinson), un estándar alto (5 y 7 ppm para mancozeb y carbofurano respectivamente), un estándar bajo (0,5 y 3 ppm), dos muestras naturales (dos muestras de agua recolectadas en la zona norte del Municipio de Ventaquemada, Boyacá – Colombia. Un adicionado alto (2 y 6 ppm) y uno bajo (0,5 y 3 ppm), llevando a cabo el estudio, dos analistas. Los resultados fueron contrastados con los obtenidos en contra–muestras por la técnica de espectroscopia UV–Vis según Kaur et al. (2011), y Tamrakar et al. (2007). El tratamiento estadístico de los datos se realizó con el paquete SPSS, 2012®.
Determinación de Mancozeb y Carbofurano en aguas
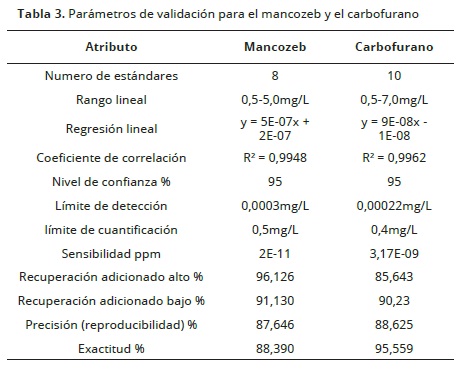
Veinticinco muestras de agua (2 litros por cada muestra y por triplicado) fueron recolectadas de forma aleatoria en diferentes fuentes hídricas (quebradas y pozos de almacenamiento aledaños a cultivos de papa y zanahoria) de la zona norte del municipio de Ventaquemada, veredas de Puente de Boyacá y Bojirque, Boyacá– Colombia; las cuales se etiquetaron por georreferenciación (Tabla 2). La toma, transporte, conservación y pretratamiento de las muestras, se llevó a cabo cuidadosamente conforme a los lineamientos técnicos estandarizados. Una vez en el laboratorio, se tomaron alícuotas de 10mL de cada muestra y se le adicionó un 1mL de EDTA 0,01N como solución acomplejante, luego se agitaron durante 5 minutos en un rotador orbital (marca UNICO, modelo L–RT28®); el precipitado formado fue separado mediante la ayuda de un equipo de filtración con bomba de vacío (marca BARNANT COMPANY®, modelo 400–3910) y papel filtro de fibra de vidrio grado GC–50 de 47mm de tamaño. La cuantificación de los plaguicidas se llevó a cabo como se describió anteriormente. Con la intensidad de corriente generada, se calculó la concentración de cada pesticida, para lo cual se emplearon las ecuaciones lineales de las curvas de calibración y teniendo en cuenta el tamaño de la muestra.
Diseño experimental
La validación se evaluó a través de un diseño factorial 26, las muestras se analizaron al azar por triplicado, en total se realizaron 64 ensayos por dos analistas.
Resultados y discusión
Selección de pH
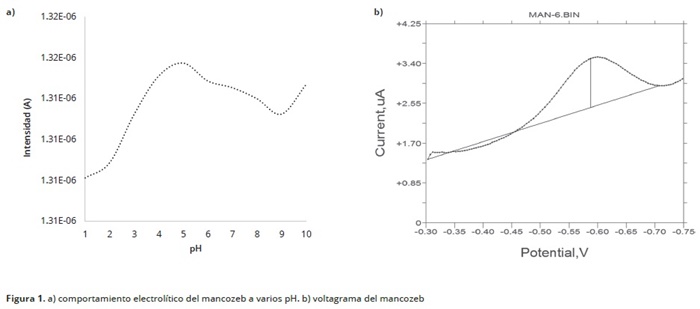
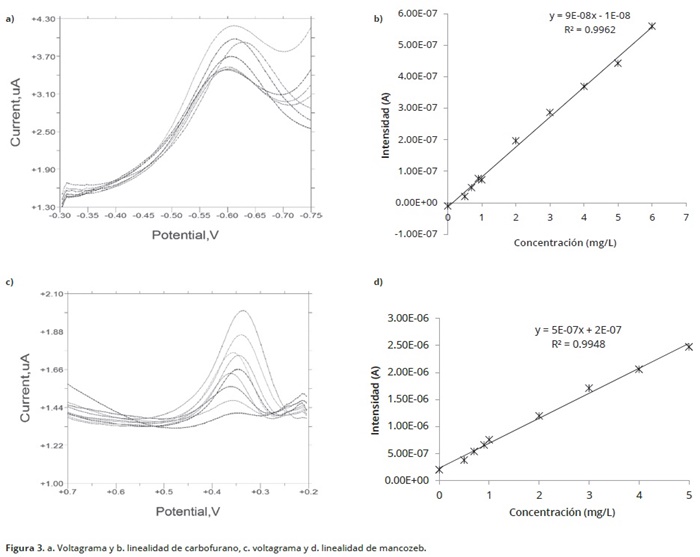
La oxidación de Mancozeb se evaluó en un rango de pH de 1–10 con el método de voltametría de onda cuadrada (VOC), presentando mejor respuesta a pH 5 (Figura 1). Swarupa et al. (2013), determinaron que la mejor respuesta de este compuesto se presentaba a pH 4,5 empleando buffer de acetato, lo que es similar a lo hallado en la presente investigación. El Mancozeb, en su proceso de oxidación genera una señal hacia –590 ± 12mV (Figura 1); la intensidad de corriente máxima se presenta a pH 5. Swarupa et al. (2013), emplearon un electrodo modificado de carbón vítreo para detectar mancozeb catódicamente por voltametría cíclica y diferencial de pulso, encontrando un potencial de reducción de 410mV. La electroactividad del Carbofurano, fue llevada a cabo por determinación anódica con VDP y presentó además, un potencial de oxidación hacia 445 ± 9mV (Figura 3). Lo anterior indica una mayor sensibilidad de la técnica. Los carbamatos son moléculas no electro–activas, por lo tanto, no presentan respuesta electroquímica alguna. Sin embargo, sus productos de hidrólisis se oxidan fácilmente sobre electrodo de carbón vítreo y producen derivados fenólicos (Figura 2).
Validación de los métodos
Se graficó la respuesta generada por el equipo, intensidad (Amperios) vs concentración, lo cual permitió establecer el rango lineal del método y la construcción de las curvas de calibración (4), en las que se obtuvo un coeficiente de correlación de 0,9962 (Carbofurano) y 0,9948 (Mancozeb) (Figura 3). Los atributos de validación (Tabla 3), indican que la exactitud y precisión están por encima del 87%, aunque el desempeño del método en estos aspectos ofreció mejores resultados para el Carbofurano. Los límites de detección y cuantificación fueron de 0.0003 y 0.5 mg/L para Mancozeb y 0.0002 y 0.4 mg/L para Carbofurano, valores similares a los encontrados en otros plaguicidas reportados recientemente por espectrofotometría cinética (0.12–0.26mg/L) y por técnicas voltamétricas (0.3–0.8mg/L); Swarupa et al. 2013). La selectividad de los métodos es alta porque otros pesticidas pueden estar presentes como residuos en las muestras analizadas (por ejemplo organofosforados), pero no son interferencias para el análisis porque el electrolito de soporte y en particular el pH, son totalmente diferentes. El análisis de varianza de las soluciones analizadas en la validación, indicó que no había diferencia significativa alguna entre los lotes y entre los analistas, lo que indica que los métodos son reproducibles. En adición a lo anterior, los resultados obtenidos presentan coeficientes de variación inferiores al 10%, lo que indica que los métodos son precisos. En cuanto a los porcentajes de recuperación superiores al 85%, indican que los métodos son exactos. Los métodos validados fueron comparados con las técnicas de espectrofotometría UV–Vis y los resultados indicaron que los métodos voltamétricos fueron superiores. Es decir, el método es más sensible y registra concentraciones más bajas del analito en muestras de agua. Esta diferencia se evaluó por medio de un análisis de varianza de un factor donde se tuvo como referencia la concentración de los estándares evaluados. No se presentó diferencia significativa en la concentración de los estándares de los plaguicidas por los dos métodos mencionados. El análisis fue realizado con un nivel de confiabilidad del 95%.
Residualidad de mancozeb y carbofurano en muestras de agua
La aplicación de los métodos electroquímicos validados se realizó en la detección y cuantificación de mancozeb y carbofurano en aguas provenientes de la zona norte del Municipio de Ventaquemada, Boyacá – Colombia, área de una amplia producción agrícola, especialmente de los cultivos de papa y zanahoria. De las 25 muestras evaluadas, el Mancozeb no se detectó en 16 muestras de agua (Tabla 2), pero en el resto de las muestras de agua, excedió el límite máximo residual permitido y estandarizado internacionalmente. En cuanto al Carbofurán, no se detectó solamente en 3 muestras de agua, lo que indica, que este insecticida es uno de los plaguicidas más usados en esta región y que su uso excesivo está contaminando las reservas hídricas, lo que puede causar un riesgo para la salud de los campesinos y animales que utilizan esta agua para consumo. El monitoreo de residuos de plaguicidas en aguas, es de crucial importancia para determinar el grado de exposición de una población y prevenir posibles consecuencias toxicológicas a largo plazo. Además, la implementación de programas de prevención en el uso correcto y racional de pesticidas, reduciría los riesgos de la comunidad a intoxicaciones con este tipo de sustancias.
Conclusiones
- La aplicación de los métodos validados en el análisis de muestras de fuentes hídricas, permitió conocer que en la zona norte del Municipio de Ventaquemada, Boyacá– Colombia, región donde tradicionalmente se establecen los cultivos de papa y zanahoria; se están utilizando indiscriminadamente estos dos pesticidas, debido a que en la mayoría de las muestras de agua evalauadas, se evideenció que excedian los límites mínimos residuales permitidos para estos compuestos en esta matriz. Los métodos electroquímicos fueron exitosamente aplicados en análisis rutinarios con una precisión (desviación estándar relativa < 10%) y exactitud (porcentajes de recuperación por encima del 88%) satisfactorias. Adicionalmente, se usaron cantidades pequeñas de reactivos y muestra de agua, reduciendo el impacto ambiental por la minimización de los residuos químicos.
Agradecimientos
Los autores agradecen a COLCIENCIAS y a la Universidad Pedagógica y Tecnológica de Colombia por el apoyo financiero al Convenio 0212–2013, titulado: "Sistema de detección in situ de plaguicidas en la cadena de la papa al alcance de los agricultores".
Referencias
Bermúdez. A. Fernández. D. Pateiro. M. Novoa. J.C. Simal. J. Arias. M. (2011). Adsorption and desorption kinetics of Carbofuran in acid soils. J Hazard Mater, 190(1–3), 159–167. doi:10.1016/j.jhazmat.2011.03.021.
Bhaskar. R. Mohanty. B. (2014). Pesticides in mixture disrupt metabolic regulation: In silico and in vivo analysis of cumulative toxicity of Mancozeb and imidacloprid on body weight of mice. Gen Comp Endocr, 205(1), 226–234. doi:10.1016/j.ygcen.2014.02.007.
Bravo R. L.M. Caltabiano. C. Fernández. K.D. Smith. M. Gallegos. R.D. Whitehead. J.R. Weerasekara–Restrepo. P. Bishop. A.M. Pérez. J.J. Needham. L.L. Barr. D.B. (2005). Quantification of phenolic metabolites of environmental chemicals in human urine using gas chromatography–tandem mass spectrometry and isotope dilution quantification, J Chromatogr B, 820(2),229–236. doi:10.1016/j.jchromb.2005.03.012.
Brody. H. Chou. E. Gray. J. Pokyrwka. M. Raley. K. (2013). Mancozeb–induced behavioral deficits precede structural neural degeneration. Neurotoxicology, 34, 74–81. doi:10.1016/j.neuro.2012.10.007.
Gbadegesin. M. Owumi. S. Akinseye. V. Odulona. O. (2014). Evaluation of hepatotoxicity and clastogenicity of Carbofuran in male Wistar rats. Food Chem Toxicol, 65,115–119. doi:10.1016/j.fct.2013.12.034.
Hernández. D. Pérez. M. Soler. F. Gravato. C. Guilhermino. L. (2011). Effects of carbofuran on the sea bass (Dicentrarchus labrax L.): Study of biomarkers and behaviour alterations. Ecotox Environ Safe, 74(7), 1905–1912. doi: 10.1016/j.ecoenv.2011.07.016.
Jeyapragasam. T. Saraswathi. R. (2014). Electrochemical biosensing of Carbofuran based onacetylcholinesterase immobilized onto iron oxide–chitosan nanocomposite. Sensor Actuat B–Chem, 191, 681–687. doi: 10.1016/j.snb.2013.10.054.
Kaur. M. Ashok. M. Singh. B. (2011). Fourth derivative spectrophotometric method for the determination of fungicide Maneb using sodium molybdate. Am J Anal Chem, 2, 158–163. doi:10.4236/ajac.2011.22018.
López. O. Rial. R. Simal. J. (2013). Factors governing the removal of Mancozeb residues from lettuces with washing solutions. Food Control, 34(2), 530– 538. doi:10.1016/j.foodcont.2013.05.022.
Medjdoub. A. Merzouk. S.A. Merzouk. H. Chiali. F.Z. Narce. M. (2011). Effects of Mancozeb and Metribuzin on in vitro proliferative responses and oxidative stress of human and rat spleen lymphocytes stimulated by mitogens. Pestic Biochem Phys, 101(1), 27–33. doi: 10.1016/j.pestbp.2011.06.002.
Moros. J. Armenta. S. Garrigues. S. La guardia. M. (2007). Comparison of two vibrational procedures for the direct determination of Mancozeb in agrochemicals. Talanta, 72(1), 72–79. doi: 10.1016/j.talanta.2006.09.027.
Mujawar. S. Utture. S. Fonseca. E. Matarrita. J. Banerjee. K. (2014). Validation of a GC–MS method for the estimation of dithiocarbamate fungicide residues and safety evaluation of mancozeb in fruits and vegetables. Food Chem, 150, 175–181. doi:10.1016/j.foodchem.2013.10.148.
Otieno P.O. Lalah. J.O. Virani. M. Jondiko. I.O. Schramm. K.W. (2010). Carbofuran and its toxic metabolites provide forensic evidence for Furadan exposure in vultures (Gyps africanus) in Kenya, Bull. Environ Contam Toxicol, 84 (5), 536–544. doi: 10.1007/s00128–010–9956–5.
Paramasivam. M. Chandrasekaran. S. (2013). Dynamics and residues of mixed formulation of fenamidone and Mancozeb in gherkin field ecosystem. Eco Env Saf, 98, 292–296. doi: 10.1016/j.ecoenv.2013.08.006.
Paro. R. Tiboni. G. M. Buccione. R. Rossi. G. Cellini. V. Canipari. R. (2012). The fungicide Mancozeb induces toxic effects on mammalian granulosa cells. Toxicol Appl Pharm, 260(2), 155–161. doi: 10.1016/j.taap.2012.02.005.
Pereira. S. I. Figueiredo. P. I. Barros. A. S. Dias. M.C. Santos. C. Duarte. L. F. Gil. A. M. (2014). Changes in the metabolome of lettuce leaves due to exposure to mancozeb pesticide. Food Chem, 154, 291–298. doi:10.1016/j.foodchem.2014.01.019.
Plangklang. P. Reungsang. A. (2009). Bioaugmentation of carbofuran residues in soil using Burkholderia cepacia PCL3 adsorbed on agricultural residues. Int Biodeter Biodegr, 63(4), 515–522. doi:10.1016/j.ibiod.2009.02.003.
Sun. X. Zhu. Y. Wang. X. (2012). Amperometric immunosensor based on deposited gold nanocrystals/4, 40–thiobisbenzenethiol for determination of Carbofuran. Food Control, 28(1), 184–191. doi:10.1016/j.foodcont.2012.04.027.
Swarupa. Ch. Siva. Prasad. M. Dhananjayulu. M. & Sreedhar. N.Y. (2013). Electrochemical determination and reduction behaviour of mancozeb at glassy carbon electrode modified with polyaniline based nanosensors. Int J Scient Eng Res, 4(7), 1234–1241.
Tamrakar. U. Pillai. A.K. Gupta. V. (2007). A simple colorimetric method for the determination of carbofuran and its application in environmental and biological samples. J Braz Chem Soc, 18(2), 337–341. doi: 10.1590/S0103–50532007000200014.
Referencias
ARMENTA, S.; GARRIGUES, S.; DE LA GUARDIA, M. 2005. Solid sampling Fourier transform infrared determination of Mancozeb in pesticide formulations. Talanta. 65(4):971-979.
BERMÚDEZ, A.; FERNÁNDEZ, D.; PATEIRO, M.; NOVOA, J.C.; SIMAL, J.; ARIAS, M. 2011. Adsorption and desorption kinetics of carbofuran in acid soils. J. Hazard Mater. 190:159-167.
BLASCO, C.; FONT, G.; PICÓ, Y. 2004. Determination of dithiocarbamates and metabolites in plants by liquid chromatography–mass spectrometry. J. Chromatogr. A. 1028:267-276.
BRAVO R., L.M.; CALTABIANO, C.; FERNANDEZ, K.D.; SMITH, M.; GALLEGOS, R.D.; WHITEHEAD, J.R.; WEERASEKARA., RESTREPO, P., BISHOP, A.M., PÉREZ, J.J., NEEDHAM, L.L., BARR, D.B. 2005. Quantification of phenolic metabolites of environmental chemicals in human urine using gas chromatography–tandem mass spectrometry and isotope dilution quantification, J. Chromatogr. B Analyt Technol Biomed Life Sci. 820(2):229-236.
CALDAS, E.D.; CONCEIC¸AO, M.H.; MIRANDA, M.C.C.; DE SOUZA, L.C.K.R.; LIMA, J.F. 2001. Determination of dithiocarbamate fungicide residues in food by a spectrophotometric method using a vertical disulfide reaction system. J. Agric. Food Chem. 49 (10): 4521- 4525.
COHEN, S. M.; CANO, M.; JOHNSON; L. S.; JOHN, M. K.; ASMOTO, M.; GERLAND, E. M.; TYSSEN, J. H.; SANGHA, G. K.; VAN GOETHEM,D. L.1994. Mitogenic effects of propoxur on male rat bladder urothelium. Carcinogenesis 15: 2593-2597.
EASTON, A., GUVEN, K., POMERAI, D. I. 2001. Toxicity of the dithiocarbamate fungicide mancozeb to the nontarget soil nematode, Caenorhabditis elegans. J. Biochem Mol Toxic, 15: 15–25.
EPA, 40 CFR Part. 180 of May 15, 2009. 74 (93). Rules and Regulations, (2009) p 23 045–23 095.
FAO. 2000. Assessing Soil Contamination. A Reference Manual, FAO, Rome.
GUIBERTEAU, A., GALEANO, T., SALINAS, F., ORTÍZ, J.M. 1995. Indirect voltammetric determination of carbaryl and carbofuran using partial least squares calibration. Anal. Chim. Acta. 305: 219-226.
ITII. International Technical Information Institute. 1994. Toxic and Hazardous Industrial Chemical, Safety Manual for Handling and Disposal with Toxicity and Hazard Data; Japan, p. 357.
KAUR M., ASHOK, M., SINGH, B. 2011. Fourth derivative spectrophotometric method for the determination of fungicide maneb using sodium molybdate. Am. J. Anal. Chem, 2: 158-163.
SHAN, M., IUAN B., LEU, H. Y SHING, J. 1999. Trace measurement of dithiocarbamate based pesticide by adsorptive stripping voltammetry. Anal. Chim. Acta 388: 111-117.
MINISTERIO DE LA PROTECCIÓN SOCIAL. 2007. Resolución 2115 de 2007. Calidad del agua para consume humano. P. 5. Disponible en internet desde: https://www.minambiente.gov.co/images/GestionIntegraldelRecursoHidrico/pdf/Legislaci%C3%B3n_del_agua/Resoluci%C3%B3n_2115.pdf.
/04/2015.
MOROS, J.; ARMENTA, S.; GARRIGUES, S.; LA GUARDIA, M. 2007. Comparison of two vibrational procedures for the direct determination of mancozeb in agrochemicals. Talanta 72: 72–79.
NIA, Y. QIU, P. KOKOTC, S. 2005. Simultaneous voltammetric determination of four carbamate pesticides with the use of chemometrics. Anal Chim. Acta, 537 (1): 321-330.
OTIENO P.O., LALAH, J.O., VIRANI M., JONDIKO, I.O. SCHRAMM, K.W. 2010. Carbofuran and its toxic metabolites provide forensic evidence for furadan exposure in vultures (Gyps africanus) in Kenya, Bull. Environ. Contam. Toxicol. 84 (5): 536–544.
PACIONI, N. L.; VEGLIA, A. V. 2003. Determination of carbaryl and carbofuran in fruits and tap water by cyclodextrin enhanced fluorimetric method. Anal Chim Acta. 488: 193-202.
PARO, R., TIBONI, G. M., BUCCIONE, R., ROSSI, G., CELLINI, V., CANIPARI, R. 2012. The fungicide mancozeb induces toxic effects on mammalian granulosa cells. Toxicol. Appl. Pharm, 260: 155–161.
PEREIRA, S. I.; FIGUEIREDO, P. I.; BARROS, A. S.; DIAS, M.C.; SANTOS, C.; DUARTE, L. F.; GIL, A. M. 2014. Changes in the metabolome of lettuce leaves due to exposure to mancozeb pesticide. Food Chem. 154: 291–298.
PLANGKLANG, P., REUNGSANG, A. 2009. Bioaugmentation of carbofuran residues in soil using Burkholderia cepacia PCL3 adsorbed on agricultural residues. Int. Biodeter. Biodegr. 63: 515-522.
RITTER, W.F. SCARBOROUGH, R.W., CHIRNSIDE, A.E.M. 1994. Contamination of groundwater by triazines, metolachlor and alachlor. J. Contam. Hydrol. 15: 73-92.
SUN, X.; ZHU, Y.; WANG, X. 2012. Amperometric immunosensor based on deposited gold nanocrystals/4,40-thiobisbenzenethiol for determination of carbofuran. Food Control 28:184-191.
SYRAGO-STYLIANI, E. P., EVAGELOS, G., ANTHONY, T., PANAYOTIS, A. S. 2006. Gas chromato- graphic-tandem mass spectrometric method for the quantitation of carbofuran, carbaryl and their main metabolites in applicators’ urine. J Chromatog A, 1108: 99-110.
SWARUPA, CH. SIVA PRASAD, M. DHANANJAYULU M. Y SREEDHAR, N.Y. 2013. Electrochemical determination and reduction behaviour of mancozeb at glassy carbon electrode modified with polyaniline based nanosensors. Int. J. Scient Eng. Res. 4: 1234-1241.
TEMPLETON, S.R. ZILBERMAN, D. YOO, S.J. 1998. An economic perspective an outdoor residential pesticide use. Environ. Sci. Technol. 32: 416-423.
TAMRAKAR, U.; PILLAI, A.K.; GUPTA, V. 2007. A simple colorimetric method for the determination of carbofuran and its application in environmental and biological samples. J. Braz. Chem. Soc., 18(2): 337-341.
TENNAKOON, S., PERERA, B., HATURUSINGHE, L. 2009. Intentional poisoning cases of animals with anticholinesterase pesticide-carbofuran in Sri Lanka. Legal Med. 11: 500–502.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Diego Valbuena, Marcela Cely-Santos, Diana Obregón. (2021). Agrochemical pesticide production, trade, and hazard: Narrowing the information gap in Colombia. Journal of Environmental Management, 286, p.112141. https://doi.org/10.1016/j.jenvman.2021.112141.
2. Pablo A. Ochoa‐Cueva, Juan Arteaga, Ana P. Arévalo, Alan S. Kolok. (2022). A potential pesticides exposure index (PPEI) for developing countries: Applied in a transboundary basin. Integrated Environmental Assessment and Management, 18(1), p.187. https://doi.org/10.1002/ieam.4470.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2016 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.