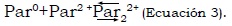Validación del método voltamétrico para la determinación de residuos de paraquat aplicado en cultivos de papa
Validation of the voltammetric method for the determination of residues of paraquat applied to potato crops
DOI:
https://doi.org/10.15446/acag.v64n4.44521Palabras clave:
Detección, electroquímica, herbicidas, paraquat, productos agrícolas. (es)Agricultural products, detection, electrochemistry, herbicides, paraquat (en)
Descargas
La cuantificación de plaguicidas es un proceso costoso y de difícil acceso para los cultivadores y entidades de salud y vigilancia. En este trabajo se presenta la metodología de voltametría de onda cuadrada para la cuantificación de paraquat(gramoxone) en papa (Solanum tuberosum). El método de voltametría de onda cuadrada fue validado para la cuantificación de este herbicida en papa. El estudio fue realizado usando como electrolito de soporte solución buffer Britton-Robinson, electrodo de trabajo de carbón vítreo, Ag/AgCl como electrodo de referencia y platino como electrodo auxiliar. El herbicida en papa fue extraído por reparto sólido-líquido y los resultados obtenidos fueron contrastados por espectroscopía UV-Vis,lo que permitió deducir que el método voltamétrico genera resultados precisos y confiables. El método propuesto fue exitosamente aplicado para lacuantificación de paraquat en muestras de papa con resultados satisfactorios.
Pesticides quantification is an expensive work and it is inaccessible for farmers and health authorities and supervisory entities. This paper describes a simple, economical and acsequible methodology for quantification of carbofuran, methomyl and mancozeb in potatoe (Solanum tuberosum). The square wave electrochemical voltammetric method to quantify Paraquat was validated. It used Britton-Robinson buffer as solution supporting electrolyte, working electrode glassy carbon, Ag/AgCl as reference electrode and platinum as counter electrode. Herbicidewas extracted from potato through solid-liquid partitionmethodology, the results obtained by voltammetry were compared with UV-Vis spectroscopy,and we can observe that voltammetric method generates accurate and reliable results. The proposed method was successfully applied to the determination of paraquat in potato samples with satisfactory results.
Validación del método voltamétrico para la determinación de residuos de paraquat aplicado en cultivos de papa
Validation of the voltammetric method for the determination of residues of paraquat applied to potato crops
Adriana Elizabeth Lara Sandoval*, José Mauricio García Colmenares y Sandra Patricia Chaparro Acuña
Grupo de Investigación en Química Ambiental. Facultad de Ciencias. Universidad Pedagógica y Tecnológica de Colombia. Tunja, Boyacá, Colombia. *Autora para correspondencia: adriana.lara@uptc.edu.co
Rec.: 21.07.2014 Acep.: 04.11.2014
Resumen
La cuantificación de plaguicidas es un proceso costoso y de difícil acceso para los cultivadores y entidades de salud y vigilancia. En este trabajo se presenta la metodología de voltametría de onda cuadrada para la cuantificación de paraquat (gramoxone) en papa (Solanum tuberosum). El método de voltametría de onda cuadrada fue validado para la cuantificación de este herbicida en papa. El estudio fue realizado usando como electrolito de soporte solución buffer Britton–Robinson, electrodo de trabajo de carbón vítreo, Ag/AgCl como electrodo de referencia y platino como electrodo auxiliar. El herbicida en papa fue extraído por reparto sólido–líquido y los resultados obtenidos fueron contrastados por espectroscopía UV–Vis,lo que permitió deducir que el método voltamétrico genera resultados precisos y confiables. El método propuesto fue exitosamente aplicado para lacuantificación de paraquat en muestras de papa con resultados satisfactorios.
Palabras clave: Detección, electroquímica, herbicidas, paraquat, productos agrícolas.
Abstract
Pesticides quantification is an expensive work and it is inaccessible for farmers and health authorities and supervisory entities. This paper describes a simple, economical and acsequible methodology for quantification of carbofuran, methomyl and mancozeb in potatoe (Solanum tuberosum). The square wave electrochemical voltammetric method to quantify Paraquat was validated. It used Britton–Robinson buffer as solution supporting electrolyte, working electrode glassy carbon, Ag/AgCl as reference electrode and platinum as counter electrode. Herbicidewas extracted from potato through solid–liquid partitionmethodology, the results obtained by voltammetry were compared with UV–Vis spectroscopy,and we can observe that voltammetric method generates accurate and reliable results. The proposed method was successfully applied to the determination of paraquat in potato samples with satisfactory results.
Keywords: Agricultural products, detection, electrochemistry, herbicides, paraquat.
Introducción
Los pesticidas son cada vez más utilizados en el departamento de Boyacá, Colombia, para el control de plagas en cultivos de papa (ICA, 2011). Está demostrado que el uso de estos compuestos es una de las prácticas que más ha contribuido al incremento de la producción agrícola en las últimas décadas, aproximadamente en un 50%, y junto con el empleo de fertilizantes sintéticos, sistemas de riego y compuestos orgánico–sintéticos, son en la actualidad indispensables para satisfacer la creciente demanda mundial de alimentos (Ministerio de la Protección Social, 2003); pero su uso indiscriminado genera consecuencias negativas para los ecosistemas, los agricultores y los consumidores, derivadas de la alta residualidad en alimentos como tomate, que junto con la papa, espinaca y lechuga son los productos en los cuales se acumulan más contaminantes (Larsbo et al., 2009).
El paraquat es un herbicida no selectivo, posemergente y de contacto, que es aplicado al follaje de las malezas y posee un amplio espectro de control. La aplicación periódica puedegenerar residualidad, cuya importancia toxicológica debe ser evaluada regularmente.Este herbicida es extremamente tóxico para los humanos (LD50= 35 mg/kg) y animales (LD50 = 110–150 mg/kg) por todos los medios de exposición (El Harmoudi et al., 2013). El Límite Máximo de Residuos (LMR) para paraquat en raíces y tubérculos se encuentra en 0.05 mg/kg (50 µg/g) (Codex Alimentarius, 2013). La Agencia de Protección Ambiental de los Estados Unidos (EPA) y la Organización Mundial de la Salud (OMS) han determinado que varios compuestos de este tipo tienen riesgos de tipo mutagénico y efectos reproductivos y de fetotoxicidad; además, está incluido en el procedimiento PIC (ICP, Convenio de Rotterdam, 1998) que se aplica a plaguicidas sumamente peligrosos para la salud humana. En estudios de toxicidad aguda utilizando animales de laboratorio, el paraquat ha mostrado ser altamente tóxico por inhalación, teniendo una categoría toxicológica de I (el más alto de los cuatro niveles) para los efectos de inhalación aguda. Este compuesto es moderadamente tóxico (Categoría II) por vía oral y ligeramente tóxico (Categoría III) por vía cutánea (Agencia de Protección Ambiental de los Estados Unidos, 1997). El herbicida ingresa al organismo por vía cutánea, respiratoria o digestiva;su vida media en el organismo es relativamente corta, aproximadamente de 12 a 120 horas (Ríos, 2012). Aunque se ha demostrado que su uso es seguro, pueden ocurrir casos de intoxicación donde el mecanismo se asocia con la acumulación de especies reactivas del oxígeno (ROS) y los radicales libres tóxicos en diversos órganos, especialmente en los pulmones, dando lugar a lesiones oxidativas (Paixao et al., 2002).
Entre los métodos utilizados para la determinación de paraquat, la cromatografía de gases acoplada a la espectrometría de masas (GC/MS) ha sido considerada como método de detección de referencia reportado por el Codex Alimentarius, al igual que la espectrofotometría UV–Vis referenciaday avalada por la AOAC. En la literatura se reportandiferentes técnicas de análisis de paraquat, entre ellas: espectrofotometría (Rai et al., 1997), cromatografía líquida (Taguchi et al., 1998) y análisis de flujo (Saad et al., 1998).Sin embargo, es necesario buscar metodologías accesibles e innovadoras como la voltametría que constituye una alternativa de amplio espectro, económica, versátil y amigable con el ambiente, ya que los métodos usados comúnmente son costosos y en pocas universidades e institutos de investigación se cuantifica este herbicida, por lo tanto,en el país son escasos los estudios relacionados con dicho compuesto.
La electroquímica es una opción para el análisis de trazas de metales pesados,aniones, sulfuros, nitritos, nitratosy otros compuestos orgánicos en aguas, alimentos, productos químicos y baños galvánicos a niveles de ppt, ppb y ppm. Algunos plaguicidas, como paraquat, cuando reciben pequeños potenciales de corriente experimentan procesos de oxidación y/o reducción y generan como respuesta intensidades de corriente características, que pueden ser cuantificadas electroquímicamente. Rühling et al. (1998), Souza y Machado (2005), Monk et al. (1999), Luciana et al. (2010) evaluaron el comportamiento electroquímico de paraquatpor voltametría diferencial de pulso con electrodo de mercurio,voltametría de onda cuadrada con microelectrodos de oro, voltametría cíclica con electrodo de mercurio y voltametría de onda modificada.
El objetivo del presente trabajo fue validar el método electroquímico usando electrodo de carbon vítreo como elemento de trabajo parala cuantificación de paraquat en papa, ya que este electrodo no produce residuos que puedan contaminar el ambiente ni al analista, además presenta un rango de trabajo más amplio.
Materiales y métodos
Reactivos y equipos
Los reactivos empleados fueron de grado analítico: hidróxido de sodio 98%, ácido bórico 99.8%, ácido fosfórico 85%, de Merck; paraquat 99.9% (1,1’–Dimetil–4,4’–dicloro bipiridina) de Sigma; ácido acético 99.5%, ditionito de sodio 85% de Panreac y nitrógeno gaseoso. Todas las soluciones se prepararon con agua desionizada (Sistema Milllipore) con conductividad 0.05 us.
En los equipos se verificaron las condiciones óptimas de funcionamiento y calibraciónnecesarias para la validación del método, dentro de los que se encuentran: Polarógrafo BAS CV 50W equipado con un analizador voltamperométrico, electrodo de trabajo de carbón vítreoBASI MF–2070, electrodo de referencia Ag/AgCl BASI MF–2052 y un electrodo auxiliar de platino BASI MW–1032, balanza analítica Aventure Ohaus y pontenciometro Sartorius Scohott CG 842. La comparación de resultados de voltametría de onda cuadrada frente al método espectrofotométrico UV–Visse realizó en un UV–Vis Génesis UV 10.
Soluciones estándar y de trabajo. Se preparó una solución ‘stock’ del plaguicida de 1000 mg/l en agua desionizada. Se ‘pipetearon’ 10 ml de la solución stock a un balón de 100 ml y se aforócon agua desionizada ajustando su concentración a 100 mg/l, de la cual se llevaron 10 ml a un balón de 100 ml y se aforó con agua desionizada. La concentración final de esta solución de trabajo fue de 10 mg/l.
Electrolito de soporte (buffer Britton Robinson). Enun balón de 100 ml se adicionaron 0.618 gde ácido bórico, 0.56 ml de ácido acético y 0.48 ml de ácido orto fosfórico,a continuación se ajustóa pH 5 con NaOH 0.1Ny se aforó con agua desionizada.
Parámetros voltamétricos. Se optimizaron las condiciones del análisis voltamétrico tales como tiempo de desoxigenación, tiempo de reposo, rango de trabajo, sensibilidad, amplitud de onda y frecuencia de onda, mediante análisis por triplicado.
Comportamiento electroquímico de paraquat. El proceso electroquímico de paraquat es cuasi reversible, según lo describen Souza et al. (2005). El paraquat presenta dos procesos de oxidación. La primera señal se presenta a –663 ± 50 mV, (Ecuación 1), proceso que es seguido por una segunda oxidación (Ecuación 2) a –947 ± 50 mV; finalmente ocurre la formación de un dímero con dos cargas positivas cuasi reversible (Ecuación 3) (Souza y Machado, 2005).
Y subsecuente formación de un dímero:
Validación de la técnica voltamétrica
En la pre–validación del método, además de comprobar la calibración de los equipos y del material volumétrico, se seleccionaron las condiciones instrumentales como el potencial inicial, el potencial final, la desoxigenación de la muestra, el tiempo de quietud, la sensibilidad, la amplitud de onda y el rango de potencial. Para la validación, se llevó a cabo la linealidad del método (de 0.5 a 3 mg/l) y se determinaron los principales atributos del método o de validación como límite de detección (DL) (Eurachem, 2005), el límite de cuantificación (QL) (Eurachem, 2005), la precisión con desviación estándar y coeficiente de variación, la exactitud con porcentaje de recuperación, el rango útil, la sensibilidad e incertidumbre. Mediante la evaluación de seis lotes de soluciones compuestas por un blanco, un estándar alto, un estándar bajo, dos muestras naturales (papa) y una muestra fortificada con un estándar alto y bajo (2.7 mg/l y 500 µg/l) con adición de herbicida en las concentraciones ya relacionadas. Los análisis fueron realizados por dos laboratoristas.
Para determinar la exactitud del método voltamétrico se emplearon las muestras fortificadas (Eurachem, 2005)para lo cual se mezclaron un volumen conocido de la solución estándar, 3 ml de extracto de papa y 4 ml de la solución electrolítica y se ajustó a pH 5. La mezcla obtenidase transfirió a la celda electroquímica, se programó el equipo según la optimización previa de los parámetros y se procedió a la medición. Los resultados fueron contrastados con los obtenidos en contra–muestras por el método espectrofotométrico 969.09 (AOAC, 1990).
Tratamiento de muestras naturales
Se modificó la metodología de extracción sólido–líquido descrita por Qiu y Nian (2008) y Leoni et al.(1992), quienes proponen una extracción partición sólido líquido con acetona y diclorometano como solventes, pero para optimizar el proceso se hizo una extracción sohxlet adicional con diclorometano y se obtuvieron extractos del herbicida de la muestra tratada, las cuales fueron disueltas en agua desionizada para la medición voltamétrica. Como muestras representativas se utilizaron 5 kg de papa, adquiridas en la central de abastos del sur de la ciudad de Tunja– Boyacá.
Diseño experimental
La evaluación se hizo en un diseño factorial 26 al azar en muestras triplicadas. En total se realizaron 64 ensayos, lo que permitió evaluar la seguridad y confiabilidad del método. Las diferencias significativas se determinaron mediante diagrama de cajas utilizando el software estadístico SPSS 18 para Windows.
Resultados y discusión
Respuesta señal del equipo
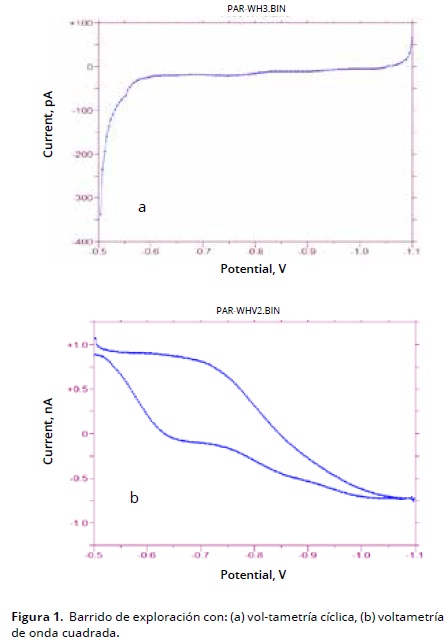
Se realizó un barrido exploratorio por la técnica de voltametría cíclica VC (Figura1a) y voltametría de onda cuadrada OSWV (Figura 1b) y se eligió esta última para el proceso de validación debido a su mayor sensibilidad, lo cual es una ventaja para la cuantificación de cantidades muy pequeñas (Figura 1b). En elensayo no se presentó señal del blanco que pudiera interferir con el análisis químico.
Se analizó un estándar para conocer su potencial de electroactividad por VC, la cual permite identificar de forma precisa el potencial de redox de una especie electroquímica, además, ofrece información acerca de la especie evaluada, si la reacción que se lleva es reversible o no. Seguidamente se optimizaron los parámetros de la técnica de voltametría de onda cuadrada (OSWV) en un rango de trabajo evaluado de –300 mV a –1600 mV obteniendo un rango óptimo de–500mV a –1100mV, una sensibilidad estudiada de 100 uA/V a 100 nA/V optimizado en 1 uA/V, tiempo de quietud de 2–20 seg, con un valor óptimo de 5 seg, amplitud de onda evaluada de 15 mV a 50 mV, con un valor óptimo de 25mV, frecuencia de onda de 15 Hz a 16 Hz, establecida en 15 Hz y tiempo de desoxigenación de 1–10 min, optimizado en 5 min.
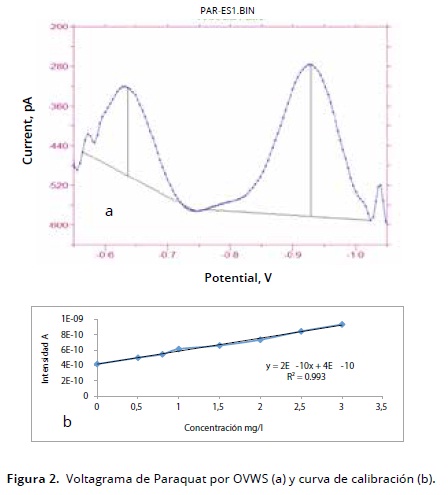
En paraquat el potencial se determinó por el método anódico y presentó dos potenciales de oxidación: –663 y –947mV (Figura 2a). La segunda señal presentó mejores parámetros estadísticos, por tanto, con base enella se llevó a cabo la validación y cuantificación del herbicida en la matriz de estudio. Rühling et al. (1998) estudiaron la presencia de tres plaguicidas, entre ellos paraquat, empleando la técnica voltametría diferencial de pulso (DPV) y electrodo de gota de mercurio y hallaron un potencial de oxidación – 600 y –1400 mV; Souza y Machado (2005) emplearon microelectrodos de oro por la técnica de análisis OSWV para cuantificar este herbicida y hallaron potenciales de oxidación de – 640 y – 940 mV; Monk et al. (1999) estudiaron el comportamiento electroquímico de paraquat en medio acuoso usando voltametría cíclica y detectaron dos picos, el primero en –700 mV y el segundo, en –1200 mV, frente a electrodo gota de mercurio (SCE). El primer pico es generado por la formación del catión radical y el segundo por la formación de la especie neutral; de acuerdo con estos autores, este proceso es seguido por una dimerización química.
Selección de la curva de calibración
Las soluciones estándar de paraquat fueron de 0.5, 0.8, 1.0, 1.5, 2.0, 2.5 y 3 mg/l, que se utilizaron para graficar la respuesta generada por el equipo, intensidad (Amperios) vs concentracion (mg/l), lo cual permitió establecer el rango lineal del método y la construcción de la curva de calibración que presentó un coeficiente de correlacion de 0.993 (Figura 2b).
Extracción sólido–líquido de paraquat
La metodología de extracción sólido–líquido descrita por Qiu y Nian (2008) y Leoni et al.(1992) se hace en base húmeda y requiere gran cantidad de diclorometano y acetona. El método planteado y modificado en este estudio se realizó en base seca y en sistema Soxhlet, lo que permite ahorrar hasta 60% en el uso de solventes con una eficiencia de extracción de 93%, 16% más que el método de referencia. Otras metodologías de extracción de paraquat en papa utilizado por García et al. (2014) obtienen una eficiencia de extracción menor que 90%.
Validación del método OSWV
Los atributos del método voltamétrico validado fueron los siguientes: límite de detección 50µg/g, límite de cuantificación 150µg/g, sensibilidad 1,69E–09I/µg por gramo, recuperación adicionado alto 81.28%, recuperación adicionado bajo 90.16%, precisión 86.63%, exactitud 96.90%, incertidumbre ± 0.06 µg/g y nivel de confianza 95%.
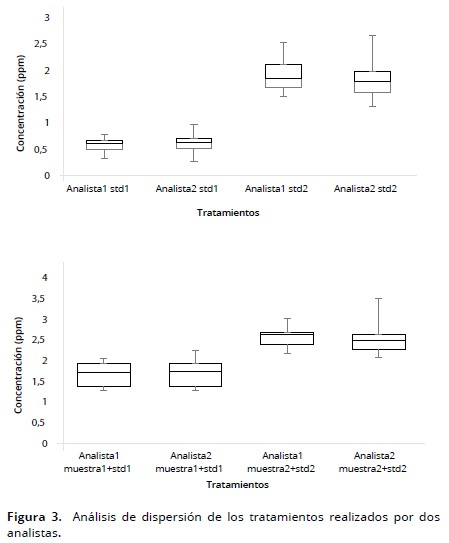
Se determinó que las respuestas delos estándares y las muestras naturales más estándar en los seis ensayos realizados por ambos analistas en el proceso de validación no presentaron variaciones significativas, lo que evidencia la robustez del método empleado (Figura 3).
Las medidas del estándar–2 y muestra–1 más estándar presentaron mayor dispersión debido, posiblemente, a que estas concentraciones son mayores que el estándar–1 y muestra–1 más adicionado, sin embargo, no se presentaron diferencias significativas (P > 0.05).(Tabla 1).

Para evaluar si el método de validación se encontraba o no en un estado de control estadístico, es decir si sólo estaban actuando causas comunes o aleatorias, inherentes al método y se trataba de un proceso estable y predecible, se elaboraron las cartas de control. Cuando existen causas especiales el proceso está fuera de control estadístico, las gráficas de control detectan la existencia de estas causas en el momento en que ocurren, lo cual permite que se puedan tomar acciones inmediatas (Feingenbaum, 1994). Cuando se compararon los valores de las medias de concentración obtenidas porambos analistas en 10 mediciones de un estándar alto deparaquat, las concentraciones obtenidas se encontraron dentro de los límites de control, lo que permite deducir que el proceso y las variables aleatorias de validación eran controlables.
Resultados por voltametría de onda cuadrada vs. el método espectrofotométrico UV–Vis
Una vez validado para cuantificación de paraquat, el método voltamétrico se aplicó a extractos de papa y se verificó la confiabilidad de las mediciones voltamétricas en cinco muestras fortificadas de papa (con 500 µg/l) yestándares deparaquat (0.5, 1, 2 y 3 mg/l). Los resultados fueron comparados con los obtenidos por el método #969.09 que usa espectrofotometría UV–Vis y está avalado y normalizado por la AOAC (AOAC,1990).
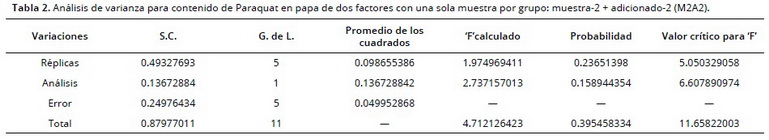
Las concentraciones determinadas de paraquat en las muestras y estándares por OSWV fueron superiores a las encontradas con el método de referencia. La diferencia se evaluó por medio de un análisis de varianza de un factor, donde se tuvo como referencia la concentración de los estándares. No se presentó diferencia (P > 0.05) en la concentración de los estándares de paraquat por ambas técnicas de análisis. El valor ‘F’ calculado (estándar 1: 2.829, estándar 2: 0.193; muestra 1 + estándar 1: 0.167; muestra 2 + estándar 2: 0.639) es inferior al valor ‘F’ crítico de aceptación (estándar 1: 4.14; estándar 2: 4.15; muestra 1 + estándar 1: 4.18; muestra 2 + estándar 2: 4.14). El análisis fue realizado con un nivel de confiabilidad del 95%, correspondiente al método voltamétrico. (Tabla 2).
Conclusiones
- Las condiciones instrumentales y los principales parámetros de validación del método voltamétrico de onda cuadrada para determinación cuantitativa de paraquat en papa establecidos permitieron obtener resultados válidos y confiables con un nivel de confianza de 95%.
- La metodología desarrollada constituye una alternativa económica y amigable con el entorno natural para la determinación de paraquat en papa, obteniendo resultados exactos y precisos. Estemétodo electroquímico puede ser aplicado en análisis de este herbicida en otros productos de origen agrícola, realizando tratamientos previos a las muestras.
Agradecimientos
Los autores agradecen a Colciencias y a la Universidad Pedagógica y Tecnológica de Colombia por el apoyo financiero dentro del Convenio 0212–2013 ‘Sistema de detección in situ de plaguicidas en la cadena de la papa al alcance de los agricultores’.
Referencias
Agencia de Protección Ambiental de los Estados Unidos. 1997. Disponible en http://www.epa.gov/oppsrrd1/REDs/factsheets/0262fact.pdf
Codex Alimentarius. 2013. Residuos de plaguicidas en alimentos y piensos. Disponible en http://www.codexalimentarius.net/pestres/data/pesticides/details.html?id=57
El Harmoudi, H.; Achak, M.; Farahi, A.; ahrich, S. et al.2013. Sensitivedetermination of paraquat by square wave anodic stripping voltammetrywith chitin modified carbon paste electrode.Talanta 115:172–177.
García, R.; Salvador, P.; y Sánchez, F.; 2014. Rapid method based on immunoassay for determination of paraquat residues in wheat, barley and potato. Food Control 41:193 – 201.
ICA (Instituto Colombiano Agropecuario). 2011. Manejo fitosanitario del cultivo de la papa. Medidas para la temporada invernal. Produmedios. p. 5.
Leoni, V.; Caricchia, A. M.; y Chiavarini, S. 1992. Multiresidue method for quantitation of organophosphorous pesticides in vegetable and animal foods. J. AOAC. Int. 75:511–518.
Luciana, B. O.; Carlos, M. C.; y Jorge, C. 2010. Development of a sequential injection–square wave voltammetry method for determination of paraquat in water samples employing the hanging mercury drop electrode. Anal Bioanal Chem. 396:1897 – 1903.
Larsbo, M.;Stenström, J.;Etana, A.;Börjesson, E.; y Jarvis, N. J. 2009. Herbicide sorption, degradation, and leaching in three Swedish soils under longterm conventional and reduced tillage. Soil Till Res. 105:200–208.
Monk, P.M.;Turner, C.; yAkhtar, S.P. 1999. Electrochemical behaviour of methyl viologen in a matrix of paper. Electrochim.Acta.44:4817 – 26.
AOAC (Official Methods of Analysis). Edited by Kenneth Helrich, 15th Edition, Validación 969.09, 1990. p. 227.
Paixao, P.; Costa, P.; Bugalho T.; Fidalgo C.; y Pereira L.M. 2002. Simple method for determination of paraquat in plasma and serum of human patients by high–performance liquid chromatography. J. Chromatogr.B. 775:109–113.
Qiu, P. y Nian. Y. 2008. Determination of ziram in vegetable samples by square wave voltammetry. Chinese Chem. Lett. 19:1337 – 1340.
Rai, M.K.;Das, J.V.; y Gupta, V.K. 1997.A sensitive determination of paraquat by spectrophotometry. Talanta 45(2):343– 348.
Ríos, J. 2012. Paraquat. Disponible en http://escuela.med.puc.cl/publ/guiaintoxicaciones/Paraquat.html 23/10/2014.
Rühling, I.; Schäfer, H.; y Ternes, W. 1999.HPLC online reductive scanning voltammetric detection of diquat, paraquat and difenzoquat with mercury electrodes. Fresenius J. Anal. Chem.364:565 – 569.
Saad, B.; Ariffin, M.; y Saleh, M.I. 1998. Flow injection potentiometric determination of paraquat in formulations and biological samples. Talanta 47(5):1231–1236.
Souza, D.; y Machado, S. A. 2005.Electrochemical detection of the herbicide paraquat in natural water and citric fruit juices using microelectrodes. Anal Chim. Acta. 546:85 – 91.
Taguchi, V. Y.; Jenkins, S. W.; Crozier, P.W.; y Wang, D.T. 1998. Determination of diquat and paraquat in water by liquid chromatography (electrospray ionization) mass spectrometry. J. Am. Soc. Mass Spectrom 8:830– 839.
Referencias
Agencia de Protección Ambiental de los Estados Unidos (1997). Disponible en http://www.epa.gov/oppsrrd1/REDs/factsheets/0262fact.pdf visitado el 15-07-2014
Goviwatchai, N.; Johnson, D. C. 1985. Anal. Chim. Acta,215
Leoni V.; Caricchia, A. M.; Chiavarini, S. 1992. Multiresidue method for quantitation of organophosphorous pesticides in vegetable and animal foods. J. AOAC. Int. 75, 511-518.
Monk, P.M. S.; Turner, C.; Akhtar, S.P. 1999. Electrochim. Acta. 44-48
Nia, Y.; Qiua, P.;Kokotc, S. 2005. Simultaneous voltammetric determination of four carbamate pesticides with the use of chemometrics. Analytica Chimica Acta. 537, 321–330.
Official Methods of Analysis (AOAC). Edited by Kenneth Helrich, 15th edition, Validación 969.09, 1990, p. 227.
Qiu, P.; Nian. Y. 2008. Determination of ziram in vegetable samples by square wave voltammetry. Chinese Chemical Letters. 19, 1337–1340.
Ríos, J. 2012. Paraquat. [Artículo de Internet]. http://escuela.med.puc.cl/publ/guiaintoxicaciones/Paraquat.html [Consulta: 11 de julio de 2014]
Rühling, I.;Schäfer, H.; Ternes, W. 1999.HPLC online reductive scanning voltammetric detection of diquat, paraquat and difenzoquat with mercury electrodes. Fresenius J. Anal. Chem.364, 565–569.
Sierra, E. V.; Méndez, M. A.; Sarria, V. M.; Cortés, M. T. 2002. Electrooxidation of glyphosate on niquel and copper electrodes. Departamento de Química, Universidad de los Andes.
Souza, D.;Machado, S. A. 2005.Electrochemical detection of the herbicide paraquat in natural water and citric fruit juices using microelectrodes. Analytica Chimica Acta. 546, 85–91.
Stara, V.; Kopanica, M. 1984. Coll. Czech. Chem. Comm.49, 1282
Subbalakshmamma, M.; Sreedhar, M.; Jyothi, N. V.; Damodar, J.; Reddy, S. J. 1999 Trans.SAEST. 34,35; CAN 131: 239094.
Tomašević, A.; Milka, I.; Avramov I.; Petrović, S.; Jovanović, M.;Dušan, M. 2009.A study of the electrochemical behaviour of methomyl on a gold electrode in a neutral electrolyte. J. Serb. Chem. Soc.74 (5) 573–579.
Teófilo, R.; Reis, E. L.; Reisa, C.; Da Silva G. A.; Kubota, L. T.; Paiva J. F. 208. Glyphosate Determination in Soil, Water and Vegetables Using DPV Optimized by Response Surface Methodology. Portugaliae Electrochimica Acta. 26(4), 325-337.
Teófilo, R.; Reis, E. L.; Reisa, C.; Da Silva G. A.; Kubota, L. T. 2004. Experimental Design Employed to Square Wave Voltammetry Response Optimization for the Glyphosate Determination. J. Braz. Chem. Soc. 15(4), 865-871.
Cómo citar
APA
ACM
ACS
ABNT
Chicago
Harvard
IEEE
MLA
Turabian
Vancouver
Descargar cita
CrossRef Cited-by
1. Carlos Garcia, Hugo Romero, Humberto Ayala, Byron Lapo, Adriana Lam, Alexander Moreno. (2020). Cuantificación de ácido ascórbico en pimientos comercializados en la zona 7 del Ecuador aplicando voltamperometría. Cumbres, 3(2), p.71. https://doi.org/10.48190/cumbres.v3n2a7.
Dimensions
PlumX
Visitas a la página del resumen del artículo
Descargas
Licencia
Derechos de autor 2015 Acta Agronómica

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Política sobre Derechos de autor:Los autores que publican en la revista se acogen al código de licencia creative commons 4.0 de atribución, no comercial, sin derivados.
Es decir, que aún siendo la Revista Acta Agronómica de acceso libre, los usuarios pueden descargar la información contenida en ella, pero deben darle atribución o reconocimiento de propiedad intelectual, deben usarlo tal como está, sin derivación alguna y no debe ser usado con fines comerciales.